水稻小孢子發育過程中花藥超微結構研究
鄭 靈,肖培村,謝從簡,曹厚明,趙 鵬,陳 勇
(內江農業科學院雜交水稻科技開發中心,四川 內江 641000)
水稻小孢子發育過程中花藥超微結構研究
鄭 靈,肖培村,謝從簡,曹厚明,趙 鵬,陳 勇*
(內江農業科學院雜交水稻科技開發中心,四川 內江 641000)
【目的】水稻小孢子發育過程直接影響成熟花藥的育性,進行系統的細胞學研究揭示不同發育時期的結構特征具有重要意義。【方法】結合形態觀察與光鏡分析,運用掃描電鏡以及透射電鏡技術,分別對小孢子發育過程中水稻花藥外表皮角質層的發育過程以及內部細胞的形態發育進行了系統觀察和分析。【結果】①在花粉發育過程中,絨氈層細胞結構變化最為明顯。減數分裂前期,絨氈層細胞結構完整,隨著減數分裂的進行,絨氈層細胞質濃縮,細胞內呈現空泡化,內質網清晰可見,此后逐漸消失。②空泡期早期花藥表皮細胞外部逐漸增厚,最終形成具有保護功能且對花藥正常發育至關重要的角質層。③烏氏體作為絨氈層細胞向雄配子體運輸物資的直接通道,是在小孢子早期在絨氈層靠近雄配子體側開始形成,參與絨氈層細胞內脂肪酸以及其他營養物質的運輸。④在烏氏體形成的同時,小孢子外壁物質快速沉積,最后形成小孢子外壁結構。【結論】本研究觀察了花藥發育多個關鍵時期的細胞學特征,且發現了不同組織與功能相關的精細結構,對花藥發育的研究具有指導作用。
水稻;花藥發育;絨氈層細胞;角質層;烏氏體;小孢子外壁
【研究意義】開花植物的雄性生殖發育是一個非常復雜的生物學過程,起始于分化組織形成花藥。花藥的發育進程直接影響最終能否形成成熟的花粉,因此對其發育過程中結構特征的研究尤為重要。 【前人研究進展】在花藥形態建成以后,小孢子母細胞由四層細胞包裹,從外到內分別是外表皮、藥室內壁、中間層以及絨氈層。伴隨小孢子母細胞的發育,這四層細胞在形態上都隨之而變化,而其中外表皮角質層增厚、絨粘層細胞的降解、烏氏體以及小孢子外壁的形成對小孢子發育至關重要。對于水稻花藥發育超微結構研究已經積累了很多資料[1-3],且研究的較為細致。【本研究切入點】本研究運用常規石蠟切片、掃描電鏡與透射電鏡對水稻花藥發育進行了系統的觀察。【擬解決的關鍵問題】旨在發現小孢子發育階段花藥細胞的結構特征變化,其結果進一步認識了水稻小孢子發育過程中各種細胞的結構變化,揭示超微結構與組織細胞功能間的聯系,有助于開展雄性不育發育過程中的比較研究。
1 材料與方法
運用秈稻品種內恢9914,2016年正季種植于內江雜交水稻中心實驗基地,常規方法管理。從幼穗發育進入雌雄蕊原基形成期開始直至開花為止進行取樣,根據小穗不同長度處于不同發育時期的幼穗進行固定[4]。
不同發育時期的花藥采用戊二醛-鋨酸雙固定,LR white樹脂包埋,半薄切片,在光鏡下觀察確定發育時期,從中選出理想的各個時期的材料進一步制備超薄切片,在Tecnai G2F20型透射電子顯微鏡下觀察、拍照,加速電壓為80kV。
取不同發育時期的花藥采用戊二醛-鋨酸雙固定,經系列酒精脫水,醋酸異戊酯浸透,液體CO2臨界點干燥(日立HCP-2型),真空噴鍍金,標本置于JEM-1200 EX掃描電鏡觀察,拍照,加速電壓為20 kV。
2 結果與分析
2.1 小孢子的發育階段
根據幼穗不同發育階段的形態變化,確定了花藥發育減數分裂時期、小孢子時期、空泡期、二胞花粉時期以及成熟花粉時期相對應的穎花形態(圖1)。同時通過對相應時期的幼穗進行常規脫水包埋后半薄切片并用光鏡觀察確定花藥的時期(圖2)。
2.2 絨氈層結構變化
在減數分裂時期,絨氈層細胞體積明顯比表皮細胞、藥室內壁細胞、中層細胞都要大,且原生質濃,細胞器豐富,液泡少而小(圖3A)。其中線粒體分布于核的周圍,而質體多位于絨氈層的內切向壁一側,表現出極性分布現象。這時的絨氈層細胞結構完整,內切向壁稍厚。
在四分體時期到小孢子時期,絨氈層細胞中質體的數量增多,原生質體進一步濃縮,但其內細胞器仍十分豐富,其中以內質網最為明顯,呈高度發達狀態。絨氈層細胞在四分體時期后開始解體,出現單個或幾個連在一起隨機分布的小泡囊,細胞核開始解體,核膜消失。且這一時期絨粘層細胞內側區域分散著大量染色較深的脂肪體(圖3B)。
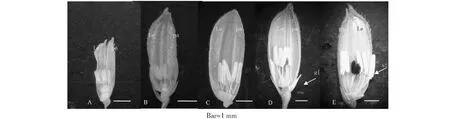
A:減數分裂時期;B:四分體時期;C:空泡期;D:二胞花粉時期;E:成熟花粉時期。Le外稃;pa內桴;gl穎片;st花藥圖1 水稻不同發育時期穎花解剖圖Fig.1 Anatomical diagram of rice flowers in different developmental stages
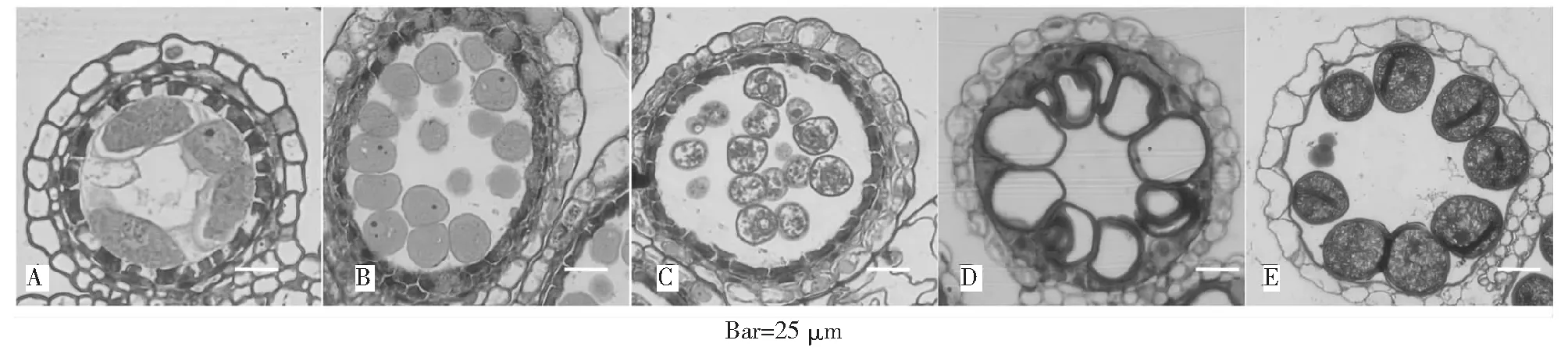
A:減數分裂(二分體)時期;B:四分體時期;C:小孢子時期;D:空泡期;E:成熟花粉時期圖2 水稻花藥不同發育時期石蠟切片觀察Fig.2 Paraffin serial section analysis of rice anther in different developmental stages
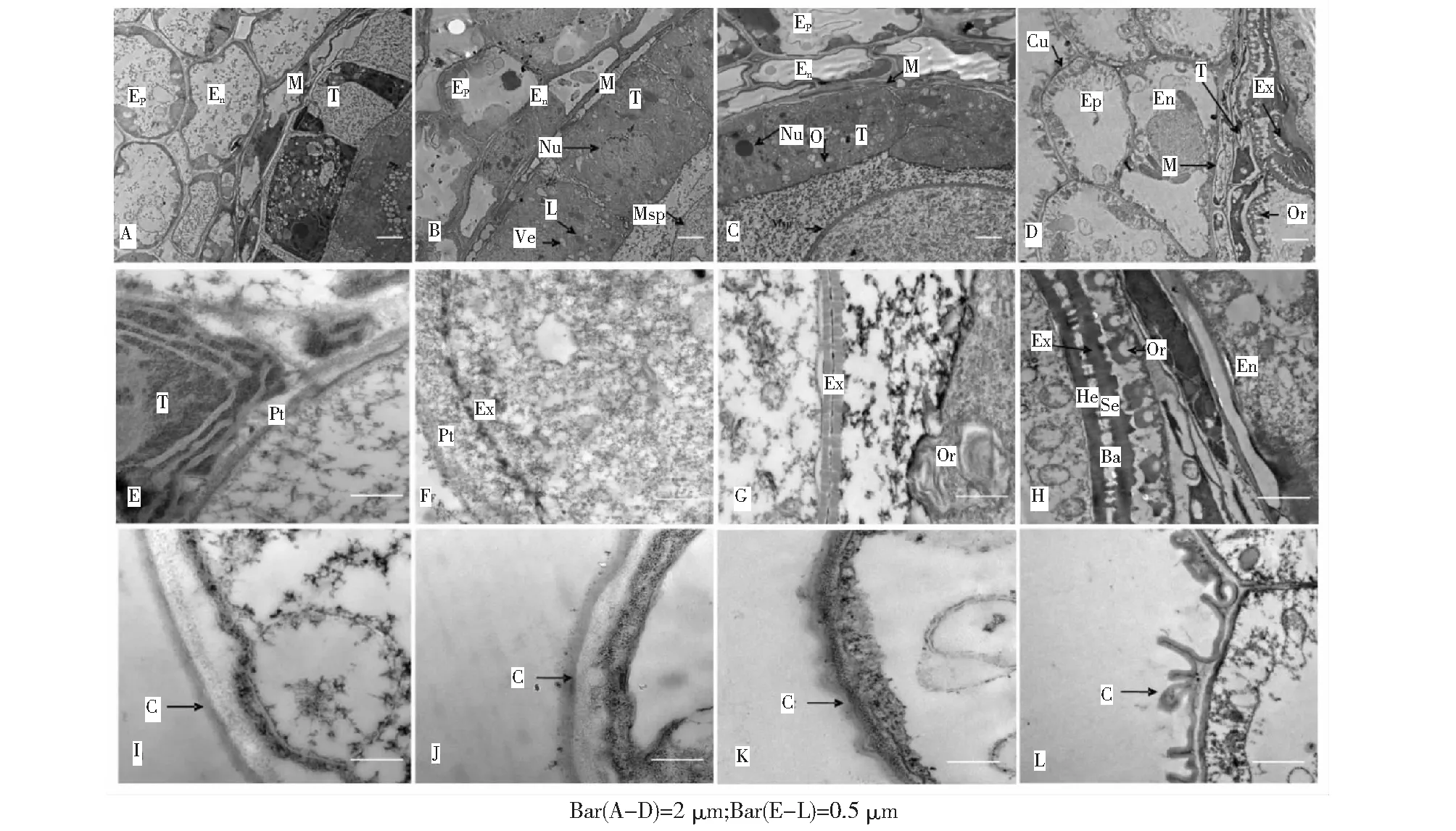
(A)到(D)為內恢9914 分別在減數分裂、小孢子時期、花粉有絲分裂早期、成熟花粉時期的橫切面;(E)到(H)為(A)到(D)中靠近絨氈層內側區域的放大分析;(I)到(L)為(A)到(D)中外表皮細胞外側區域的放大分析。Ba,孢子外壁柱狀層;C,角質層; En,藥室內壁細胞;Ep,外表皮細胞; Ex,孢子外壁;He,孢子外壁基層;L,脂肪體;M,中層細胞;Msp,小孢子細胞;Nu,細胞核;Or,烏氏體;P,花粉;Pl,質體;PM,質膜;PT,絨氈層內側;Se,孢子外壁覆蓋層;T,絨氈層;Ve,空泡圖3 花藥不同發育時期透射電鏡觀察Fig.3 Transmission electron microscopy analyses of rice anther in developing stages
在小孢子晚期(空泡期)到花粉有絲分裂早期絨氈層細胞核消失,核物質滲透到細胞質中,細胞徑向厚度變薄且出現前烏氏體結構,細胞器降解,整個絨氈層細胞幾乎成透明狀,但絨氈層細胞間界限清晰,質膜沒有降解。同時絨粘層靠近烏氏體內側區域脂肪體數目有所降低(圖3C)。
當花粉完全成熟時,絨氈層細胞已完全退化解體。僅留一條小而窄的帶狀殘留,中層細胞此時也已完全解體,殘留的中層細胞壁和絨粘層細胞內切壁一起形成疊合的“壁”包裹著花粉。絨粘層細胞靠近成熟烏氏體一側脂肪體消失(圖3D、3H)。
2.3 烏氏體的發育
在小孢子中期絨粘層細胞開始解體、細胞徑向壁變薄時,前烏氏體已部分暴露于藥室腔,前烏氏體表面開始沉積孢粉素物質(圖3C、圖3G),絨氈層細胞內切向面的質膜上也有前烏氏體分布,其上孢粉素物質同樣有沉積。
隨著花粉的進一步發育,孢粉素物質的逐漸積累,烏氏體發育逐漸成熟,均勻地排列在藥室腔內表面上。成熟烏氏體中央著色淺,而四周著色較深,其上不均勻地沉積孢粉素物質(圖3D、圖3H)。最終形成類似馬蹄形的結構。
2.4 小孢子外壁的沉積
早在四分體時期胼胝質壁就包裹在四分體細胞外圍,在此基礎上,隨著發育的進行,小孢子早期小孢子的外壁就形成了可以分辨的帶狀結構,其帶狀結構上附著了很多黑色的顆粒(圖3F),同時黑色顆粒也存在于小孢子的周圍。
等到小孢子中期到空泡期時,孢子外壁胞粉素快速沉積,形成了由兩側電子致密帶以及中間空隙形成的帶狀柵欄結構,到空泡期后期時兩邊的電子致密帶明顯加寬,結果分別形成了孢子外壁的覆蓋層、柱狀層、基層(圖3G)。至此孢子外壁基本形成,即由中間的透明帶和兩邊較寬的電子致密帶組成的帶狀柵欄結構。
花粉發育的后期,孢子外壁的外形基本保持不變,但壁物質沉積增多,而表現為更加致密。中間柱狀層透明帶區清晰可見且覆蓋層、基層中間有柱狀通道連接(圖3H)。
2.5 角質層的形成
在絨氈層細胞通過前烏氏體往藥室腔供給胞粉素以形成外孢壁的同時,外表皮細胞細胞壁外也逐漸形成一層著色較淺的結構(圖3I-J),該結構就是角質層。在四分體時期角質層還只是薄薄的覆蓋在細胞壁外,但到了小孢子時期、空泡期早期就逐漸加厚,形成靠近內側著色較深的角質、靠近外側的蠟質結構,而且外部的蠟質堆積成脊狀結構(圖3K)。到了成熟期角質隨著積累的過程著色更深,而蠟質則由脊狀結構發育成棘狀突起(圖3L)。為進一步直觀的觀察花藥發育過程外表皮細胞壁的形態變化過程,筆者對處于3個重要發育時期的花藥進行掃描電鏡觀察,其結果驗證的透射電鏡的結果:在減數分裂以及四分體時期花藥的表皮細胞壁上未完全形成,細胞小且分界不明顯;待花藥發育到小孢子時期,細胞脹大、輪廓清晰可見但仍然很小、且表面光滑無物質堆積;當進入空泡期,表皮細胞充分伸長、表面形成致密的網狀結構;在成熟花粉中網狀結構更加致密(圖4)。

(A)到(C)為內恢9914 外表皮細胞角質層分別在減數分裂、小孢子時期、空泡期后期的掃描圖片圖4 花藥發育各個時期掃描電鏡觀察Fig.4 Scanningelectron microscopy analyses of rice anther in developing stages
3 討 論
3.1 絨氈層細胞在花藥的發育過程中具有重要功能
處于花藥壁四層體細胞中最里層,絨氈層直接與花藥藥室中的花粉母細胞及以后發育中的花粉接觸,在小孢子到成熟花粉發育的過程中扮演重要的角色[5],是將孢子體組織的物質輸往雄配子體的中轉站。作為分泌性細胞,絨氈層提供四分體胼胝質降解釋放小孢子細胞所必須的酶類、花粉發育所需要的營養物質、以及花藥壁發育所需要的胞粉素等長鏈脂肪酸[6]。本研究觀察到四分體時期脂肪粒大量存在于絨氈層細胞內切向壁,到花藥有絲分裂早期數目明顯下降,直至最終消失。從而直接從形態上驗證了絨粘層細胞在合成大量脂肪類物質的同時會伴隨小孢子的發育過程而變化。絨粘層細胞在花粉發育晚期啟動細胞程序性死亡,在細胞降解的過程中,細胞內結構相繼消失。在已報道的有關雄性不育研究中,常因為絨氈層的提前降解[7-8]、延遲降解[9]或不降解而導致雄性敗育。
3.2 烏氏體可能是絨氈層細胞內營養物質運往藥室腔的直接通道
在絕大多數植物中球形或馬蹄形的烏氏體是分泌性絨粘層細胞的標志,早在1865年烏氏體就被Rosanoff發現[10],但對于其功能的研究至今尚不清楚,有人認為烏氏體只是絨粘層代謝的副產物,但也有人證明烏氏體參與到胞粉素、脂肪酸衍生復合物、以及苯丙酯類從絨粘層運輸到花藥外壁形成花藥壁的過程[11]。由于結構太小,又和絨粘層細胞緊密結合,烏氏體一直不能被分離,所以其生化性質一直沒能被研究,直到RAFTIN蛋白的發現以及編碼基因功能研究才直接證明烏氏體的運輸功能[12]。在小麥中RAFTIN蛋白存在于前烏氏體中,并且在烏氏體中聚集,最后轉移到小孢子壁上參與外孢壁的形成。伴隨著花藥絨粘層的濃縮與降解過程,本研究發現前烏氏體到成熟烏氏體的發育過程中大量脂肪體分散在其周圍,從而間接證明了烏氏體可能參與到營養物質從絨粘層到藥室腔的運輸。
3.3 角質層和外孢壁對花藥起到保護作用
高等植物具有高效和有效的繁殖能力,在不斷的進化過程中,形成了兩道屏障,用以保護小孢子和花粉細胞抵御各種環境脅迫和生物壓迫。首先是花藥壁的四層細胞,特別是覆蓋有角質層的外表皮;其次是由外孢壁構成的花粉外壁,在花粉釋放后抵抗環境脅迫中起到重要的作用[13]。
角質層是覆蓋在植物地上部分最表層的保護層,直接與外界環境接觸。角質層由最外層的上表皮蠟質和角質組成,上表皮蠟質主要由可溶性的脂肪酸、烷烴、脂肪醇、酮類和酯類組成,作為連續的網狀分布于植物體的最表面。角質主要由羥基脂肪酸聚合形成的不可溶性多聚酯組成。角質層的重要功能是降低通過植物表面的水分散失,此外,角質層還在防止紫外線輻射傷害、抵抗病蟲害的侵入方面起重要作用,也有研究報道角質層的蠟質含量與花粉育性和其他農藝性狀有關[14-15]。
4 小 結
在水稻花藥不同發育時期,花藥各組織細胞具有特定的發育進程,同時表現出與之相對應的精細結構,本研究通過解剖、石蠟切片、掃描電鏡以及透射電鏡分別在器官發育的關鍵時期從整體結構特征到細胞形態進行了詳細的觀察和描述,發現了絨氈層細胞、上表皮細胞以及烏氏體等多種細胞組織的超微結構特征,對花藥的發育系統研究具有重要意義。
[1]Sun J,Zhu Y G. The ultrastructure of pollen and anther wall in the development of Hubei photoperiod-sensitive genic male sterile rice[J]. ActaAgron Sin, 1995, 21(3): 364-367.
[2]傅建華,劉志玲,陳良碧,等. 水稻花藥絨氈層及烏氏體的超微結構觀察[J]. 生命科學研究,1999,3(2):155-160.
[3]馮九煥,盧永根,劉向東,等. 水稻花粉發育過程及其分期[J]. 中國水稻科學,2001,15(1): 21-28.
[4]Ming-Der Huang,Fu-Jin Wei. Analyses of Advanced Rice Anther Transcriptomes Reveal Global Tapetum Secretory Functions and Potential Proteins for Lipid ExineFormation[J]. Plant Physiology, 2009, 149: 694-707.
[5]ShivannaK R, Cresti M, Ciampolini F. Pollen Biotechnology for Crop Production and Improvement[M]. Cambridge, UK:Cambridge University Press,1997:15-39.
[6]Pacini E, Franch G G, Hesse M. The tapetum:Itsform,function,and possible phylogeny in Embryophyta[J]. Plant Syst. Evol., 1985, 149: 155-185.
[7]Loukides C A, Broadwater A H, B edinger P A. Two new malesterile mutants ofZeamays(Poaceae) with abnormal tapetal cell morphology[J]. Amer J Bot, 1995, 82(8): 1017-1023.
[8]MassariME,MurreC.Helix-loop-helix proteins:Regulators of transcription in eukaryotic organisms[J]. Mol. Cell. Biol., 2000, 20: 429-440.
[9]Li N, Zhang D S, Liu H S, et al. The rice tapetum degeneration retardation gene is required for tapetum degradation and anther development[J]. Plant Cell, 2006, 18: 2999-3014.
[10]Heslop-Harrison J. Anther carotenoids and the synthesis of sporopollenin[J]. Nature, 1968, 220: 605.
[11]Huysmans S, El-Ghazaly, G.Smets E. Orbicules in angiosperms: morphology, function,distribution and relation with tapetum types[J]. Bot.Rev.,1998, 64: 240-272.
[12]Aiming Wang, Qun Xia, Wenshuang Xie. The classical Ubisch bodies carry a sporophytically produced structural protein(RAFTIN)that is essential for pollen development[J]. PNAS., 2003, 24: 14487-14492.
[13]PiffanelliP, Ross J H, Murphy D J. Biogenesis and function of the lipidic structures of pollen grain Sex[J].Plant Reprod.,1998,11:65-80.
[14]Jung K H, Han M J, Lee D Y, et al. Wax-deficient anther1 is involved in cuticle and wax production in rice anther walls and is required for pollen development[J]. Plant Cell, 2006, 18:3015-3032.
[15]Li H, Pinot F, Sauveplane V, et al. Cytochrome P450 family member CYP704B2 catalyzes the v-hydroxylation of fatty acids and is required for anther cutin biosynthesis and pollen exine formation in rice[J]. Plant Cell, 2010, 22: 173-190.
UltrastructuralObservationsofRicePollenDevelopments
ZHENG Ling, XIAO Pei-cun, XIE Cong-jian, CAO Hou-ming, ZHAO Peng, CHEN Yong*
(Hybrid Rice Research Center, Neijiang Academy of Agricultural Science, Sichuan Neijiang 641000, China)
【Objective】The development of microspores directly affected the fertility of mature anthers, and it is critical important to carry out the systematic cytological study which reveals the structural characteristics of different developmental stages.【Method】In combination with morphology observation and light microscope analysis, by using scanning electron microscopy (SEM) and transmission electron microscopy (TEM) observation, an extensively cytological study of rice anther outer epidermis cutin layer and the internal cells was conducted on the pollen development of SI HUI 498, an indica cultivar. 【Result】(i) During pollen development process, ultrastructural change of tapetum was most dramatic: Tapetum cells had complete structure before meiosis; Following meiosis, tapetum cytoplasm condensed and vacuoles formed; The endoplasmic reticulums population rapidly increased and were clearly visible. These changes mean that endoplasmic reticulum may play a major role in the pollen development. (ii) From early vacuolated pollen stage, cell wall of anther outer epidermis gradually thickened, and finally cuticle formed protecting the microspore from various environmental and biological stresses. (iii)Orbicule, as nutrition direct access from tapetum cells to male gametophytes, was not visible until early spore pollen stage, participating in transportation of fatty acids and protein from tapetum cells. (iv)At the same time of orbicule formation, sporopollenins begin to deposit on the surface of spores and finally produced the structure of exine. 【Conclusion】Our results uncovered the cytological characteristics of anther development of several key development stages and found that the fine structure associated with their distinct functions in different tissues, which could guide the study of anther development.
Rice; Pollen development; Tapetum cells; Cuticle; Orbicule; Exine
1001-4829(2017)12-2624-05
10.16213/j.cnki.scjas.2017.12.002
2017-01-20
四川省十三五水稻育種攻關項目“引領性水稻育種材料與方法創新”(2016NYZ0028)
鄭 靈(1986-) ,女,四川內江人,碩士,農藝師,主要從事分子生物輔助育種及優質多抗恢復系選育工作,Tel: 13890539812,E-mail: zl86311@163.com,*為通訊作者, E-mail: chengyongnj@163.com。
S511
A
(責任編輯陳 虹)

