水飛薊素對丙烯酰胺誘導人肝癌細胞氧化損傷的保護作用
李 亮,趙筱鐸,劉 巍,孫紅洋,趙洪宇,邵美麗,*
水飛薊素對丙烯酰胺誘導人肝癌細胞氧化損傷的保護作用
李 亮1,趙筱鐸1,劉 巍2,孫紅洋1,趙洪宇1,邵美麗1,*
研究水飛薊素對人肝癌細胞系(human hepatocellular liver carcinoma cell line,HepG2)增殖的影響以及對食品加工過程中產生的丙烯酰胺所致肝細胞毒性的預防效果,同時對其保護機制進行探討。通過噻唑藍法檢測水飛薊素對HepG2細胞增殖的影響和對丙烯酰胺誘發HepG2細胞毒性的保護效果;利用熒光探針法對HepG2細胞內活性氧的變化進行檢測,并運用比色法分別檢測細胞內脂質、蛋白質及DNA的氧化損傷標志物(丙二醛、蛋白羰基和8-羥基脫氧鳥苷)含量;利用酶活力試劑盒檢測細胞內過氧化氫酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)活力的變化。結果顯示,12~96 μg/mL的水飛薊素對HepG2細胞無毒性;水飛薊素可以抑制丙烯酰胺引起的細胞存活率降低和氧自由基水平升高,減少丙烯酰胺對脂質、蛋白質和DNA的氧化損傷,并提高細胞內抗氧化物酶CAT、SOD和GSH-Px活力。研究證明,水飛薊素能夠緩解丙烯酰胺對肝細胞造成的氧化損傷。
水飛薊素;丙烯酰胺;人肝癌細胞系
丙烯酰胺在日常生活中主要應用于工業領域,對人或動物具有神經毒性、生殖毒性、遺傳毒性和致癌性[1-2]。近些年來有研究發現,含淀粉類的食品經高溫加工(≥120 ℃)會形成丙烯酰胺[3-5],抑制食品中丙烯酰胺對人類造成的損傷是非常必要的。有實驗證明,丙烯酰胺還具有明顯的肝毒性,這與丙烯酰胺能夠誘導細胞產生過量的活性氧(reactive oxygen species,ROS),從而破壞細胞內的氧化還原平衡,造成細胞損傷或凋亡有著密切聯系[6-7]。正常情況下,ROS產生于線粒體和免疫系統,可以抵抗來自病原菌的侵害。但過量的ROS會對多種生物分子包括蛋白質、脂質和DNA具有損傷作用,引發多種退行性疾病[8-10]。此外,丙烯酰胺在細胞內會被細胞色素P450轉化成環氧丙酰胺(glycidamide,GA),GA對細胞內蛋白質、DNA的攻擊和對還原型谷胱甘肽(glutathione,GSH)的消耗均比丙烯酰胺強[11-12]。
植物化學物質能夠有效地保護細胞免受因過量ROS引起的氧化損傷,且因自身具有良好的藥用價值而被廣泛關注[13]。從奶薊草中提取的水飛薊素是一種天然黃酮類混合物,約由50%水飛薊賓、20%水飛薊亭、10%異水飛薊素、5%異水飛薊賓和15%其他有機聚合物構成。水飛薊素作為一種常用的保肝成分,具有強抗炎和抗氧化活性[14-15]。人肝癌細胞瘤細胞系(human hepatocellular liver carcinoma cell line,HepG2)具有增殖快、永生化等特性,且含有大部分肝細胞酶系,例如Ⅰ相和Ⅱ相解毒酶,常被用于作為探究化學物質毒性及細胞保護作用的模型[16-17]。本研究利用丙烯酰胺誘導建立HepG2細胞的氧化損傷模型,探討水飛薊素預防丙烯酰胺肝毒性的初步作用機制,從而為降低食品中丙烯酰胺對人類造成的損害提供新思路。
1 材料與方法
1.1 材料與試劑
HepG2細胞由哈爾濱商業大學藥理學院惠贈。
水飛薊素(純度≥90%) 美國Sigma公司;丙烯酰胺(純度≥99.9%)、噻唑藍(3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide,MTT)(純度>98%) 美國Amresco公司;RPMI-1640完全培養基美國Gibco公司;胎牛血清 杭州四季青有限公司;BCA蛋白濃度檢測試劑盒、ROS檢測試劑盒 上海碧云天生物技術有限公司;丙二醛(malondialdehyde,MDA)檢測試劑盒、過氧化氫酶(catalase,CAT)檢測試劑盒、超氧化物歧化酶(superoxide dismutase,SOD)檢測試劑盒、谷胱甘肽過氧化物酶(glutathione peroxidase,GSH-Px)檢測試劑盒、蛋白質羰基含量檢測試劑盒 南京建成生物工程研究所;人8-羥基脫氧鳥苷(8-hydroxy-2’-deoxyguanosine,8-OHdG)檢測試劑盒中國Summus公司;其他試劑均為分析純。
1.2 儀器與設備
Model-680酶標儀 美國伯樂公司;650-60熒光分光光度計 日本日立公司。
1.3 方法
1.3.1 細胞培養和預處理
HepG2細胞培養于含10%胎牛血清、1%雙抗(青霉素和鏈霉素)的1640培養基中。培養條件為37 ℃、5% CO2,選取對數生長期細胞進行實驗。細胞預處理及分組如下:對照組:正常培養的HepG2細胞;氧化應激模型組:8 mmol/L丙烯酰胺干預24 h培養的HepG2細胞;實驗組:分別用12、24、48、96 μg/mL水飛薊素提前干預6 h,再用8 mmol/L丙烯酰胺干預24 h,對應制成實驗組1、2、3、4。
1.3.2 MTT法測定細胞存活率
取對數生長期HepG2細胞按1×104個/孔的密度接種于96 孔細胞板中,37 ℃、5% CO2條件過夜培養后,分別向每孔中加入0.00、1.25、2.50、5.00、10.00、20.00 mmol/L丙烯酰胺干預24 h,每組設置3 個平行。再向各孔中加入20 μL MTT,37 ℃避光孵育4 h,棄去每孔中培養液,加入150 μL 二甲基亞砜,避光振蕩10 min,于570 nm波長處測定各組OD值,并按式(1)計算各組細胞存活率。
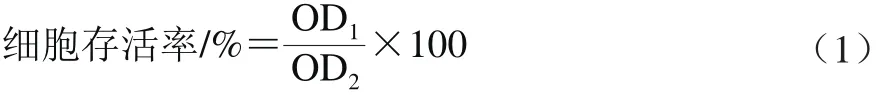
式中:OD1為加入各濃度丙烯酰胺的細胞培養液OD值;OD2為未加入丙烯酰胺的細胞培養液OD值。
取對數生長期HepG2細胞按1×104個/孔的密度接種于96 孔細胞板中,37 ℃、5% CO2條件過夜培養后,分別向每孔中加入0、12、24、48、96 μg/mL水飛薊素干預24 h,按照上述MTT法依次進行測定,每組設置3 個平行。并按式(2)計算各組細胞存活率。

式中:OD3為加入各質量濃度水飛薊素的細胞培養液OD值;OD4為未加入水飛薊素的細胞培養液OD值。
再利用上述MTT法依次對1.3.1節中對照組、模型組和實驗組進行測定,并按照式(3)計算各組細胞存活率。

1.3.3 氧化指標水平的測定
1.3.3.1 ROS相對水平測定
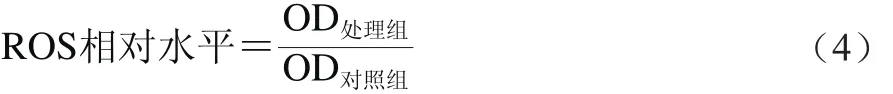
取對數生長期HepG2細胞,按實驗需求給予不同因素處理,分別制成對照組、模型組、實驗組1~4。棄掉細胞培養液,每孔加入2 mL 10 μmol/L的熒光探針2’,7’-二氯熒光黃雙乙酸鹽(2’,7’-dichlorodihydrofluorescein diacetate,DCFH-DA),37 ℃細胞培養箱內孵育20 min。無血清細胞培養液洗滌細胞3 次后,收集細胞,用熒光分光光度計檢測,激發波長為488 nm,發射波長為525 nm。按式(4)計算ROS相對水平。
1.3.3.2 氧化損傷標志物含量測定
MDA、蛋白羰基和8-OHdG分別是細胞內脂質、蛋白質和DNA氧化損傷的標志物[18-20]。將對照組、模型組、實驗組1~4的培養液1 000 r/min離心10 min,收集細胞,預冷的磷酸鹽緩沖液洗滌3 次,加入細胞裂解液對細胞進行裂解,2 500 r/min離心10 min收集細胞上清液。用BCA蛋白質量濃度檢測試劑盒測定細胞上清液蛋白質量濃度,然后分別按照MDA、蛋白羥基和8-OHdG檢測試劑盒上的方法測定MDA、蛋白羥基和8-OHdG含量,結果分別用nmol/mg pro、nmol/mg pro和μg/mg pro表示。
1.3.4 CAT、SOD和GSH-Px活力的測定
取對照組、模型組、實驗組1~4培養液,1 000 r/min離心10 min收集細胞,預冷的磷酸鹽緩沖液洗滌3 次,加入細胞裂解液,冰浴條件下對細胞進行裂解后,2 500 r/min離心10 min收集細胞上清液。BCA蛋白質量濃度檢測試劑盒測定上清液蛋白質量濃度,并按照CAT、SOD和GSH-Px檢測試劑盒上的方法測定CAT、SOD和GSH-Px活力,用U/mg pro表示。
1.4 數據統計處理
實驗數據采用SPSS 11.0統計軟件進行分析,結果用 ±s表示。并對實驗結果進行t檢驗,P<0.05表示差異顯著。
2 結果與分析
2.1 丙烯酰胺對HepG2細胞的毒性作用
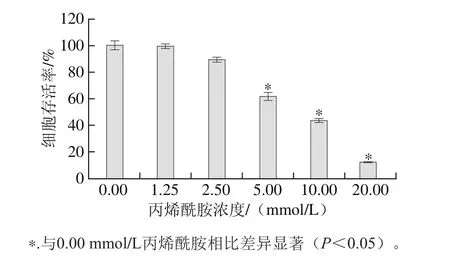
圖1 丙烯酰胺對HepG2細胞的毒性作用Fig. 1 Cytotoxic effect of acrylamide on HepG2 cells
MTT法檢測丙烯酰胺對HepG2細胞的毒性作用結果如圖1所示。HepG2細胞的存活率隨著丙烯酰胺濃度的增加而逐漸減少,并通過Graphpad Prism軟件計算丙烯酰胺作用24 h的半數致死劑量(half maximal inhibitory concentration,IC50)為(8.04±0.37) mmol/L,故本實驗選用8 mmol/L作為后續探究中丙烯酰胺的給藥濃度。
2.2 水飛薊素對HepG2細胞增殖的影響
利用MTT法檢測水飛薊素對HepG2細胞增殖的影響,結果如圖2所示。HepG2細胞在不同質量濃度(12、24、48、96 μg/mL)的水飛薊素作用下,細胞存活率與無水飛薊素干預正常條件培養的HepG2細胞相比無顯著差異。說明水飛薊素對HepG2細胞增殖沒有影響,為后續探究水飛薊素對丙烯酰胺誘導HepG2細胞毒性的抑制作用提供了保障。
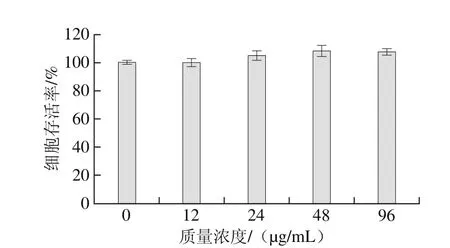
圖2 水飛薊素對HepG2細胞增殖的影響Fig. 2 Effect of silymarin on the proliferation of HepG2 cells
2.3 水飛薊素對丙烯酰胺所致HepG2細胞毒性的影響
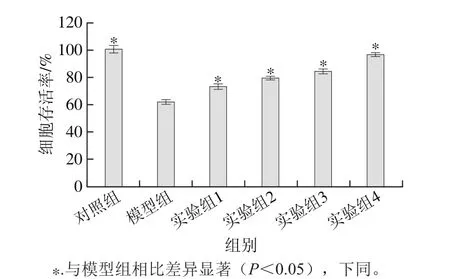
圖3 水飛薊素對丙烯酰胺誘導HepG2細胞毒性的影響Fig. 3 Effect of silymarin on acrylamide-induced cytotoxicity in HepG2 cells
如圖3所示,對照組細胞存活率顯著高于模型組(P<0.05),說明丙烯酰胺對HepG2細胞增殖具有抑制作用。而實驗組1~4的細胞存活率相比模型組顯著增加(P<0.05),說明水飛薊素能顯著緩解HepG2細胞受丙烯酰胺引發的細胞毒性,且與質量濃度呈正相關。
2.4 水飛薊素對丙烯酰胺誘導損傷的HepG2細胞氧化指標的影響
2.4.1 ROS相對水平
細胞內過量ROS的產生能使細胞發生氧化應激現象,從而對細胞造成氧化損傷,所以細胞內ROS水平能直接反映細胞氧化損傷的程度[21]。運用熒光探針DCFH-DA法,對各組HepG2細胞中ROS相對水平進行測定,結果如圖4所示。實驗組1~4和對照組的ROS相對水平均顯著低于模型組(P<0.05)。結合MTT法的結果可知,丙烯酰胺能通過誘發大量ROS的生成,對HepG2細胞造成損傷,而水飛薊素則通過降低細胞中ROS的水平對HepG2細胞起到保護的效果,且與質量濃度呈正相關。

圖4 水飛薊素對丙烯酰胺誘導HepG2細胞內ROS相對水平的影響Fig. 4 Effects of silymarin on relative ROS level in acrylamide-induced HepG2 cells
2.4.2 MDA、蛋白羰基鍵和8-OHdG的含量
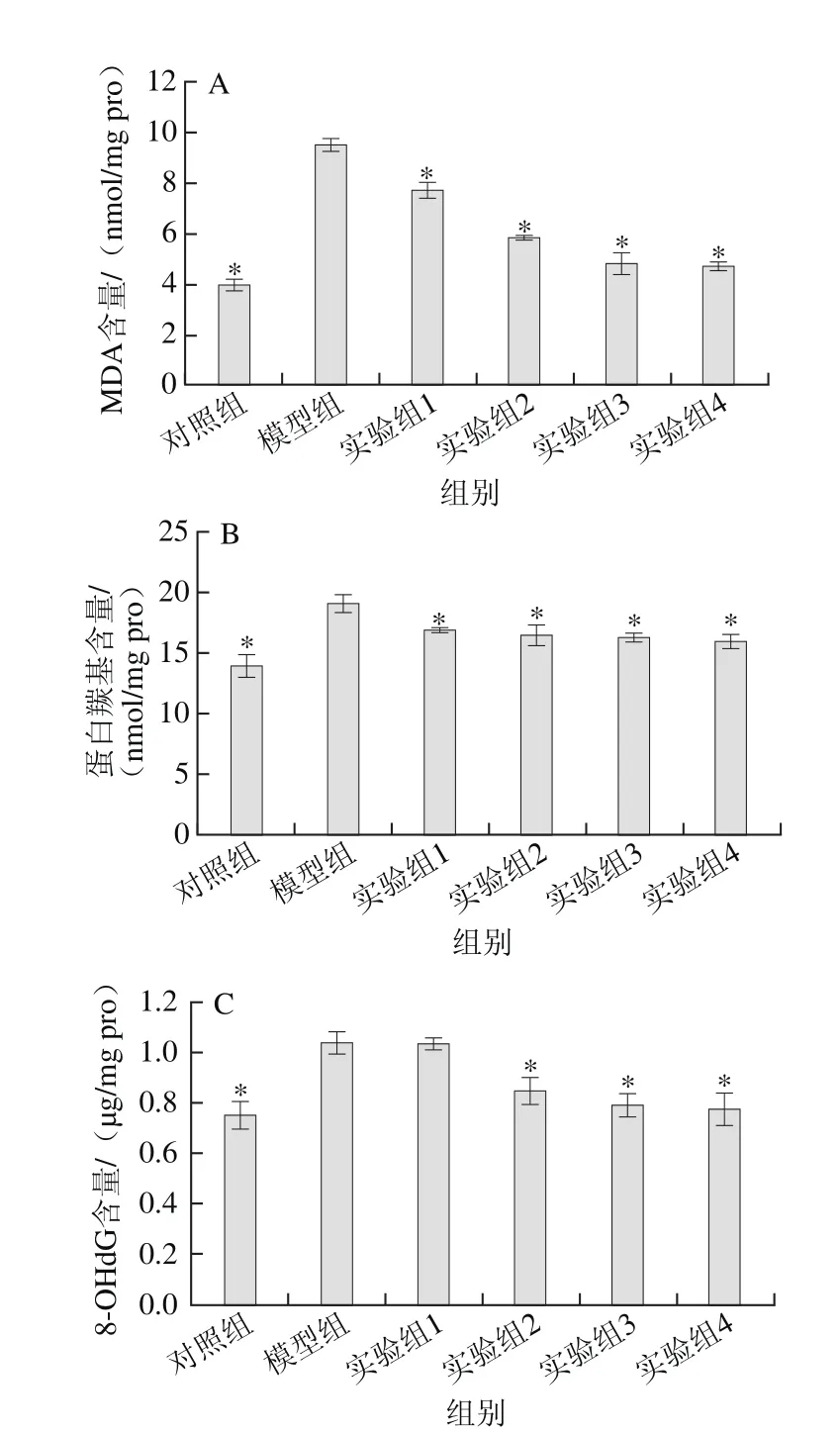
圖5 水飛薊素對丙烯酰胺誘導HepG2細胞內MDA(A)、蛋白羰基(B)、8-OHdG(C)含量的影響Fig. 5 Effect of silymarin on the contents of MDA (A), protein carbonyl (B)and 8-OHdG (C) in acrylamide-induced HepG2 cells
MDA是細胞內脂質的氧化損傷標志物,由細胞膜上的脂質與ROS發生的過氧化反應生成,能破壞甚至摧毀細胞膜[22]。MDA能和硫代巴比妥酸反應生成紅色物質,利用這一性質對HepG2細胞內的MDA含量進行測定。如圖5A所示,模型組的MDA含量顯著高于對照組(P<0.05),這與丙烯酰胺能誘發細胞產生大量ROS密切相關;而實驗組隨著水飛薊素質量濃度的增加逐漸減少實驗組HepG2細胞內的MDA含量,這一結果與前面細胞內ROS相對水平測定的結果相符。由此說明,水飛薊素能夠減少丙烯酰胺對HepG2細胞內脂質的氧化損傷。
蛋白羰基是ROS或活性氮氧化蛋白的產物,通常用來衡量蛋白質的氧化損傷程度[23]。運用2,4-二硝基苯肼比色法對HepG2細胞內的蛋白羰基含量進行檢測。如圖5B所示,所有實驗組和對照組的蛋白羰基含量顯著低于模型組(P<0.05)。表明水飛薊素能夠抑制丙烯酰胺對HepG2細胞內蛋白質的氧化損傷,且與水飛薊素的質量濃度呈正相關。
8-OHdG是ROS誘發細胞內DNA羥基化形成的,具有修復鳥嘌呤氧化損傷的功能,被公認為一個合適的鑒定DNA氧化損傷標志物[24]。通過酶聯免疫吸附測定法檢測HepG2細胞內8-OHdG含量,由圖5C可知,除實驗組1外其他組別的8-OHdG含量均顯著低于模型組(P<0.05)。結果證明,水飛薊素能夠抑制丙烯酰胺對HepG2細胞內DNA的氧化損傷,且呈劑量依賴性。
綜上所述,水飛薊素對丙烯酰胺造成HepG2細胞內脂質、蛋白質和DNA的氧化損傷均能起到保護作用,且與水飛薊素質量濃度呈正相關。
2.5 水飛薊素對丙烯酰胺誘導損傷的HepG2細胞抗氧化能力的影響
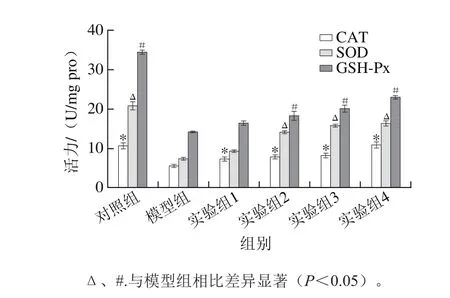
圖6 水飛薊素對丙烯酰胺誘導HepG2細胞內CAT、SOD和GSH-Px活力的影響Fig. 6 Effect of silymarin on the activities of CAT, SOD and GSH-Px in acrylamide-induced HepG2 cells
CAT、SOD和GSH-Px是細胞內3 種重要的抗氧化物酶,常被用于機體抗氧化損傷作用方面的研究。CAT能促使細胞中有害的H2O2轉化為無毒的氧和水[25];SOD是一種金屬酶,是機體內抵抗ROS損傷的第一道防御關卡,可以使有毒的超氧化自由基降解為氧和過氧化物[26];GSH-Px在體內能通過GSH來調控ROS以及消除有機過氧化物[27],而GSH是一種內源性巰基化合物,對維護細胞的氧化還原平衡和氨基酸平衡、調控細胞基因及胞內信號的轉導起到重要作用,與多種蛋白的結構、功能和穩定性相關[28]。有研究發現,丙烯酰胺在體內的代謝也與GSH密切相關,丙烯酰胺在體內一部分被氧化成GA,GA和丙烯酰胺都能在谷胱甘肽-S-轉移酶的作用下,結合GSH形成GSH-丙烯酰胺復合物,最后降解為硫醇尿酸[29]。對HepG2細胞內抗氧化物酶CAT、SOD和GSH-Px活力的測定結果由圖6可知,實驗組1~4和對照組的CAT活力均顯著高于模型組(P<0.05),而除實驗組1外其余組別的SOD和GSH-Px活力顯著大于模型組(P<0.05)。說明水飛薊素能通過提高胞內CAT、SOD和GSH-Px的活力來保護HepG2細胞抵抗丙烯酰胺誘導的損傷作用,且與水飛薊素的質量濃度呈正相關性,水飛薊素的這一功能可能與細胞內的一種核轉錄因子Nrf2相關[30]。
3 結 論
本實驗探究水飛薊素在保護肝細胞抵抗丙烯酰胺誘導的氧化損傷方面的功能。研究發現水飛薊素能通過降低細胞內ROS的水平,改善抗氧化物酶CAT、SOD和GSH-Px的活力,對丙烯酰胺造成HepG2細胞內脂質、蛋白質和DNA的氧化損傷起到抑制效果,且與水飛薊素劑量呈正相關性。MTT法測定結果顯示經不同質量濃度水飛薊素處理的HepG2細胞的存活率與正常培養細胞無統計學意義上的差異,這說明水飛薊素對HepG2細胞增殖沒有影響。本研究證實水飛薊素能預防丙烯酰胺的肝毒性,并對其作用機制進行了初步探究,為降低食品中丙烯酰胺對機體造成損傷的風險提供了一條途徑。
[1] XU Y, CUI B, RAN R, et al. Risk assessment, formation, and mitigation of dietary acrylamide: current status and future prospects[J].Food and Chemical Toxicology, 2014, 69: 1-12. DOI:10.1016/j.fct.2014.03.037.
[2] ZHAO M, WANG F S, HU X S, et al. Effect of acrylamide-induced neurotoxicity in a primary astrocytes/microglial co-culture model[J].Toxicology in Vitro, 2017, 39: 119-125. DOI:10.1016/j.tiv.2016.11.007.
[3] PEDRESCHI F, MARIOTTI M S, GRANBY K. Current issues in dietary acrylamide: formation, mitigation and risk assessment[J].Journal of the Science of Food and Agriculture, 2014, 94(1): 9-20.DOI:10.1002/jsfa.6349.
[4] RIBOLDI B P, VINHAS á M, MOREIRA J D. Risks of dietary acrylamide exposure: a systematic review[J]. Food Chemistry, 2014,157(15): 310-322. DOI:10.1016/j.foodchem.2014.02.046.
[5] MOTTRAM D S, WEDZICHA B L, DODSON A T. Acrylamide is formed in the Maillard reaction[J]. Nature, 2002, 419: 448-449.DOI:10.1038/419448a.
[6] CHEN W, SU H M, XU Y, et al. Protective effect of wild raspberry (Rubus hirsutus Thunb.) extract against acrylamide-induced oxidative damage is potentiated after simulated gastrointestinal digestion[J]. Food Chemistry,2016, 196(1): 943-952. DOI:10.1016/j.foodchem.2015.10.024.
[7] SHAN X Y, LI Y, MENG X, et al. Curcumin and (-)-epigallocatechin-3-gallate attenuate acrylamide-induced proliferation in HepG2 cells[J].Food and Chemical Toxicology, 2014, 66: 194-202. DOI:10.1016/j.fct.2014.01.046.
[8] MURPHY M P. How mitochondria produce reactive oxygen species[J].Biochemical Journal, 2009, 417(1): 1-13. DOI:10.1042/BJ20081386.
[9] FENG X J, YU W, ZHOU F F, et al. A novel small molecule compound diaporine inhibits breast cancer cell promoting ROS generation[J]. Biomedicine and Pharmacotherapy, 2016, 83: 1038-1047. DOI:10.1016/j.biopha.2016.08.029.
[10] LI S, CHEN G W, ZHANG C, et al. Research progress of natural antioxidants in foods for the treatment of diseases[J]. Food Science and Human Wellness, 2014, 3(3/4): 110-116. DOI:10.1016/j.fshw.2014.11.002.
[11] NAN M, HU J X, CHURCHWELLl M I, et al. Genotoxic effects of acrylamide and glycidamide in mouse lymphoma cells[J]. Food and Chemical Toxicology, 2008, 46(2): 628-636. DOI:10.1016/j.fct.2007.09.093.
[12] LIU Z G, SONG G, ZOU C, et al. Acrylamide induces mitochondrial dysfunction and apoptosis in BV-2 microglial cells[J]. Free Radical Biology and Medicine, 2015, 84: 42-53. DOI:10.1016/j.freeradbiomed.2015.03.013.
[13] OROIAN M, ESCRICHE I. Antioxidants: characterization, natural sources, extraction and analysis[J]. Food Research International, 2015,74: 10-36. DOI:10.1016/j.foodres.2015.04.018.
[14] ZHOLOBENKO A, MODRIANSKY M. Silymarin and its constituents in cardiac preconditioning[J]. Fitoterapia, 2014, 97: 122-132.DOI:10.1016/j.f i tote.2014.05.016.
[15] HSIANG C, LIN L J, KAO S T, et al. Glycyrrhizin, silymarin, and ursodeoxycholic acid regulate a common hepatoprotective pathway in HepG2 cells[J]. Phytomedicine, 2015, 22(7/8): 768-777. DOI:10.1016/j.phymed.2015.05.053.
[16] BAEZA G, SARRIá B, MATEOS R, et al. Dihydrocaffeic acid,a major microbial metabolite of chlorogenic acids, shows similar protective effect than a yerba mate phenolic extract against oxidative stress in HepG2 cells[J]. Food Research International, 2016, 87: 25-33.DOI:10.1016/j.foodres.2016.06.011.
[17] YAN F J, DAI G H, ZHENG X D. Mulberry anthocyanin extract ameliorates insulin resistance by regulating PI3K/AKT pathway in HepG2 cells and db/db mice[J]. The Journal of Nutritional Biochemistry, 2016, 36: 68-80. DOI:10.1016/j.jnutbio.2016.07.004.
[18] YONNY M E, GARCíA E, JOSéI A L, et al. Measurement of malondialdehyde as oxidative stress biomarker in goat plasma by HPLC-DAD[J]. Microchemical Journal, 2016, 129: 281-285.DOI:10.1016/j.microc.2016.07.010.
[19] KEDZIERSKA M, OLAS B, WACHOWICZ B, et al. Relationship between thiol, tyrosine and carbonyl formation as biomarkes of oxidative stress and changes of hemostatic function of plasma form breast cancer patients before surgery[J]. Clinical Biochemistry, 2012,45(3): 231-236. DOI:10.1016/j.clinbiochem.2011.12.002.
[20] SETYANINGSIH Y, HUSODO A H, ASTUTI I. Detection of urinary 8-hydroxydeoxyguanosine (8-OHdG) levels as biomarker of oxidative DNA damage among home industry workers exposed to chromium[J].Procedia Environmental Sciences, 2015, 23: 290-296. DOI:10.1016/j.proenv.2015.01.043.
[21] LEPETSOS P, PAPAVASSILIOU A G. ROS/oxidative stress signaling in osteoarthritis[J]. Biochimica et Biophysica Acta: Molecular Basis of Disease, 2016, 1862(4): 576-591. DOI:10.1016/j.bbadis.2016.01.003.
[22] BUSH C J, BINDER C J. Malondialdehyde epitopes as mediators of sterile inflammation[J]. Biochimica et Biophysica Acta: Molecular and Cell Biology of Lipids, 2016, 1862(4): 398-406. DOI:10.1016/j.bbalip.2016.06.016.
[23] WU J Z, LUO X T, JING S Q, et al. Tow-dimensional gel electrophoretic detection of portein carbonyls derivatized with biotinhydrazide[J]. Journal of Chromatography B, 2016, 1019(15): 128-131.DOI:10.1016/j.jchromb.2015.11.003.
[24] MARTINS G V, MARQUES A C, FORTUNATO E, et al. 8-Hydroxy-2’-deoxyguanosine (8-OHdG) biomarker detection down to picoMolar level on a plastic antibody film[J]. Biosensors and Bioelectronics,2016, 86(15): 225-234. DOI:10.1016/j.bios.2016.06.052.
[25] ZHANG X Y, LI Y H, WANG J X, et al. Identification and characteristic analysis of the catalase gene from Locusta migratoria[J]. Pesticide Biochemistry and Physiology, 2016, 132: 125-131. DOI:10.1016/j.pestbp.2016.03.010.
[26] JAIKUA W, KUEAKHAI P, CHAITHIRAYANON K, et al.Cytosolic superoxide dismutase can provide protection against Fasciocla gigantica[J]. Acta Tropica, 2016, 162: 75-82. DOI:10.1016/j.actatropica.2016.06.020.
[27] LIU G D, SHENG Z, WANG Y F, et al. Glutathione peroxidase 1 expression, malondialdehyde levels and histological alterations in the liver of Acrossochellus fasciatus exposed to cadmium chloride[J].Gene, 2016, 2(10): 210-218. DOI:10.1016/j.gene.2015.12.034.
[28] ZHAO L Z, ZHAO L, MIAO Y Q, et al. Selective eletrochemical determination of glutathione from the leakage of intracellular GSH contents in HeLa cells following doxorubicin-induced cell apoptosis[J].Electrochimica Acta, 2016, 206(10): 86-98. DOI:10.1016/j.electacta.2016.04.117.
[29] LUO Y S, LONG T Y, SHEN L C, et al. Synthesis, characterization and analysis of the acrylamide- and glycidamide-glutathione conjugates[J]. Chemic-Biological Interactions, 2015, 237(25): 38-46.DOI:10.1016/j.cbi.2015.05.002.
[30] ZHANG H J, WANG J, LIU Y L, et al. Wheat bran feruloyl oligosaccharides ameliorate AAPH-induced oxidative stress in HepG2 cell via Nrf2 signalling[J]. Journal of Functional Foods, 2016, 25: 333-340. DOI:10.1016/j.jff.2016.06.012.
Protective Effect of Silymarin on Acrylamide-Induced Oxidative Damage in HepG2 Cells
LI Liang1, ZHAO Xiaoduo1, LIU Wei2, SUN Hongyang1, ZHAO Hongyu1, SHAO Meili1,*
(1. College of Food Science, Northeast Agricultural University, Harbin 150030, China;2. Tongjiang Entry-Exit Inspection and Quarantine Bureau, Tongjiang 156400, China)
This study was designed to study the effect of silymarin on the proliferation of human hepatocellular liver carcinoma cell line (HepG2) and its preventive effect on the hepatotoxicity caused by acrylamide produced during food processing and to discuss the underlying mechanism. The effect of silymarin on the proliferation of HepG2 cells and its protective effect on acrylamide-induced cytotoxicity in HepG2 cells were evaluated by 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide (MTT) assay. By use of fl uorescence probe 2,7-dichlorodi-hydrof l uorescein diacetate (DCFHDA) method, the change in intracellular reactive oxygen species (ROS) of HepG2 cells was detected, and the markers of oxidative damage to lipid, protein and DNA (malondialdehyde, protein carbonyl and 8-hydroxy-2’-deoxyguanosine) were colorimetrically detected. The activities of the intracellular antioxidant enzymes catalase (CAT), superoxide dismutase(SOD) and glutathione peroxidase (GSH-Px) were measured with commercial kits. Our data revealed that the silymarin at 12–96 μg/mL had no cytotoxic effect on HepG2 cells and could increase cell viability and the enzyme activities of CAT,SOD and GSH-Px, reducing intracellular ROS levels and oxidative damage induced by acrylamide to lipid, protein and DNA in HepG2 cells. Therefore, silymarin can protect hepatic cells from oxidative damage caused by food-derived acrylamide.
silymarin; acrylamide; HepG2
10.7506/spkx1002-6630-201801036
TS201.6
A
1002-6630(2018)01-0238-05
李亮, 趙筱鐸, 劉巍, 等. 水飛薊素在丙烯酰胺誘導人肝癌細胞氧化損傷中的保護作用[J]. 食品科學, 2018, 39(1):238-242.
10.7506/spkx1002-6630-201801036. http://www.spkx.net.cn
LI Liang, ZHAO Xiaoduo, LIU Wei, et al. Protective effect of silymarin on acrylamide-induced oxidative damage in HepG2 cells[J]. Food Science, 2018, 39(1): 238-242. (in Chinese with English abstract) DOI:10.7506/spkx1002-6630-201801036.http://www.spkx.net.cn
2016-10-12
黑龍江省自然科學基金面上項目(C201303);黑龍江省教育廳自然科學基金項目(12541045)
李亮(1990—),男,碩士研究生,研究方向為食品安全。E-mail:1066250905@qq.com
*通信作者簡介:邵美麗(1974—),女,教授,博士,研究方向為食品安全。E-mail:shml0915@163.com
(1.東北農業大學食品學院,黑龍江 哈爾濱 150030;2.同江出入境檢驗檢疫局,黑龍江 同江 156400)

