片球菌素pedA基因的原核表達、純化及生物信息學分析
黃宇良 汪立平, 陸克文 邵會娟 王正全
(1. 上海海洋大學食品學院 食品熱加工工程技術研究中心,上海 201306;2. 上海海洋大學食品學院 上海水產品加工及貯藏工程技術研究中心,上海 201306;3. 上海邦成生物工程有限公司,上海 201506)
片球菌素pedA基因的原核表達、純化及生物信息學分析
黃宇良1汪立平1,2陸克文3邵會娟3王正全2
(1. 上海海洋大學食品學院 食品熱加工工程技術研究中心,上海 201306;2. 上海海洋大學食品學院 上海水產品加工及貯藏工程技術研究中心,上海 201306;3. 上海邦成生物工程有限公司,上海 201506)
旨在構建片球菌素PA-1結構基因pedA的原核表達載體,在大腸桿菌體系中實現PA-1的外源表達,運用生物信息學手段分析重組蛋白的理化性質及分子結構。以戊糖片球菌C-2-1的DNA為模板,擴增pedA基因,擴增產物克隆入pET28a(+)原核表達載體,構建pET28a-pedA重組質粒,轉入大腸桿菌BL21(DE3)中;30℃,以1 mmol/L IPTG 誘導表達5 h;采用Ni-NTA樹脂親和層析純化重組蛋白,檢測純化后重組蛋白的抑菌活性;利用生物信息學手段探究重組蛋白的理化性質及分子結構信息。結果顯示,pET28a-pedA重組質粒構建成功,帶有His標簽的PA-1重組片球菌素在大腸桿菌中實現了可溶性表達,利用Ni-NTA親和層析獲得純化的重組蛋白,Tricine-SDS-PAGE電泳分析表明純化后的重組蛋白分子量約為7.8 kD,與理論值相符。瓊脂擴散法抑菌活性實驗抑菌圈效果明顯,表明純化的重組片球菌素具有抑菌活性。生物信息學方法對比分析其蛋白結構發現,獲得的重組蛋白含有信號肽,α螺旋占23.53%,疏水性提高,可能促進了重組蛋白的可溶性表達。該實驗成功構建了片球菌素PA-1的原核表達載體,實現了在大腸桿菌中的可溶性表達,該表達可能與其含有信號肽及信號肽疏水性有關,純化后的重組蛋白抑菌活性明顯。
pedA基因;片球菌素PA-1;原核表達;抑菌活性;生物信息學
近年來食品安全事件頻發,其中由微生物引起的食品腐敗和食源性疾病占很大一部分比例,化學防腐劑的添加可有效抑制食品中的腐敗微生物,但防腐劑的濫用又造成了新的食品安全問題,因此尋找安全無毒副作用的天然食品防腐劑顯得尤為重要。乳酸菌細菌素是由乳酸菌通過核糖體合成機制,在代謝過程產生的一類具有抑菌活性的前體多肽或多肽,通常乳酸菌對其自身所產細菌素具有免疫性[1-2]。因細菌素對人體無危害,可被胃腸道內蛋白酶降解消化,具有作為食品生物防腐劑的潛在應用價值[3-4]。乳酸菌細菌素可分為4大類:第一類被稱為羊毛硫細菌素,是一類小分子的修飾肽;第二類是小分子熱穩定肽,其代表為乳酸鏈球菌產生的乳酸鏈球菌素Nisin,已在包括我國在內的許多國家獲得許可并在食品工業中推廣應用[5];第三類是被稱為溶菌素的大分子熱不穩定蛋白;第四類是復合型的大分子復合物。其中第二類細菌素又可分為3個亞類,其中的IIa類是類片球菌細菌素,主要由戊糖片球菌、乳酸片球菌、小片球菌產生。這類細菌素相比于Nisin 在pH6.0 時就有90% 以上的活性喪失的特點,其性質更穩定[6],抑菌譜較廣,對單增李斯特菌的抑制作用尤為明顯[7-8],在食品防腐保鮮領域中具有更廣泛的應用前景。
類片球菌素中的片球菌素PA-1是目前繼Nisin之后第二個被用于商業開發的細菌素[9],其相關基因是大小為9.4 kb的質粒pSRQ11,由4個基因簇構成一個操縱子,分別為pedA,pedB,pedC,pedD基因,pedA基因為結構基因,編碼62個氨基酸的PA-1前體,其成熟且有活性的片球菌素是由第19-62個氨基酸組成的44個氨基酸殘基和2個二硫鍵組成。其余3個基因分別為免疫基因、分泌基因、加工基因,它們不涉及片球菌素的產生[10]。天然菌株片球菌素的表達量低,不易純化,難以實現產業化,化學合成法雖然能夠生產足夠量的細菌素,但成本高、活性不穩定[11]。采用基因工程技術將片球菌素基因克隆到細菌等宿主內進行異源高效表達是近年來細菌素領域的研究熱點。如Moon等[12]在E.coli內成功表達了無活性的His-tag-倉鼠二氫葉酸還原酶-乳酸片球菌素PA-1,純化后的融合蛋白經酶切后恢復抑菌活性;劉珊娜[11]和陳信全等[13]分別在E. coli BL21(DE3)和E. coli Rosetta(DE3)內實現了片球菌素PA-1的異源融合表達;韓燁等[14]也成功實現了乳酸片球菌素pedA基因在E.coli體內的表達。以真菌為宿主異源表達細菌素近來也有報道,van Reenen等[15]利用釀酒酵母表達 Plantaricin 423,其工程菌表現出了抑菌活性;Beaulieu等[16]在畢赤酵母中也實現了無生物活性的片球菌素的高效表達。
本實驗室前期從內蒙古干酪中篩選出一株戊糖片球菌C-2-1菌株,經證實該菌株能產生片球菌素[6]。本研究以此戊糖片球菌C-2-1菌株的總DNA為模板,設計引物擴增片球菌素PA-1成熟肽的結構基因pedA,構建pET28a-pedA重組質粒,在E.coli細胞內表達重組片球菌素PA-1,利用李斯特氏菌抑菌活性檢驗純化后獲得的重組片球菌素PA-1,運用生物信息學工具分析了重組蛋白的理化特性和結構信息,以期為片球菌素PA-1的體外高效表達和后期在食品中的應用奠定基礎。
1 材料與方法
1.1 材料
1.1.1 菌株與質粒 戊糖片球菌C-2-1(Pediococcus pentosaceus C-2-1)由本實驗室自行分離獲得,表達載體 pET-28a(+)、大腸桿菌 Top10、BL21(DE3)、指示菌單增李斯特菌(L. monocytogenes ATCC19114)均由本實驗室保藏。
1.1.2 試劑與培養基 DNA聚合酶、T4 DNA連接酶購自北京全式金生物技術有限公司;限制性內切酶、質粒提取試劑盒、瓊脂糖膠回收試劑盒、Ni-NTA Agarose、卡那霉素、Tris、異丙基 -β-D-硫代半乳糖甘(IPTG)、X-Gal、瓊脂糖、溶菌酶等均購自上海生工生物工程有限公司;DNA marker、蛋白marker購自中科瑞泰生物科技有限公司;胰蛋白胨、酵母粉購自OXOID公司,氯化鈉、甘油、吐溫-80等購自國藥。LB液體培養基(g/L):胰蛋白胨 10.0、酵母粉 5.0、氯化鈉 10.0,121℃滅菌15 min,用于大腸桿菌的培養;MRS培養基(g/L):葡萄糖 20.0,蛋白胨 10.0,酵母粉 10.0,牛肉膏 5.0,磷酸氫二鉀2.0,檸檬酸銨 2.0,無水乙酸鈉 5.0,七水硫酸鎂 0.58,水合硫酸錳 0.25,吐溫-80 1.0,pH 6.2-6.6,121℃滅菌15 min,用于戊糖片球菌C-2-1的培養;TSBYE液體培養基(g/L):胰蛋白胨 17.0,大豆蛋白胨3.0,酵母粉 6.0,氯化鈉 5.0,磷酸氫二鉀 2.5,葡萄糖 2.5,調pH 7.3±0.1,121℃滅菌15 min。TSBYE固體培養基(g/L):配方同上,加入瓊脂粉1.0%。用于指示菌單增李斯特菌的培養。
1.2 方法
1.2.1 引物設計及基因擴增 根據GenBank中上傳的可產片球菌素細菌的基因進行對比,找到編碼片球菌素PA-1的pedA結構基因的全序列(GenBank登錄號:AY083244.3),設計正向引物pedA-F:5'-CATGCCATGGAAAAAATTGAAAAATTAACTGAA AAAGAA-3'(劃線部分為Nco I酶切位點,前面為保護堿基和啟動子)。反向引物pedA-R:5'-CCCAA GCTTCTAGTGATGATGGTGATGATGGCATTTATGA TTACCTTGATGTCCA-3'(劃線部分為Hind III酶切位點,前面為保護堿基,后面加有His標簽),由生工生物工程(上海)有限公司合成。以戊糖片球菌C-2-1總DNA為模板,設計引物進行PCR擴增。PCR反應條件為:95℃預變性10 min;95℃變性30 S,55℃退火30 S,72℃延伸45 S,循環30 次;72℃后延伸10 min。PCR 產物以1.5% 的瓊脂糖凝膠電泳進行檢測,切下凝膠上目的條帶后,用DNA 回收試劑盒回收純化。
1.2.2 重組質粒pET28a-pedA的構建 將回收的PCR 產物和pET-28a(+)質粒用限制性內切酶Nco I和Hind III雙酶切,回收酶切產物,利用T4 DNA 連接酶將雙酶切后的pedA 基因和pET-28a(+)質粒進行連接,連接產物轉化至Top10大腸桿菌感受態細胞,在含有卡那霉素抗性的LB 平板中篩選陽性轉化子。挑出單克隆接種LB液體培養基培養,提取質粒,將質粒用Nco I和Hind III雙酶切鑒定,鑒定正確后送至上海生工公司進行DNA測序。
1.2.3 重組球菌素PA-1的誘導表達 將測序正確的重組質粒pET28a-pedA轉化到大腸桿菌BL21(DE3)中,挑取單菌落于含卡那霉素(終濃度50 μg/mL)的LB培養基中,37℃、200 r/min搖床培養至對數生長期(OD600nm=0.6),加入終濃度1 mmol/L IPTG,30℃振蕩培養5 h,4℃離心收集細胞并洗滌后,加入細胞裂解液(終濃度為50 mg/mL)和溶菌酶(終濃度為1 mg/mL)。冰浴超聲裂解細胞,高速離心后分別取上清和沉淀進行Tricine-SDS-PAGE電泳分析,檢測重組蛋白的表達形式,收集上清和沉淀保存備用。1.2.4 重組球菌素PA-1蛋白的純化 取1 000 μL的Ni-NTA His-Bind樹脂混合液加入空純化柱中,用蒸餾水重懸珠子,待水從純化柱下方流出后,用 Binding buffer(NaH2PO450 mmol/L,NaCl 500 mmol/L,咪唑10 mmol/L,最終調pH 為8.0)重懸,重復2 次,備用;將離心得到的細胞破碎上清加入含有瓊脂糖珠子的純化柱中,4℃在旋轉儀上與珠子孵育2 h后,將上清從純化柱下方流出;用Wash buffer(NaH2PO450mmol/L,NaCl 500 mmol/L,咪唑20 mmol/L,最終調pH 為8.0)洗滌樹脂,重復3 次;漂洗完畢后用Elution buffer(NaH2PO450 mmol/L,NaCl 500 mmol/L,咪唑 250 mmol/L,最終調 pH 為 8.0)洗脫蛋白,每200 μL 洗脫1 次,重復2 次,分別取5 μL洗脫液進行Tricine-SDS-PAGE膠分析。
1.2.5 戊糖片球菌素PA-1的活性檢測 以單核細胞增生李斯特氏菌為指示菌,采用瓊脂擴散法檢測表達片球菌素的活性。取50 μL第二次洗脫液樣品經0.22 μm濾膜過濾除菌,注入接種有新鮮過夜單核細胞增生李斯特菌菌液(37℃條件下培養16 h)的TSB固體平板上的瓊脂孔(約3 mm)中,對照組瓊脂孔加入洗脫重組蛋白時使用的相同洗脫液。在超凈工作臺上靜止1 h后,置于37℃培養箱培養12 h,觀察抑菌圈。
1.2.6 片球菌素PA-1的生物信息學分析 氨基酸序列利用NCBI網站提供的BLAST工具進行預測(https://www.ncbi.nlm.nih.gov/orffinder/),BioEdit工具進行氨基酸序列對比,用ProtParam蛋白在線分析工具和https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=/NPSA/npsa_seccons.html網站二級結構預測工具等對兩種蛋白的理化性質和二級結構組成等生物信息學信息進行分析。
2 結果
2.1 pedA基因的擴增
以戊糖片球菌C-2-1菌株的總DNA為模板,pedA-F和pedA-R為正反向引物,進行pedA基因PCR擴增,產物經1.5%瓊脂糖凝膠電泳檢測,如圖1所示,在220 bp 左右有明顯條帶,與預期片段大小相符,目的基因擴增成功。
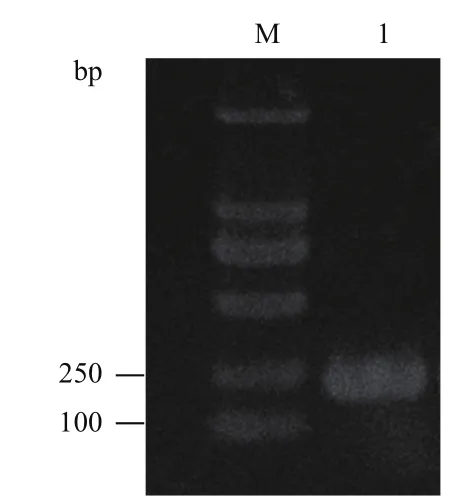
圖 1 pedA基因的PCR擴增
2.2 重組質粒pET28a-pedA的構建與鑒定
將雙酶切后的pedA 基因和pET-28a(+)質粒進行T4 連接酶連接,產物轉化至感受態細胞,篩選陽性轉化子接種到LB液體培養基培養,提取質粒。如圖2 所示,將重組質粒pET28a-pedA用Nco I和Hind III雙酶切后,獲得一條220 bp 左右的條帶,此條帶大小與預期值相符。將雙酶切鑒定正確的質粒進行基因測序,測序結果表明連入pET28a質粒中的pedA 基因與GenBank中的pedA 基因堿基序列(GenBank登錄號:AY083244.3)完全一致,說明重組質粒pET28a-pedA 構建成功。
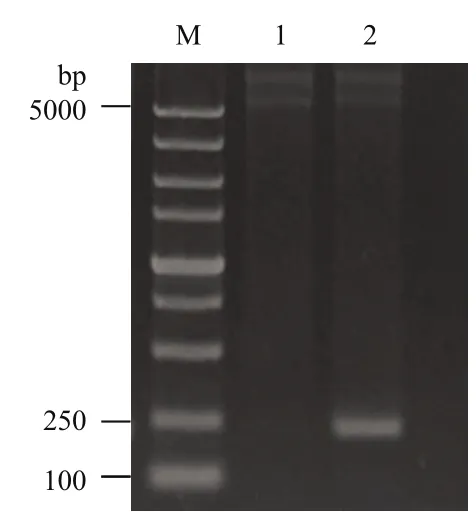
圖2 陽性重組子雙酶切鑒定
2.3 重組球菌素PA-1蛋白的誘導表達
將重組質粒pET28a-pedA轉化到大腸桿菌BL21(DE3)感受態細胞中,在含有卡那霉素的LB培養基中振蕩培養,加入IPTG后降低培養溫度誘導表達,震蕩培養5 h后,4℃離心收集細胞并洗滌,加入裂解液和溶菌酶。冰浴超聲裂解細胞,離心后取上清和沉淀進行電泳分析,檢測重組蛋白表達形式,實驗結果如圖3所示,誘導后的上清和沉淀中在7.8 kD附近有一條明顯的條帶,與理論值相符。而未轉化重組質粒pET28a-pedA的大腸桿菌BL21(DE3)野生菌株在7.8 kD附近無明顯條帶。表明重組球菌素PA-1蛋白在大腸桿菌BL21(DE3)中誘導表達成功,且以可溶性蛋白形式存在。
2.4 重組片球菌素PA-1蛋白的純化
將收集的超聲裂解上清液與Ni-NTA 瓊脂糖鎳柱孵育,帶有His 標簽的重組球菌素PA-1蛋白會與鎳柱特異性結合,經過3次漂洗和2次洗脫后,成功獲得純化的重組球菌素PA-1蛋白(圖4)。收集對應洗脫液保存,進行活性檢測。
2.5 片球菌素PA-1的活性檢測
以單核細胞增生李斯特氏菌為指示菌,利用瓊脂擴散法鑒定表達重組片球菌素PA-1的活性。結果如圖5所示,純化后的重組片球菌素PA-1抑菌圈明顯,而僅含洗脫液的空白對照沒有抑菌圈,證明戊糖片球菌素pedA結構基因在大腸桿菌體內成功表達出了有活性的PA-1細菌素。

圖3 重組片球菌素PA-1蛋白的Tricine-SDS-PAGE電泳檢測
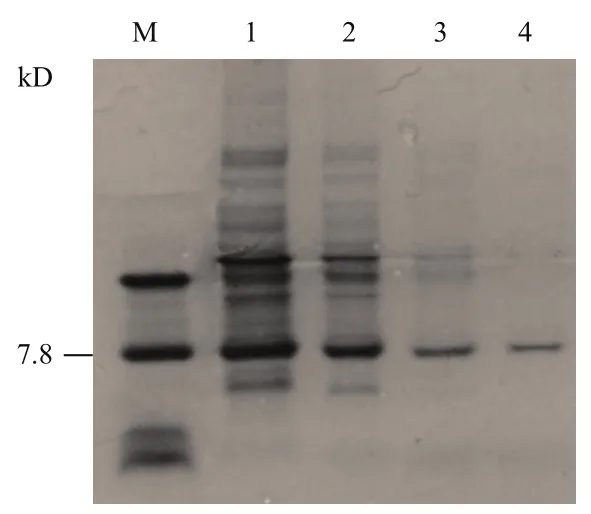
圖4 重組片球菌素PA-1蛋白的純化
2.6 片球菌素PA-1的生物信息學分析
鑒于本實驗得到的重組蛋白為胞內可溶性表達,而已報道的僅表達成熟且有活性的由44個氨基酸組成(GenBank登錄號為BAE79270)的PA-1細菌素前體蛋白,大部分為包涵體不可溶表達。運用生物信息學工具分析預測本實驗得到的重組片球菌素PA-1氨基酸序列和 BAE79270 PA-1細菌素兩種蛋白的理化性質、結構特征等內容,推測本實驗重組蛋白在大腸桿菌體內可溶性表達的可能原因。
2.6.1 片球菌素PA-1的理化性質分析 本實驗成功表達的重組片球菌素PA-1氨基酸序列為:MKKI EKLTEKEMANIIGGKYYGNGVTCGKHSCSVDWGKAT TCIINNGAMAWATGGHQGNHKCHHHHHH,由68個氨基酸(其中含劃線部分6個組氨酸組成的His標簽)組成。登錄號為BAE79270的PA-1細菌素由44個氨基酸組成,其氨基酸序列為:KYYGNGVTC GKHSCSVDWGKATTCIINNGAMAWATGGHQGNHKC。BioEdit分析發現兩者之差別在于本研究多了氨基酸序列MKKIEKLTEKEMANIIGG,其他序列相同。

圖5 重組片球菌素的抑菌活性驗證
用ProtParam蛋白在線分析工具分析BAE79270的PA-1細菌素氨基酸序列,結果表明,其分子式為C196H297N61O60S5,分子量為4 628.19,理論pI(等電點)值為8.85,同時含有1個負電荷氨基酸(Asp +Glu)和4個正電荷氨基酸(Arg + Lys),脂肪系數為40.00,總平均親水值(GRAVY)為-0.716,不穩定性系數為-0.48。用相同方法分析本實驗成功表達的重組片球菌素PA-1氨基酸序列,結果表明,其分子式為C319H489N101O94S7,分子量為7 467.43,理論pI值為8.42,含有5個負電荷氨基酸(Asp + Glu)和7個正電荷氨基酸(Arg + Lys),脂肪系數為50.29,總平均親水值為-0.716,不穩定性系數為23.65,屬于穩定型細菌素。兩種蛋白的氨基酸組成見表1。
2.6.2 片球菌素PA-1的二級結構預測 利用二級結構預測工具對片球菌素PA-1進行二級結構預測。各參數設置為:視窗寬度為17,相似度閾值為8,狀態數目為4。經分析:登錄號為BAE79270的PA-1細菌素的二級結構(圖6)中,無α螺旋結構;延伸鏈占40.91%,有18個氨基酸殘基參與;β轉角占13.64%,有6個氨基酸殘基參與;無規則卷曲占45.45%,共有20個氨基酸殘基參與。
本實驗成功表達的重組片球菌素PA-1的二級結構(圖7)中,α螺旋占23.53%,有16個氨基酸殘基參與;延伸鏈占20.97%,有13個氨基酸殘基參與;β轉角占12.90%,有8個氨基酸殘基參與,無規則卷曲占40.32%,共有25個氨基酸殘基參與。
對比預測結果后發現,本實驗重組片球菌素PA-1的二級結構中含有23.53%的α螺旋結構,而由44個氨基酸組成的成熟且有活性的PA-1細菌素的二級結構中不含有α螺旋結構。
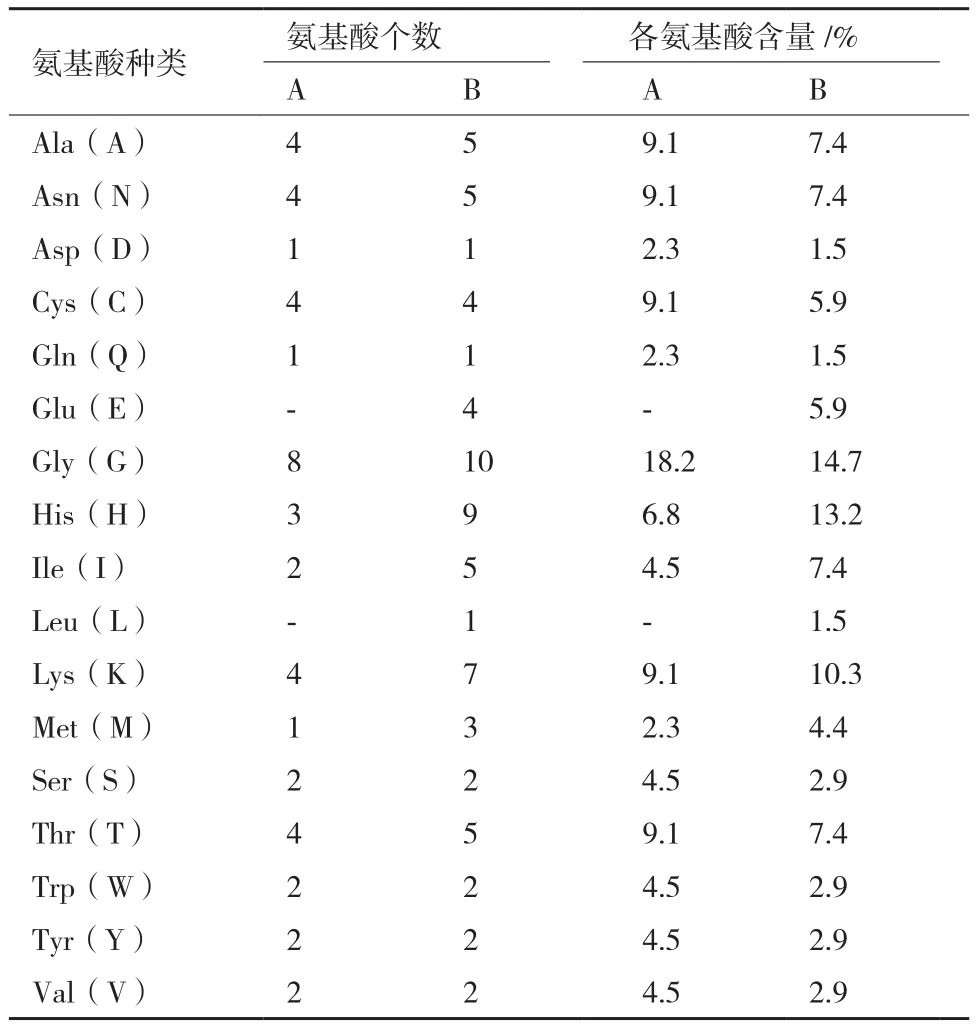
表1 兩種不同片球菌素PA-1的氨基酸組成
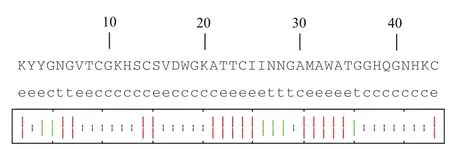
圖6 BAE79270片球菌素PA-1的二級結構預測
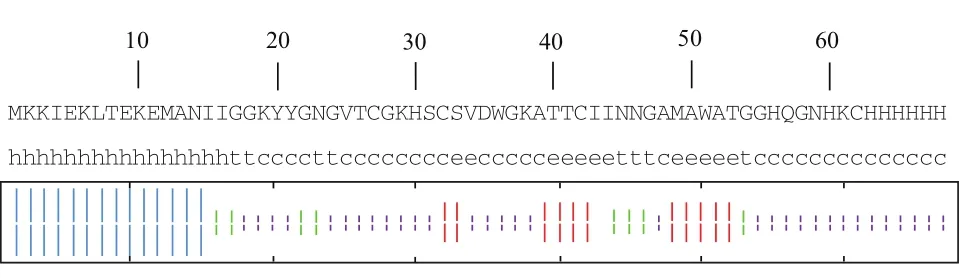
圖7 本實驗片球菌素PA-1的二級結構預測
3 討論
采用基因工程技術來提高片球菌素的效價是可行的,但還存在一定問題。已報道的片球菌素PA-1在大腸桿菌中的表達形式多為細胞內不溶性表達,產物通常存在于包涵體中,包涵體溶解、變性、復性等過程復雜,導致表達效率降低[17]。劉珊娜等[11]在E. coli BL21(DE3)內實現了Trx-PA-1的融合表達,重組片球菌素以包涵體的形式存在,限制了PA-1進一步應用。此外,引入分子伴侶或運用融合表達的方法來實現PA-1的可溶性表達,也是學者常用的一種細菌素異源表達的方法,但獲得的重組蛋白要經過腸激酶酶切去除標簽蛋白后才能恢復活性。陳信全等[13]利用GST系統,通過在GST和PA-1蛋白間引入His標簽實現了融合蛋白的可溶性表達,重組PA-1經過腸激酶去除標簽蛋白后活性才得以恢復,制約了其在食品工業中的應用。本研究構建了pET28a-pedA重組質粒,轉入大腸桿菌后經誘導表達、Ni-NTA柱純化、Tricine-SDS-PAGE電泳分析后[18],獲得了分子量在7.8 kD左右的可溶性重組蛋白,與ProtParam蛋白分析工具的分子量預測值相符。經單增李斯特菌抑菌檢測顯示,重組片球菌素具有明顯的抑菌活性。本實驗成功表達的可溶性重組片球菌素PA-1,未加入融合蛋白或分子伴侶,使重組片球菌素的提取和純化更加簡便,為片球菌素PA-1在食品防腐保鮮領域的應用奠定了很好的基礎。
Marugg等[10]證實pedA基因編碼PA-1片球菌素62個氨基酸的PA-1前體,第19-62個氨基酸為具有活性的片球菌素前體,前18個氨基酸為信號肽序列,與劉珊娜[11]包涵體表達的片球菌素PA-1相比,本實驗成功表達的重組片球菌素PA-1含有此信號肽序列。研究表明分泌蛋白的N端都攜帶有引導其跨越細胞膜的信號肽,它對于分泌蛋白的分泌效率起主導作用[19],利用信號肽來引導外源蛋白定位分泌到細胞特定區間,提高可溶性,可避免因包涵體復性帶來的困難[20]。因此,本實驗獲得的重組片球菌素PA-1含信號肽可能是導致其可溶性表達的原因。進一步比較兩種PA-1的理化性質及二級結構后發現,未含信號肽的BAE79270的PA-1細菌素沒有α螺旋結構,含有信號肽的片球菌素PA-1的α螺旋結構占23.53%,重組蛋白疏水性提高。據文獻報道,信號肽分泌加工能力隨疏水性增加而提高,前體蛋白可以不依賴分子伴侶或其他輔助因子仍能較好的分泌[21]。楊運桂等[22]證實信號肽疏水性能提高促進青霉素G 酰化酶分泌。因此,本實驗獲得的重組PA-1蛋白含有的疏水核心信號肽可能促進了重組蛋白的分泌,從而獲得了較穩定的重組蛋白,使提取和純化更為簡單。
4 結論
本實驗成功構建了片球菌素PA-1結構基因pedA的原核表達載體,純化得到了可溶性表達并具有抑菌活性的重組片球菌素PA-1。運用生物信息學手段,進一步分析了重組片球菌素PA-1可溶性表達的原因可能為含有信號肽的PA-1的重組蛋白疏水性提高,促進了重組蛋白的分泌。
[1] Deegan LH, Cotter PD, Hill C, et al. Bacteriocins:Biological tools for bio-preservation and shelf-life extension[J]. International Dairy Journal, 2006, 16(9):1058-1071.
[2] Kaur G, Singh TP, Malik RK. Antibacterial efficacy of Nisin,Pediocin 34 and Enterocin FH99 against Listeria monocytogenes and cross resistance of its bacteriocin resistant variants to common food preservatives[J]. Braz J Microbiol, 2013, 44(1):63-71.
[3] 于雷雷, 王超, 等. 戊糖乳桿菌素pentocin LPEM818的初步純化及特性研究[J]. 食品與發酵工業, 2013(2):17-23.
[4] 呂燕妮. 廣譜抗菌肽—片球菌素pediocin PA-1[J]. 食品科技,2011(9):41-44.
[5] Beaulieu L, Aomari H, et al. An improved and simplified method for the large-scale purification of pediocin PA-1 produced by Pediococcus acidilactici[J]. Biotechnol Appl Biochem, 2006, 43(Pt 2):77-84.
[6] 王艷婷, 汪立平, 唐潮, 等. 蒙古干酪中產細菌素戊糖片球菌的篩選及其細菌素理化特性研究[J]. 食品與發酵工業, 2015,41(10):14-19.
[7] Siegers K, Entian KD. Genes involved in immunity to the lantibiotic nisin produced by Lactococcus lactis 6F3[J]. Appl Environ Microbiol, 1995, 61(3):1082-1089.
[8] Reviriego C, Fernández A, Horn N, et al. Production of pediocin PA-1, and coproduction of nisin A and pediocin PA-1, by wild Lactococcus lactis, strains of dairy origin[J]. International Dairy Journal, 2005, 15(1):45-49.
[9] 劉晨, 齊凡, 陳穎怡, 等. 片球菌素在食品防腐保鮮中的應用研究進展[J]. 保鮮與加工, 2012, 12(4):1-6.
[10] Marugg JD, Gonzalez CF, Kunka BS, et al. Cloning, expression, and nucleotide sequence of genes involved in production of pediocin PA-1, and bacteriocin from Pediococcus acidilactici PAC1. 0[J].Appl Environ Microbiol, 1992, 58(8):2360-2367.
[11] 劉珊娜. 乳酸片球菌素pedA基因的克隆與表達[D]. 天津:天津大學, 2009.
[12] Moon GS, Pyun YR, Kim WJ. Expression and purification of a fusion-typed pediocin PA-1 in Escherichia coli and recovery of biologically active pediocin PA-1[J]. International Journal of Food Microbiology, 2006, 108(1):136-140.
[13] 陳信全, 都立輝, 鞠興榮, 等. 乳酸片球菌素PA-1在大腸桿菌中的表達與純化[J]. 食品科學, 2016, 37(3):97-102.
[14] 韓燁, 周志江, 王培培, 等. 片球菌素基因的克隆及表達[J].華北農學報, 2009, 24(2):32-35.
[15] van Reenen CA, Dicks LM, et al. Isolation, purification and partial characterization of plantaricin 423, a bacteriocin produced by Lactobacillus plantarum[J]. J Appl Microbiol, 1998, 6:1131-1137.
[16] Beaulieu L, Groleau DC, Jette J, et al. Production of pediocin PA-1 in the methylotrophic yeast Pichia pastoris reveals unexpected inhibition of its biological activity due to the presence of collagenlike material[J]. Protein Exp Purif, 2005, 43(2):111-125.
[17] 蘇鵬, 龔國利. 優化大腸桿菌表達外源蛋白的研究進展[J].生物技術通報, 2017, 33(2):16-23.
[18] Sch?gger H, Jagow GV. Tricine-sodium dodecyl sulfatepolyacrylamide gel electrophoresis for the separation of proteins in the range from 1 to 100 kDa[J]. Anal Biochem, 1987, 2 :368-379.
[19] Izard JW, Doughty MB, Kendall DA. Physical and conformational properties of synthetic idealized signal sequences parallel their biological function[J]. Biochemistry, 1995, 31:9904-9912.
[20] 韋雪芳, 王冬梅, 劉思, 等. 信號肽及其在蛋白質表達中的應用[J]. 生物技術通報, 2006(6):38-42.
[21] Chen H, Kim J, Kendall DA. Competition between functional signal peptides demonstrates variation in affinity for the secretion pathway[J]. J Bacteriol, 1996, 178(23):6658-6664.
[22] 楊運桂, 等. 信號肽疏水性的提高促進青霉素 G 酰化酶分泌[J]. 生物化學與生物物理學報, 2000, 32(2):163-168.
Prokaryotic Expression,Purification and Bioinformatics Analysis of Pediocin pedA Gene
HUANG Yu-liang1WANG Li-ping1,2LU Ke-wen3SHAO Hui-juan3WANG Zheng-quan2
(1. College of Food Science and Technology,Shanghai Ocean University,Engineering Research Center of Food Thermal-processing Technology,Shanghai 201306 ;2. College of Food Science and Technology,Shanghai Ocean University,Shanghai Engineering Research Center of Aquatic-Product Processing & Preservation,Shanghai 201306 ;3. Shanghai Bangcheng Biotechnology Co. Ltd.,Shanghai 201506)
The aim of this study is to construct a prokaryotic expression vector for pedA gene of pediocin PA-1 to realize the exogenous expression of PA-1,and to analyze the physicochemical properties and molecular structure of recombinant protein by bioinformatics. The pedA gene was amplified by DNA of Pediococcus pentosaceus C-2-1 as template,and the PCR product was cloned into prokaryotic expression vector pET28a(+). The recombinant plasmid pET28a-pedA was thus constructed and transformed into Escherichia coli BL21(DE3)competent cells. Next,the transformant was induced to express protein by IPTG(1 mmol/L)at 30℃ for 5 h. Then,the recombinant protein was purified by Ni-NTA resin affinity chromatography,and the antibacterial activity of the recombinant protein was detected. Finally,the physicochemical properties and molecular structure of recombinant protein was explored by bioinformatics method. The results showed that the recombinant plasmid pET28a-pedA was successfully constructed,and recombinant pediocin of PA-1 with His-tag was expressed in E. coli. The molecular size of the purified recombinant protein by Ni-NTA affinity chromatography was determined to be about 7.8 kD via Tricine-SDS-PAGE,whichwas consistent with the theoretical value. Agar diffusion method demonstrated that antibacterial colony was remarkable,indicating that the purified recombinant pediocin had antibacterial activity. Comparative analysis of the protein structure and characteristics by bioinformatics method showed that the recombinant protein contained the signal peptide and consisted of 23.53% alpha helix,meaning that its hydrophobicity increased,thus which might enhance the soluble expression of the recombinant protein. Conclusively,in this experiment,the prokaryotic expression vector of pediocin PA-1 was successfully constructed,and the recombinant protein was at soluble expression in E. coli. The soluble expression may be related to signal peptide and the hydrophobicity of the signal peptide,and the antibacterial activity of the purified recombinant protein was significant.
pedA gene;pediocin PA-1;prokaryotic expression;antibacterial activity;bioinformatics
10.13560/j.cnki.biotech.bull.1985.2017-0373
2017-05-09
國家自然科學基金青年基金項目(31401486),上海市科學技術委員會工程中心建設項目(11DZ2280300)
黃宇良,男,碩士研究生,研究方向:食品生物技術;E-mail:791313564@qq.com
汪立平,女,博士,副教授,研究方向:食品生物技術;E-mail:lpwang@shou.edu.cn
(責任編輯 狄艷紅)

