Wnt10A基因促進(jìn)胃癌細(xì)胞增殖與遷移作用及機(jī)制探討
郭會(huì)燦
(石家莊職業(yè)技術(shù)學(xué)院,石家莊 050081)
Wnt10A基因促進(jìn)胃癌細(xì)胞增殖與遷移作用及機(jī)制探討
郭會(huì)燦
(石家莊職業(yè)技術(shù)學(xué)院,石家莊 050081)
闡明Wnt10A基因在胃癌細(xì)胞增殖及遷移中的功能及探索潛在的分子機(jī)制,為胃癌診斷、治療提供新的靶點(diǎn)分子。以熒光定量PCR及免疫印跡技術(shù)檢測(cè)基因表達(dá),以RNAi技術(shù)敲減Wnt10A基因,以MTT法、劃痕及transwell實(shí)驗(yàn)檢測(cè)細(xì)胞行為學(xué)變化。結(jié)果顯示,Wnt10A基因在胃癌組織中表達(dá)量均顯著高于癌旁對(duì)照,平均差異達(dá)到3倍。并且Wnt10A基因在胃癌細(xì)胞系中表達(dá)量也高于正常細(xì)胞GES。當(dāng)Wnt10A基因在胃癌細(xì)胞AGS中表達(dá)被成功下調(diào)約60%后,AGS細(xì)胞增殖率下降40%,遷移率下降約40%,侵襲能力也降低約70%。免疫印跡實(shí)驗(yàn)表明Wnt10A下調(diào)后,β-catenin、Cyclin D、TCF以及Myc基因表達(dá)量下調(diào),而DKK1與GSK3β表達(dá)增強(qiáng),與LGK-974處理結(jié)果一致。Wnt10A基因通過模擬激活Wnt/β-catenin/Myc信號(hào)通路促進(jìn)胃癌細(xì)胞增殖與遷移,發(fā)揮促癌基因的功能。
Wnt10A;胃癌;AGS;Wnt/β-catenin信號(hào)
胃癌是嚴(yán)重威脅人類生命安全的十大惡性腫瘤之一,發(fā)病率與死亡率一直居高不下,并且呈現(xiàn)穩(wěn)步增長(zhǎng)趨勢(shì)。世界癌癥研究報(bào)告數(shù)據(jù)顯示,2017年在美國(guó)胃癌的新增病例為28 000例,死亡病例為10 960例,分別占據(jù)十大腫瘤發(fā)病率第二、死亡率第一的位置[1]。中國(guó)面臨的形勢(shì)更嚴(yán)峻,據(jù)2015年統(tǒng)計(jì)預(yù)測(cè)新增胃癌病例約733 300例,新增死亡人數(shù)為610 200例[2]。然而,目前針對(duì)胃癌主要還是以手術(shù)切除為主,并給予放化療輔助治療。但是臨床預(yù)后較差、發(fā)現(xiàn)晚,極大地降低了胃癌患者生存概率,其主要原因是缺乏胃癌早期診斷標(biāo)志物,以及對(duì)胃癌發(fā)病機(jī)理缺乏充分的認(rèn)識(shí)[3]。大量研究數(shù)據(jù)表明,癌癥的發(fā)生發(fā)展是一個(gè)多因素參與的復(fù)雜過程,基因突變、缺失、表達(dá)失調(diào)導(dǎo)致細(xì)胞生長(zhǎng)、遷移特性異常或紊亂是癌癥發(fā)生發(fā)展的常見機(jī)制。同樣,胃癌中關(guān)鍵分子及關(guān)鍵信號(hào)途徑仍有待挖掘[4-5]。
研究表明,Wnt信號(hào)通路過度激活以及關(guān)鍵調(diào)節(jié)蛋白的改變與腫瘤的發(fā)生發(fā)展密切相關(guān)[6-8]。Wnt配體家族有19個(gè)成員,其中Wnt10A基因被報(bào)道促進(jìn)腎細(xì)胞癌發(fā)生,發(fā)揮癌基因功能[9-10]。同時(shí)有研究表明,在胃癌細(xì)胞系和原發(fā)性胃癌組織中Wnt10A基因表達(dá)也增強(qiáng)[11]。而且TNFα和幽門螺桿菌感染均誘導(dǎo)Wnt10A基因表達(dá)上調(diào)。幽門螺桿菌是胃炎的元兇,并且會(huì)導(dǎo)致胃癌的形成[11],但Wnt10A基因在胃癌中的功能及分子機(jī)制尚無報(bào)道。
本研究通過基因干擾技術(shù)下調(diào)胃癌細(xì)胞AGS細(xì)胞中Wnt10A表達(dá),檢測(cè)AGS細(xì)胞增殖、遷移的改變,并以免疫印跡技術(shù)探索Wnt10A在胃癌發(fā)生、發(fā)展中參與調(diào)控的信號(hào)機(jī)制。
1 材料與方法
1.1 材料
40例冰凍胃癌樣本組織及對(duì)應(yīng)癌旁組織來源于河北醫(yī)科大學(xué)第一醫(yī)院病理科。胃癌細(xì)胞系A(chǔ)GS、MGC-803、SGC-7901及對(duì)照細(xì)胞系GES購(gòu)自中科院上海細(xì)胞庫(kù),細(xì)胞培養(yǎng)于DMEM培養(yǎng)基(含10%FBS)。
1.2 方法
1.2.1 siRNA合成與轉(zhuǎn)染 以在線軟件設(shè)計(jì)并合成2條靶向Wnt10A基因編碼區(qū)的siRNA片段(siWnt10A-1與 siWnt10A-2),如表 1所示。參考Invitrogen公司Lipofectamine2000使用手冊(cè)以脂質(zhì)體轉(zhuǎn)染法將siRNA片段與細(xì)胞共培養(yǎng)6 h,然后更換新鮮培養(yǎng)基繼續(xù)培養(yǎng)細(xì)胞。
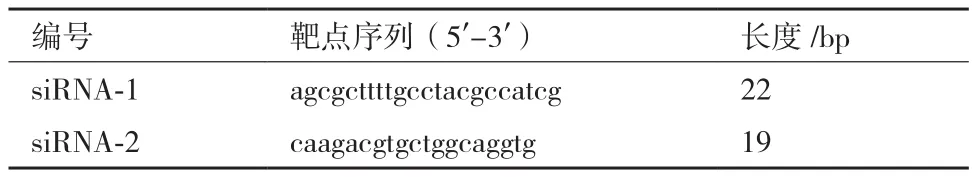
表1 靶向Wnt10A基因siRNA靶點(diǎn)序列
1.2.2 MTT實(shí)驗(yàn) 分組:siRNA對(duì)照組(NC組)、Wnt10A-siRNA-1組、抑制劑對(duì)照組(DMSO組)、LGK-974組、聯(lián)用組(Wnt10A-siRNA-1/LGK-974組);其中LGK-974實(shí)驗(yàn)劑量為0.6 nmol/L。
準(zhǔn)備96孔板,按照2 000個(gè)細(xì)胞/孔接種胃癌細(xì)胞,3個(gè)復(fù)孔/組,按照1.2.1方法轉(zhuǎn)染siRNA片段,繼續(xù)培養(yǎng)至120 h,每24 h取一組細(xì)胞棄上清并加入20 μL MTT試劑(5 mg/mL),繼續(xù)孵育4 h,棄上清并加入200 μL DMSO試劑,振蕩30 s,以酶標(biāo)儀檢測(cè)490 nm波長(zhǎng)讀值。計(jì)算細(xì)胞增殖率。
1.2.3 劃痕實(shí)驗(yàn) 準(zhǔn)備6孔板,按照200 000個(gè)細(xì)胞/孔接種胃癌細(xì)胞,3個(gè)復(fù)孔/組,按照1.2.1方法轉(zhuǎn)染siRNA片段,24 h后觀察細(xì)胞融合度達(dá)到90%,以10 μL移液槍頭制造1個(gè)劃痕并以含2%FBS的DMEM培養(yǎng)基繼續(xù)培養(yǎng)48 h。顯微鏡下觀察細(xì)胞遷移情況,并分別在24 h、72 h兩個(gè)時(shí)間點(diǎn)測(cè)量劃痕距離(S24h、S72h),計(jì)算細(xì)胞遷移率,計(jì)算公式為migration rate=(S24h-S72h)/S24h。
1.2.4 Transwell實(shí)驗(yàn) 取BD公司transwell小室(上室,孔徑8 μm),按照20 000個(gè)細(xì)胞/孔接種siRNA處理過的胃癌細(xì)胞,3個(gè)復(fù)孔/組,將上室置于24孔板(下室)中,下室中加入500 μL含20%FBS的DMEM培養(yǎng)基。48 h后,取出上室,刮去上室內(nèi)側(cè)細(xì)胞,上室外側(cè)細(xì)胞以0.1%結(jié)晶紫染色并以甲醇固定。顯微鏡下觀察穿膜細(xì)胞數(shù)量并計(jì)數(shù),評(píng)估細(xì)胞侵襲能力。
1.2.5 實(shí)時(shí)熒光定量PCR(qRT-PCR) 參考Invitrogen公司的TRIZOL產(chǎn)品手冊(cè)提取胃癌組織及細(xì)胞系中總RNA并以Promega公司的核酸酶處理RNA。以 1 μg RNA 為 模 板 逆 轉(zhuǎn) 錄 合 成 cDNA, 取 2 μL cDNA為模板,以SYBR Green方法進(jìn)行qRT-PCR。以GAPDH為內(nèi)參,按照2-△Ct方法計(jì)算目的基因相對(duì)含量。△Ct=Ct(目的基因)-Ct(GAPDH)。
1.2.6 免疫印跡實(shí)驗(yàn) 以商業(yè)蛋白提取試劑盒提取細(xì)胞中總蛋白并以BCA方法定量。取15 μg總蛋白以10% SDS-PAGE電泳分離并以濕轉(zhuǎn)染將目的蛋白轉(zhuǎn)移至PVDF膜上,以第一抗體包括Wnt10A抗體(ab62051,Abcam)、DKK1(ab109416,Abcam)、TCF(ab69999,Abcam)、β-catenin(ab32572,Abcam)、cyclin D1(ab134175,Abcam)、GAPDH(ab9484,Abcam)孵育PVDF膜,4℃過夜,然后以相應(yīng)第二抗體孵育PVDF膜,以ECL kit曝光檢測(cè)目的基因表達(dá)量。
1.2.7 數(shù)據(jù)分析 所有實(shí)驗(yàn)均至少重復(fù)3次,并表示為平均值±標(biāo)準(zhǔn)差(x-±s)。Student’t檢驗(yàn)用于評(píng)價(jià)各實(shí)驗(yàn)組之間是否具有顯著差異。*P<0.05表示具有顯著差異。
2 結(jié)果
2.1 Wnt10A基因在胃癌細(xì)胞中高表達(dá)
借助熒光定量PCR技術(shù)(qPCR)及免疫印跡技術(shù)(WB)分析發(fā)現(xiàn),在多株胃癌細(xì)胞系中,Wnt10A基因表達(dá)明顯強(qiáng)于正常胃上皮細(xì)胞GES-1。如圖1-A所示,在3株胃癌細(xì)胞系A(chǔ)GS、MGC-803、SGC-7901中Wnt10A基因的mRNA表達(dá)顯著高于對(duì)照細(xì)胞GES-1,其中以AGS細(xì)胞中Wnt10A表達(dá)最強(qiáng)。而且在蛋白表達(dá)水平,Wnt10A基因在3株胃癌細(xì)胞系中表達(dá)也明顯高于GES-1細(xì)胞中(圖1-B)。同時(shí),以qPCR技術(shù)也發(fā)現(xiàn)在40例胃癌組織中Wnt10A基因表達(dá)也明顯高于癌旁正常組織,平均表達(dá)水平增強(qiáng)約3倍(圖1-C)。因此,Wnt10A基因在胃癌發(fā)生、進(jìn)展中可能有重要意義。
2.2 Wnt10A基因在胃癌細(xì)胞AGS中被成功敲減
如表1,設(shè)計(jì)、合成2個(gè)siRNA片段即siWnt-10A-1余siWnt10A-2。然后,通過lipo2000將這2個(gè)siRNA片段分別導(dǎo)入AGS細(xì)胞中。共培養(yǎng)48 h后,通過qPCR與WB方法分析發(fā)現(xiàn)AGS細(xì)胞中Wnt10A基因在AGS細(xì)胞中被顯著降低。如圖2所示,Wnt10A基因在mRNA與蛋白水平分別降低達(dá)60%與54%。因此,表明成功敲減胃癌細(xì)胞AGS中Wnt10A基因的表達(dá)。
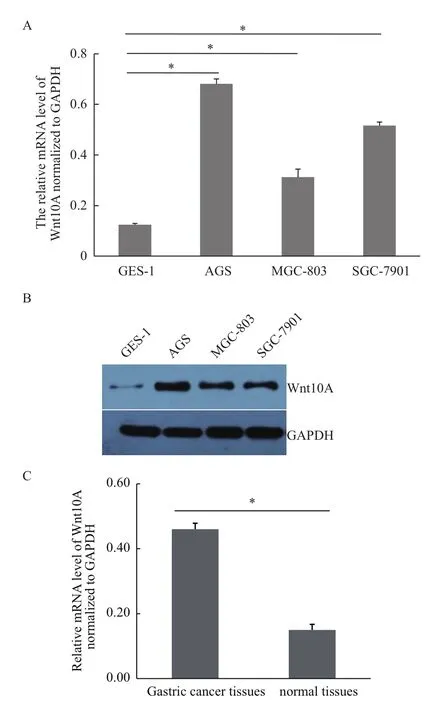
圖1 Wnt10A基因表達(dá)模式
2.3 敲減Wnt10A基因抑制AGS細(xì)胞增殖
當(dāng)降低Wnt10A基因表達(dá)后,發(fā)現(xiàn)AGS細(xì)胞增殖能力明顯減弱。如圖3所示,轉(zhuǎn)染siRNA片段后120 h,AGS細(xì)胞增殖率降低40%以上。這些數(shù)據(jù)表明Wnt10A基因?qū)ξ赴┘?xì)胞生長(zhǎng)有促進(jìn)作用。
2.4 敲減Wnt10A基因降低AGS細(xì)胞遷移及侵襲能力
以劃痕實(shí)驗(yàn)分析發(fā)現(xiàn)敲減Wnt10A基因表達(dá)后,AGS細(xì)胞的遷移率降低達(dá)40%(圖4-A與4-C)。同時(shí)在transwell實(shí)驗(yàn)中,AGS細(xì)胞侵襲能力也顯著減弱,幅度達(dá)到70%以上(圖4-B與4-D)。因此,Wnt10A有利于胃癌細(xì)胞遷移及侵襲。
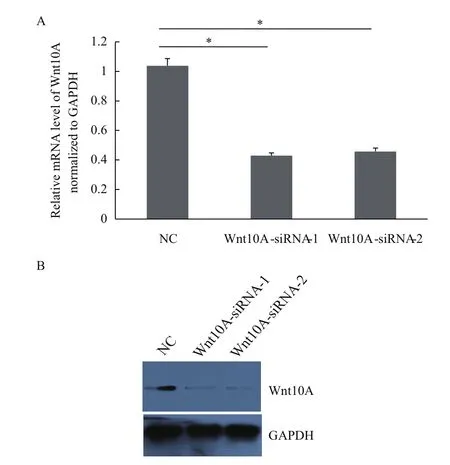
圖2 Wnt10A基因被成功敲減
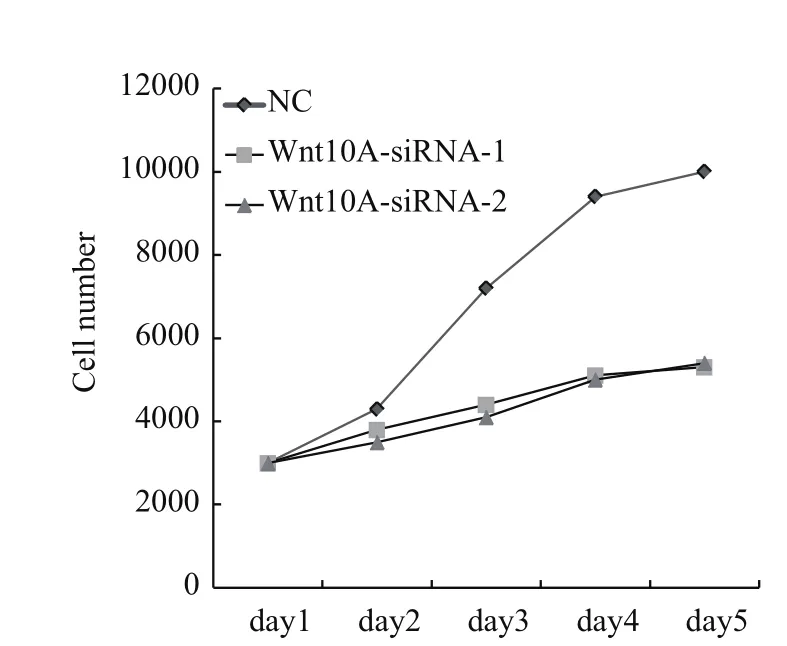
圖3 Wnt10A基因敲減阻滯AGS細(xì)胞生長(zhǎng)
2.5 Wnt10A基因模擬調(diào)控Wnt/β-catenin/Myc信號(hào)通路
如圖5-A,敲減Wnt10A基因后,經(jīng)典Wnt信號(hào)通路中的關(guān)鍵分子如β-catenin、Cyclin D1、TCF以及Myc基因表達(dá)量下調(diào),而DKK1與GSK3β表達(dá)增強(qiáng)。該數(shù)據(jù)與以Wnt信號(hào)抑制劑LGK-974處理AGS細(xì)胞得到的結(jié)果一致,并且LGK-974與Wnt10A敲減之間無協(xié)調(diào)效應(yīng)或疊加效應(yīng)。如圖5-B,聯(lián)用組LGK-974/ siWnt10A-1與單獨(dú)組siWnt10A-1的AGS細(xì)胞增殖無顯著差異(P<0.05)。據(jù)此推斷,在胃癌細(xì)胞中Wnt10A基因模擬調(diào)控Wnt/β-catenin/Myc信號(hào)活性。
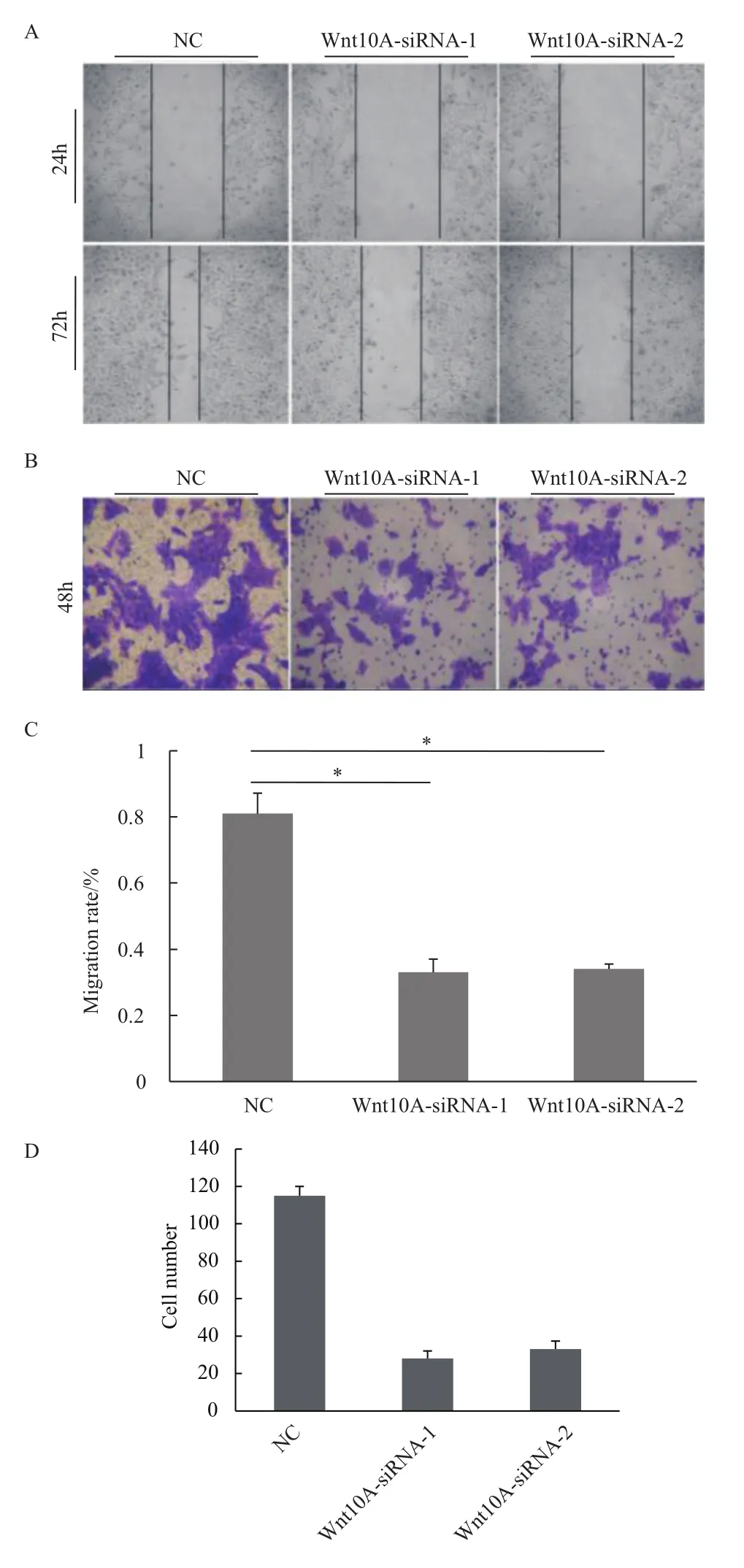
圖4 Wnt10A基因敲減抑制AGS細(xì)胞遷移及侵襲

圖5 Wnt10A基因調(diào)控Wnt/β-catenin信號(hào)
3 討論
Wnt10A基因是Wnt信號(hào)配體家族成員之一,而大量研究數(shù)據(jù)表明Wnt信號(hào)通路對(duì)促進(jìn)腫瘤細(xì)胞生長(zhǎng)起重要的作用。因此推測(cè)Wnt10A基因在腫瘤進(jìn)程中可能也發(fā)揮一定作用。借助qPCR技術(shù),我們檢測(cè)在胃癌組織樣本中Wnt10A基因表達(dá)量顯著高于癌旁正常組織。進(jìn)一步發(fā)現(xiàn)在常見胃癌細(xì)胞系中Wnt10A基因在RNA及蛋白水平也顯著高于正常胃上皮細(xì)胞。這些數(shù)據(jù)進(jìn)一步支持我們的推測(cè),即Wnt10A在胃癌發(fā)生、發(fā)展中有臨床意義。已有研究報(bào)道表明Wnt10A在食道癌、淋巴瘤、結(jié)直腸癌組織中也呈高水平表達(dá)[9,12-13]。同時(shí)有報(bào)道證實(shí)Wnt10A基因在腎癌的發(fā)生、進(jìn)展過程中發(fā)揮促癌基因的作用[10]。腫瘤具有兩大顯著特征即無限制生長(zhǎng)與侵襲能力強(qiáng)[14]。在本研究中,我們發(fā)現(xiàn)Wnt10A基因下調(diào)后,胃癌細(xì)胞的增殖能力、侵襲及遷移能力均大幅度下降。這表明Wnt10A基因的高表達(dá)促進(jìn)胃癌細(xì)胞增殖、遷移及侵襲行為。因此,體外功能實(shí)驗(yàn)與組織表達(dá)模式提示W(wǎng)nt10A在胃癌中也發(fā)揮促癌基因的功能。
Wnt信號(hào)家族已發(fā)現(xiàn)19個(gè)成員,大量研究表明Wnt分子表達(dá)增強(qiáng)或功能異常在各種腫瘤中均發(fā)揮重要作用。在Wnt/β-catenin信號(hào)途徑中,Wnt分子結(jié)合相應(yīng)受體激活Dishevelled蛋白,抑制GSK3β導(dǎo)致β-catenin分子集聚及核內(nèi)移,進(jìn)而結(jié)合TCF/LEF因子,促進(jìn)下游靶基因表達(dá)。促進(jìn)細(xì)胞生長(zhǎng)、增殖[15]。
在本研究中,我們發(fā)現(xiàn)Wnt10A基因下調(diào)后,經(jīng)典Wnt信號(hào)通路中的關(guān)鍵分子包括β-catenin、Cyclin D、TCF與LEF分子表達(dá)顯著降低。而Wnt10A-受體結(jié)合率降低導(dǎo)致Dishevelled蛋白活性減弱,從而解除對(duì)GSK3β的抑制作用,增強(qiáng)GSK3β表達(dá)。因?yàn)镚SK3β分子可促進(jìn)β-catenin的磷酸化水平升高,進(jìn)一步降解β-catenin,從而抑制Wnt信號(hào)激活。同時(shí)DKK1基因表達(dá)量也顯著增強(qiáng)。DKK1可結(jié)合受體LRP5/6,促進(jìn)膜受體內(nèi)吞作用,減少膜上受體占有率。而LRP5/6受體對(duì)Wnt配體結(jié)合對(duì)應(yīng)Frizzled受體并激活下游信號(hào)通路發(fā)揮關(guān)鍵作用[17]。因此DKK1表達(dá)增強(qiáng)必將阻斷Wnt信號(hào)激活。
當(dāng)我們以Wnt信號(hào)的小分子抑制劑LGK-974處理AGS細(xì)胞發(fā)現(xiàn)LGK-974單獨(dú)作用、si-Wnt10A單獨(dú)作用、LGK-974與si-Wnt10A聯(lián)合作用均可以顯著抑制AGS細(xì)胞生長(zhǎng),但是聯(lián)合作用組與單獨(dú)處理組無顯著差異,表明si-Wnt10A與LGK-974之間無顯著疊加效應(yīng)或協(xié)同效應(yīng)。LGK-974是經(jīng)典Wnt/βcatenin信號(hào)通路阻斷劑,可特異性結(jié)合Wnt下游porcn蛋白,抑制Wnt信號(hào)。這些數(shù)據(jù)表明在胃癌細(xì)胞中Wnt10A基因通過模擬調(diào)控經(jīng)典Wnt/β-catenin信號(hào)通路促進(jìn)胃癌細(xì)胞生長(zhǎng)與遷移。Myc基因是一個(gè)原癌基因,大量研究表明Myc基因在腫瘤組織及腫瘤細(xì)胞中表達(dá)量明顯增強(qiáng),腫瘤細(xì)胞增殖能力也顯著提高[16-17]。而且Myc基因參與腫瘤細(xì)胞代謝,有利于細(xì)胞生長(zhǎng)[17]。在本研究中,我們發(fā)現(xiàn)敲減Wnt10A基因后,Myc基因表達(dá)量顯著降低。而體外細(xì)胞功能實(shí)驗(yàn)已經(jīng)證明Wnt10A基因下調(diào)后,胃癌細(xì)胞增殖能力明顯降低。所以,在分子水平和細(xì)胞水平均證明Myc基因?qū)nt10A基因的功能非常關(guān)鍵。基于以上數(shù)據(jù)分析,我們提出在胃癌細(xì)胞中,Wnt10A基因通過模擬調(diào)控Wnt/β-catenin/Myc信號(hào)途徑發(fā)揮促進(jìn)癌細(xì)胞生長(zhǎng)及遷移的作用。
4 結(jié)論
Wnt10A基因在胃癌細(xì)胞系及組織中均呈高水平表達(dá),并且Wnt10A通過模擬激活Wnt/β-catenin/Myc信號(hào)通路促進(jìn)胃癌細(xì)胞增殖與遷移,發(fā)揮促癌基因的功能。
[1]Siegel RL, Miller KD, Jemal A. Cancer statistics, 2017[J]. CA Cancer J Clin, 2017, 67:7-30.
[2]Chen WQ, Zheng RS, Zhang SW, et al. Cancer statistics in China,2015[J]. CA Cancer J Clin, 2016, 66:115-132.
[3]Cervantes A, Roda D, Tarazona N, et al. Current questions for the treatment of advanced gastric cancer[J]. Cancer Treat Rev, 2013,39(1):60-67.
[4]王思萌, 高柳村, 帖君, 等. Cetuximab抑制胃癌SGC7901/ADR細(xì)胞的增殖并增加其化療敏感性[J]. 現(xiàn)代生物醫(yī)學(xué)進(jìn)展,2013, 13(12):2253-2256.
[5]Kühl SJ, Kühl M. On the role of Wnt/β-catenin signaling in stem cells[J]. Biochim Biophys Acta, 2013, 1830(2):2297-2306.
[6] Katoh M. WNT/PCP signaling pathway and human cancer(review)[J]. Oncol Rep, 2005, 14(6):1583-1588.
[7]Clevers H, Nusse R. Wnt/β-catenin signaling and disease[J].Cell, 2012, 149(6):1192-1205.
[8]Klaus A, Birchmeier W. Wnt signalling and its impact on development and cancer[J]. Nat Rev Cancer, 2008, 8(5):387-398.
[9]Long A, Giroux V, Whelan KA, et al. WNT10A promotes an invasive and self-renewing phenotype in esophageal squamous cell carcinoma[J]. Carcinogenesis, 2015, 36(5):598-606.
[10]Hsu RJ, Ho JY, Cha TL, et al. WNT10A plays an oncogenic Role in Renal Cell Carcinoma by activation WNT/β-catenin pathway[J].PLoS One, 2001, 7(10):e47649.
[11]Kirikoshi H, Sekihara H, Katoh M. Up-regulation of Wntl0A by tumor necrosis factor alpha and Helicobacter pylori in gastric cancer[J]. Int J Oncol, 2001, 19(3):533-536.
[12]Kirikoshi H, Inoue S, Sekihara H, et al. Expression of WNT10A in human cancer[J]. Int J Oncol, 2001, 19 :997-1001.
[13]Kirikoshi H, Sekihara H, Katoh M. WNT10A and WNT6, clustered in human chromosome 2q35 region with head-to-tail manner, are strongly coexpressed in SW480 cells[J]. Biochem Bioph Res Co,2001, 283:798-805.
[14]Hanahan D, Weinberg RA. Hallmarks of Cancer:The next generation[J]. Cell, 2011, 144(5):646-674.
[15]Delannay D, Cortay V, Patti D, et a1. Mimtic spindle asymmetry:a Wnt/PCP regulated mechanism generating asymmetrical division in cortical precursors[J]. Cell Rep, 2014, 6(2):400-414.
[16]Hsieh AL, Dang CV. MYC, Metabolic Synthetic Lethality, and Cancer[J]. Recent Results Cancer Res, 2016, 207 :73-91.
[17]Tarrado-Castellarnau M, de Atauri P, Cascante M. Oncogenic regulation of tumor metabolic reprogramming[J]. Oncotarget,2016, 7(38):62726-62753.
The Promoting Role of Gene Wnt10A in Proliferation and Migration of Gastric Cancer Cells and the Underlying Mechanism
GUO Hui-can
(Shi Jia Zhuang University of Applied Technology,Shijiazhuang 050081)
This work aims to elucidate the function of gene Wnt10A during the proliferation and migration of gastric cancer cells and the underlying molecular mechanism,for providing new target molecule in the diagnosis and treatment of gastric cancer. Real-time quantitative PCR and Western bolt analysis were used to detect gene expression;RNAi technology was applied to knockdown and decrease the expression of Wnt10A,and MTT assay,wound healing assay and transwell assay were employed to detect the biological behavior of gastric cancer cells.Results showed that gene Wnt10A expressed more highly in tumor tissues than that in adjacent normal tissues,approximately 3 times. The level of Wnt10A in gastric cancer cell lines was also higher than the normal cells GES. The proliferation rate of AGS cells reduced by 40%,the migration rate decreased by 40%,and the invasive ability was also downregulated about 70%,when the expression level of gene Wnt10A in AGS cells decreased about 60%. Furthermore,Western blot analysis demonstrated that the expressions of β-catenin,Cyclin D,TCF and gene Myc reduced after Wnt10A knockdown in AGS cells,while the expression levels of DKK1 and GSK3β increased,which was in consistent with the results by the treatment of LGK-974,a specific inhibitor against Wnt/β-catenin signaling. Conclusively,gene Wnt10A promotes the proliferation and migration of gastric cancer cells through simulating activation of Wnt/β-catenin/Myc signaling pathway,i.e.,functions as cancer-promoting gene.
Wnt10A;gastric cancer;AGS;Wnt/β-catenin signaling
2017-05-26
郭會(huì)燦,女,碩士,副教授,研究方向:生物制藥;E-mail:heweibingkkk@126.com
10.13560/j.cnki.biotech.bull.1985.2017-0434
(責(zé)任編輯 朱琳峰)

