玉米籽粒容重QTL定位
郭晉杰,陳景堂
(河北農業大學農學院/國家玉米改良中心河北分中心/河北省作物種質資源實驗室,河北 保定 071000)
玉米的容重是國際玉米商品品質的衡量指標。郭淑春等[1]研究表明,不論是什么品種,也不論是哪種粒型,玉米容重都與營養成分成正比,尤其是蛋白質含量,其容重隨著蛋白質含量的增加呈上升趨勢。所以,容重是最能體現玉米成熟度的指標。為使玉米的商品品質與國際接軌,我國于1999年制定了新的玉米定等標準,以容重作為衡量玉米商品品質好壞的標準。外觀品質與容重極顯著正相關,籽粒成熟度和飽滿度好、角質率高、色澤純正的品種容重等級高[2]。品種的遺傳特性是造成不同類型玉米品種間品質差異的主要原因,不同類型玉米品種的粗蛋白、粗脂肪、粗淀粉、賴氨酸含量、籽粒容重及其產量差異達顯著水平[3]。因此,探討容重的遺傳機制具有重要意義。
生物的不同性狀之間存在廣泛的表型和生理相關。Tuberosa等認為,QTL分析的手段為闡明性狀間的相關提供了有用的信息,并提出了性狀相關可能存在的4 種原因:(1)控制不同性狀的兩個基因緊密連鎖,分布在染色體的相同或相鄰區域;(2)同一個單一功能的基因,對一系列的基因起調控作用;(3)同一個基因能獨立控制兩個或多個不同的性狀;(4)兩個緊密連鎖的基因同時控制不同的性狀[4]。玉米容重是受多基因控制的數量性狀,其遺傳基礎復雜。近年來,隨著分子生物學的快速發展,有關玉米穗部性狀的基因定位進展也非常迅速,穗部產量性狀、株型性狀等已經進行多次定位,并獲得大量QTLs,而關于玉米容重的QTL定位并不多見。彭勃以齊319×黃早四(Q/H)和掖 478×黃早四(Y/H)構建的兩個F2∶3群體為材料,共檢測到18個加性QTLs,并且包括1個環境鈍感型的QTL,這些QTLs分布于第1、3、4、5、7、8、10條染色體上,其中第1條染色體上6個,第3條1個,第4條5個,第5條1個,第7條1個,第8條2個,第10條2個[5]。本研究以優良自交系農系531和航天誘變后的農系531作親本構建F2∶3群體為試驗材料,采用SSR分子標記構建連鎖圖譜,利用完備區間作圖法(ICIM)對容重進行定位,通過對同一材料的加性QTLs和上位性QTLs進行檢驗、分析,為挖掘控制玉米容重的主效QTL提供理論依據。
1 材料與方法
1.1 試驗材料
以野生型農系531(NX531)為母本、航天誘變后的純合農系531(M-NX531)為父本構建含有163個家系的F2∶3群體為試驗材料。NX531和M-NX531均由河北農業大學國家玉米改良分中心提供。
1.2 田間試驗設計
2010年將未誘變親本NX531與已自交純化的誘變材料M-NX531進行夏播,雜交后獲得 F1代植株和F2代種子;同年于海南進行加代繁殖F2,F2群體單株嚴格自交獲得F2∶3群體,以此為材料進行覆蓋全基因組、多態性良好的分子標記引物的篩選。2012年在邯鄲農科院試驗田進行F2種子的夏播,對F2單株進行嚴格自交獲得F2∶3群體,共163個家系,以此為材料進行性狀測定并完成QTL定位。試驗采用隨機區組設計,2次重復,行長4 m,行寬60 cm,株距25 cm。田間管理標準同普通生產大田一致。
1.3 性狀測定
待玉米果穗成熟后,取中間的連續5穗收獲,曬干后進行室內考種,脫粒后用容重器測定容重[6]。對所得數據整理后進行正態性檢驗,并進行方差分析和廣義遺傳力的計算[7]。廣義遺傳力的計算公式為:
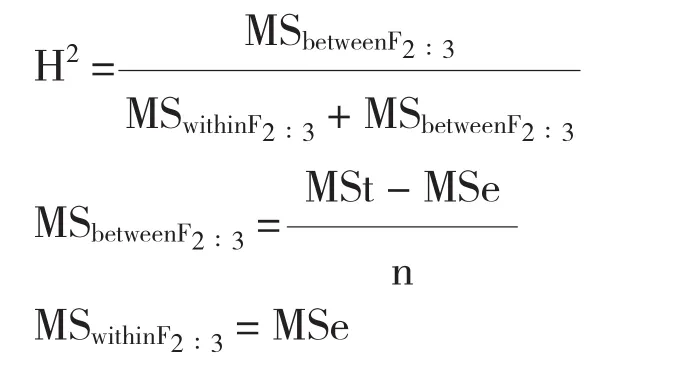
式中,MSbetweenF2∶3為基因型方差,MSwithinF2∶3為環境方差,MSt為家系間方差,MSe家系內方差。
1.4 SSR分析和QTL分析
在苗期分別剪取P1、P2、F1、F2 單株葉片,采用CTAB法抽提葉片DNA[8];參照IBM2 2005 Neighbors 2中發表的SSR分子標記(http// www.maizegdb.org),選擇均勻覆蓋玉米全基因組的964對引物,在NX531與M-NX531親本間進行親本多態性的篩選,挑選能夠覆蓋全基因組、多態性良好的分子標記[9-10],共獲得了親本間多態性良好的分子標記107對,以此進行作圖群體標記帶型數據采集,用于連鎖圖譜的構建和各性狀的QTLs分析;以F2單株為作圖群體,用Mapmaker 3.0軟件進行連鎖圖譜構建[11-12]。
利用QTL IciMapping3.0,采用完備區間作圖法(ICIM),對玉米容重進行QTL加性定位(ICIM-ADD)和QTL上位性定位(ICIMEPI),并確定定位到的QTLs的LOD值,計算每個QTL位點的遺傳效應及其對表型的貢獻率[13]。
進行加性定位時,確定 L O D的閥值為2.5,作圖函數采用Kosambi函數,步長為2.0。加性定位得出結果后,基因的作用方式按Stuber等的標準判定,DR=顯性效應值/ 加性效應值,DR= 0~0.20為加性方式,記為A;DR=0.21~0.80為部分顯性,記為PD;DR=0.81~1.20為顯性方式,記為D;DR>1.20為超顯性方式,記為OD[9]。
進行上位性定位時,確定LOD的閾值為5.0,作圖函數采用Kosambi函數,步長為2.0,顯著性水平為0.001[9]。
2 結果與分析
2.1 表型數據分析
玉米籽粒收獲后進行容重測量和數據篩選,對其進行方差分析,結果(表1)顯示,組間方差為604.92,組內方差為197.29,P值為1.7E-12,可見組間差異極顯著。依照所列公式,計算F2∶3的廣義遺傳力為50.81%。

表1 表型性狀分析結果
2.2 組合NX531×M-NX531的遺傳連鎖圖譜

圖1 F2∶3群體遺傳圖譜
選擇均勻分布于玉米10條染色體964對引物,在NX531與M-NX531親本間進行親本多態性的篩選,獲得親本間多態性良好的分子標記107對,進行F2分離群體單株基因型的鑒定,最終構建出整合了107對SSR引物位點的NX531×M-NX531 的遺傳連鎖圖(圖1)。從圖1可以看出,10條染色體上的107對引物在染色體上的分布如下:第1條染色體的引物數為34對,第2條和第10條染色體上的引物數為4對,第3條染色體上引物數為8對,第4條和第5條染色體上的引物數為5對,第6條和第7條染色體上的引物數為12對,第8條染色體上的引物數為13對,第9條染色體上的引物數為3對。從第1~10條染色體標記間平均距離分別為7.57、5.30、10.83、18.2、10.9、15.66、17.69、11.87、18.33、10.33。染色體長度范圍21.2~257.4 cM,標記位點個數為3~34個,總的遺傳長度為1 179.8 cM,約占玉米全基因組的85.76%,標記間的平均距離為11.91 cM。
2.3 容重QTL定位加性位置分析

圖2 容重QTL在染色體上的分布及LOD值
利用QTL定位軟件QTL IciMapping3.0,選擇利用完備區間作圖法(ICIM)作圖,確定以LOD的閥值為2.5,即某位點的LOD≥2.5時認定該位點存在與標記連鎖的QTL。對容重加性效應進行QTL定位的結果見圖2和表2。由圖2可以得到,玉米10條染色體各位點的LOD值大于2.5的共有3個,分別位于第1、6、8條染色體上。因此,此次容重QTL加性定位共檢測到3個QTLs,分別命名為qBD1、qBD2和qBD3。從表2可以看出,qBD1位于Ch1上的bnlg2238和bnlg1866之間,其位點在Ch1的142.0 cM 處,與其上一個連鎖標記bnlg2238的遺傳距離為3.2 cM,與其下一個連鎖標記bnlg1866的遺傳距離為1.8 cM;qBD2位于Ch6上的umc1520和umc1462之間,其位點在Ch7的150.0 cM處,與其上一個連鎖標記umc1520的遺傳距離為13.9 cM,與其下一個連鎖標記umc1462的遺傳距離為12.7 cM;qBD3位于Ch8上的phi080和umc2361之間,其位點在Ch1的24.0 cM處,與其上一個連鎖標記phi080的遺傳距離為17.7 cM ,與其下一個連鎖標記umc251的遺傳距離為14.3 cM。
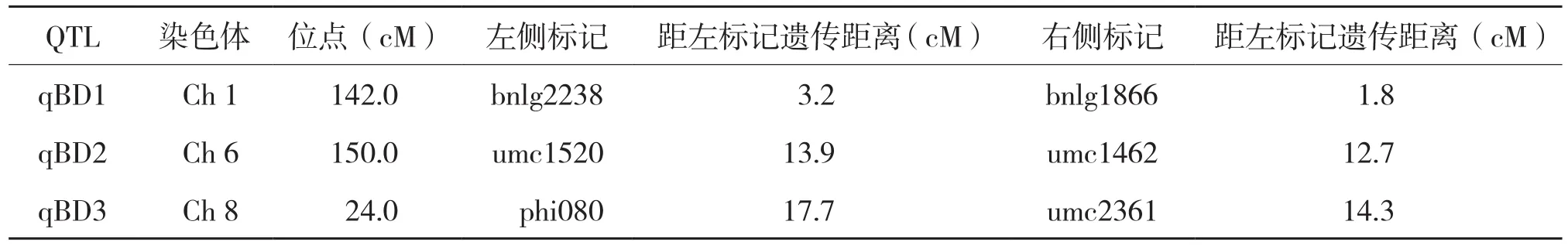
表2 QTLs位點在染色體上的位置
2.4 容重QTL定位遺傳分析
利用QTL定位軟件QTL IciMapping3.0,對容重上位性效應進行QTL定位的結果見表3。從表3可以看出,位于Ch1上的qBD1的LOD閥值為2.79,對表型的貢獻率為6.90%,基因的作用方式為加性,在該位點對加性效應增效作用的親本為NX531;位于Ch6上的qBD2的LOD閥值為4.39,對表型的貢獻率為9.24%,基因的作用方式為顯性,在該位點對加性效應起增效作用的親本為NX531;位于Ch8上的qBD3的LOD閥值為3.43,對表型的貢獻率為4.15%,基因的作用方式為顯性,在該位點對加性效應起增效作用的親本為NX531。

表3 容重的QTL分析結果
2.5 容重QTL定位上位性分析
利用QTL定位軟件QTL IciMapping3.0,選擇利用完備區間作圖法(ICIM)作圖,確定以LOD的閥值為5.0,定位結果如圖3和表4所示。從圖3和表4可以看出,共檢測到3對上位性QTLs,涉及包括第1、3、4、10條共4條染色體的6個區段,不存在顯著性位點。按照互作QTL涉及的2個基因座是否存在顯著效應,本試驗檢測到的互作QTL只有1種類型,即NN類型(無顯著效應基因座與無顯著效應基因座之間的互作)共3對,分別為:Ch1上的umc2217-umc1169和Ch3上的bnlg1047-umc2266,最顯著的上位性效應為DD,表型貢獻率為14.92%;Ch3上的umc2266-umc2166和Ch4上的umc1808-umc1559,最顯著的上位性效應為DD,表型貢獻率為27.34%;Ch3上的umc1229-umc1520和Ch10上的umc2265-dupssr5,最顯著的上位性效應為AD,表型貢獻率為24.82%。上位性QTL對容重的遺傳貢獻率范圍為14.92%-27.34%,共解釋67.08%表型遺傳變異。
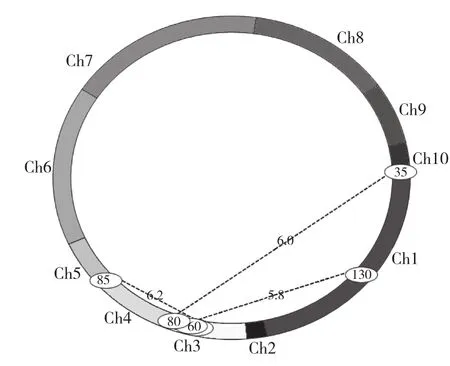
圖3 容重QTL上位性互作結果

表4 容重QTL上位性互作結果
3 討論
在檢測主效QTL 時,可能會犯兩類的錯誤:第一類是檢測到假陽性QTL,第二類是真實存在的QTL沒有被檢測到[11]。對于第二類的錯誤,一般通過加大分離群體的數量及提高遺傳圖譜的標記密度予以降低;對于第一類的錯誤,一般通過界定適當的LOD閾值來予以降低。本試驗中,所得遺傳圖譜總長度為1 179.8 cM,約占玉米染色體總長度的85.76%,染色體上的多態性良好的標記為107個,第1~10條染色體標記間平均距離分別為7.57、5.30、10.83、18.2、10.9、15.66、17.69、11.87、18.33、10.33。其中第6、7和9號染色體上標記間的距離較大,易發生第二類錯誤,漏掉真實存在的標記;其余染色體標記距離較近,減少了第二類錯誤的概率。但本試驗中確定的LOD=2.5較經驗值3.0偏小,可能因此造成檢測到假陽性的QTL。
本試驗中,在qBD1、qBD2、qBD3等3個位點起增效作用的親本均為NX531。但以往的眾多QTL定位試驗已證明,對相同性狀的不同的QTL位點起增效作用的可能是雙親中的任何一個。由于增效等位基因可能同時來自雙親,所以在聚合創制優良育種新材料時,雙親材料的遺傳貢獻均應當引起重視[14]。Song等[11]將這種親本的增效作用稱為隱蔽基因效應(cryptic gene effect),認為某些等位基因在親本中被緊密連鎖的其它基因所隱蓋,發生重組后可被檢測到[15]。
目前國內關于玉米容重QTL定位的試驗報道尚不多見,因此定位到的QTL數量很少[16-17]。彭勃[5]對容重進行QTL定位,在不同試驗地區共檢測到18個QTL位點,其中位于Ch1上的位點位置分別為148、180、214、234、236、410 cM,位于Ch8上的位點位置分別為134和0cM,沒有位于Ch6上的位點。而本試驗檢測出的3個QTLs分別位于Ch1的142.00 cM處、Ch6的150.00 cM處和Ch8的24.00 cM處。許理文等[18]利用先玉335的DH系群體和SNP標記定位玉米容重QTL,在不同年份和地點定位到5個QTL位點分布在第1、4、8、9號染色體上。許蒙蒙等[19]利用農大108的RIL群體定位了動態的玉米容重QTL,本試驗中位于Ch1上142.00 cM處的位點與彭勃[5]位于148 cM處的位點接近,可看做相同QTLs。因此,本試驗與前人試驗檢測到一個相同位點,其余的位點均為新發現標記。
本試驗中3個位點的基因作用方式分別為A、D、D,而前人研究結果指出容重的性狀遺傳力較高,主要受加性效應控制[17-18]。
存在不同位點和不同基因作用方式現象的原因可能包括:(1)不同的親本組配出的不同群體在基因型上存在較大差別;(2)QTL易受環境條件的影響,表現不穩定;(3)試驗中大多數QTL定位的平均分子標記密度都在10 cM以上,因此定位精度不高;(4)檢測過程中假陽性標記和真實存在的卻未被檢測到的標記偏多會造成位點錯開。
上位性在復雜數量性狀的遺傳和雜種優勢的形成中起著重要的作用。上位性在不同性狀之間的互作位點、作用方式不盡相同,但其在玉米穗部性狀中普遍存在,是不能被忽略的,在遺傳中可能有著與玉米主效QTL同樣重要的作用[20]。在本研究中,本群體檢測到3對上位性QTL,這3對上位性互作QTLs為非顯著QTL位點間的互作,即當這些上位性QTLs單獨存在時,對表型性狀的作用很小,只有與其他位點發生互作時才能影響表型性狀。這也說明除了加性效應和顯性效應外,上位性效應也是容重的重要遺傳基礎。
[1]郭淑春,吳月紅,錢麗燕.用容重評定玉米質量方法的研究[J].糧食儲藏,1996(5):33-34.
[2]蘇義臣,金明華,蘇桂華.玉米容重的相關性分析[J].吉林農業科學,2007,32(3):4-16.
[3]李建奇.不同類型品種對春玉米產量、品質的影響[J].種子,2006,25(12):58-60.
[4]Tuberosa R,Salvi S,Sanguineti M,et al.Mapping QTLs regulating morphophysiological traits and yield:case studies,short comings and perspectives in drought stressed maize[J].Ann Bot ,2002,89(7):941-963.
[5]彭勃.玉米籽粒產量及其相關性狀遺傳基礎的研究[D].北京:中國農業科學院,2010.
[6]張靜,王彩紅,趙永鋒,等.玉米種質資源子粒容重和品質性狀差異分析[J].植物遺傳資源學報,2016,17(5):832-839.
[7]任安然,武麗芬,關紅輝,等.不同種植密度下玉米莖稈纖維性狀和抗倒性相關分析[J].植物遺傳資源學報,2017,18(4):653-664.
[8]王芳,王化俊,王漢寧.玉米基因組DNA的提取及SSR分析[J].玉米科學,2006,14(2):30-32.
[9]Stuber C W,Edwards M D,Wendel J F.Molecular marker- facilitated investigations of quantitative trait loci in maize,Factors influencing yield and its component traits[J].Crop Science,1987,27:639- 648.
[10]Liu Y,Guo J J,Zhang D M,et al.Genetic diversity and linkage disequilibrium estimation among the maize breeding germplasm for association mapping[J].International Journal of Agriculture and Biology,2014,16(5):851-861.
[11]Zeng Z B.Precision mapping of quant itative trait loci[J].Genetics,1994,136(4):1457-1468.
[12]邢光南,趙團結,蓋鈞益.關于Mapmaker遺傳作圖中標記分群和排序操作技術的討論[J].作物學報,2008,34(2):217-223.
[13]李慧慧,張魯燕,王建康.數量性狀基因定位研究中若干常見問題的分析與解答[J].作物學報,2010, 36(6):918-93
[14]陳天青.玉米穗尖扁平及相關穗部性狀的QTL分析[D].重慶:西南大學,2007.
[15]Song K,Slocum M K,Osbom T C.Molecular marker analysis of genes encoding morphological variation inBrassica rapa(syn.campestris)[J].Theor Appl Genet,1995,90(1):1-10.
[16]宋錫章,張寶石.春玉米主要穗部性狀配合力及遺傳參數分析[J].中國農學通報,2007,23(6):245-249.
[17]柯永培,石海春,牛應澤,等.玉米營養品質性狀的遺傳與配合力分析[J].四川大學學報,2006,43(5):1148-1153.
[18]許理文,段民孝,田紅麗,等.基于SNP標記的玉米容重QTL分析[J].玉米科學,2015,23(5):21-25.
[19]許蒙蒙,秦永田,陳永強,等.玉米籽粒容重動態變化的QTL分析[J].中國農業科學,2016,49(23):4480-4487.
[20]譚巍巍,王陽,李永祥,等.不同環境下多個玉米穗部性狀的QTL分析[J].中國農業科學,2011,44(2):233-244.

