丹參酮ⅡA對COPD模型大鼠肺組織炎癥反應的影響及相關機制研究
俞 凌 陳 曄
慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD)是世界上第四大致死疾病,常伴隨病理生理性并發癥導致過早死亡,給家庭和社會帶來沉重的負擔,目前已成為全球公共健康所面臨的一個重要挑戰[1-2]。COPD的確切病因并不清楚,一般認為其發病機制主要與肺臟對有毒顆粒或氣體的炎癥反應增強有關。近年研究[3-4]發現,丹參酮ⅡA對心腦血管疾病、腫瘤等具有潛在的治療作用,表現出多種生物活性,丹參酮ⅡA不管在細胞還是動物模型上均表現出多種抗炎特性。本研究觀察丹參酮ⅡA對 COPD大鼠肺組織腫瘤壞死因子-α(tumor necrosis factor,TNF-α)、白細胞介素 1β(interleukin-1β,IL-1β)、白細胞介素 6(interleukin-6,IL-6)、白細胞介素 8(interleukin-8,IL-8)等炎癥因子的影響,并探討其相關機制。
1 材料與方法
1.1 實驗動物 清潔級健康雄性SD(sprague dawley)大鼠 40只,實驗動物合格證:SYXK(浙)2013-0184,9周齡,體質量150±20g。動物飼養于 12h明暗循環的適宜環境中(光照時間:8:00—20:00),自由攝食飲水。
1.2 實驗試劑 脂多糖(LPS)購自美國Sigma公司;煙熏采用香煙(每支含煙堿量為13mg,尼古丁為1.0mg)。大鼠腫瘤壞死因子(TNF)-α ELISA 試劑盒(MultiSciences,批號 70-EK3822/2)、大鼠 IL-1β ELISA 試劑盒(PeproTech,批號 96-900-M91)、大鼠白介素 6ELISA試劑盒(MultiSciences,批號 70-EK3062/2),購自杭州聯科公司。大鼠白介素-8ELISA 試劑盒(Maibio,批號 MRK0010-48T),購自上海麥約爾生物技術有限公司。NF-kB p-p65抗體(批號 3034)、Phospho-NF-kB p65抗體(批號 3033)購自CST公司。
1.3 動物分組及給藥 將SD大鼠40只隨機分為正常對照組、模型組、丹參酮ⅡA低劑量組、丹參酮ⅡA高劑量組,每組10只。從造模第29天至第50天,丹參酮ⅡA低、高劑量組大鼠分別給予腹腔注射1mL/(kg·d)、2mL/(kg·d)的丹參酮ⅡA磺酸鈉注射液。對照組和模型組給予大鼠腹腔注射2mL的0.9%氯化鈉溶液。每周稱量大鼠體質量以調整給藥劑量。
1.4 大鼠COPD模型構建[1]大鼠COPD模型制備用氣管內滴注脂多糖(Lipopolysaccharide,LPS)聯合煙熏法。模型組、丹參酮ⅡA高、低劑量組大鼠每天煙熏2次,兩次間隔10h,每次在自制吸煙染毒箱內被動吸煙30支,共50天;其中造模第1天、第28天每只大鼠氣道內滴入脂多糖(LPS)0.2mL(200μg),該日內不予煙熏。正常對照組每天在自制吸煙染毒箱內呼吸相同時間的正常空氣,并于造模第1、28天每只大鼠氣道內滴入0.2mL生理鹽水。每次煙熏后,大鼠置于鼠籠內常規飼養。于第52天收集大鼠肺組織進行病理學觀察及形態定量分析,確定模型是否建立成功。
1.5 標本檢測及方法 實驗第52天處死大鼠,解剖游離腹主動脈,腹主動脈取血,注入10mL EP管中,每只大鼠留取5mL血量,室溫靜置、離心后去上清液,裝于5mL EP管中,置-80℃冰箱中保存。大鼠肺泡灌洗液采集:動物處死后,頸部正中切開皮膚,剪開肌肉后暴露氣管,眼科剪尖端向心與頸部平面呈30°剪一小口,直徑1.5mm塑料軟管行氣管插管進入2cm,雙重棉線結扎固定。沿胸骨打開胸腔,暴露心肺,夾閉右主支氣管,注射器吸取生理鹽水與氣管插管相連。用4℃冷藏的生理鹽水灌洗左肺2次,30~60s內緩注4mL,在左肺停留30s后回抽,反復2次后收集肺泡灌洗液,輕揉胸廓促進灌洗液流出,注意動作輕柔,回收率可達90%。4℃ 1000r/min離心10min,上清液-80℃保存待測。ELISA法測定血清和肺泡灌洗液 TNF-α、IL-1β、IL-6、IL-8水平,檢測方法按照相應的試劑盒說明進行操作,以標準品的濃度為橫坐標,450nm波長的OD值為縱坐標,繪制雙對數曲線,根據樣品OD值在雙對數曲線上計算出其相應的濃度。
1.6 大鼠肺組織病理學觀察及形態定量分析 腹主動脈采血后,剖開胸腔,在交叉處結扎左側主支氣管,取出左肺組織,10%福爾馬林固定。右肺組織放入-80℃冰箱中保存。結扎右側主支氣管及左上肺支氣管并注入4%多聚甲醛至左下肺膨脹,隨后將左下肺浸入4%多聚甲醛中固定24h,石蠟包埋、4μm連續切片,進行常規蘇木素-伊紅(haematoxylin-eosin staining,HE)染色,觀察大鼠肺組織炎癥細胞浸潤情況。
1.7 蛋白質免疫印記檢測(Western blot) 用-80℃保存的肺組織提取總蛋白(檢測)、核蛋白(檢測NFΚb)和胞漿蛋白(檢測),Bradford法測定蛋白濃度。5%濃縮膠80V衡壓30min,10%分離膠恒壓110V,40min,濕轉120mA恒流50min,37℃搖床5%BSA封閉 2h,轉印后加入一抗:NF-kB(1:1000)4℃過夜。TBST洗膜5min,共3次。山羊抗兔或山羊抗鼠近紅外二抗1:15000,常溫避光搖床孵育1.5h,避光TBST洗膜15min,共4次。Odyssey V3.0掃描儀掃描膜。重復3次。
1.8 統計學方法 所有數據應用SPSS21.0統計軟件分析處理。組間比較采用單因素方差分析(One-Way ANOVA)方法進行數據分析,方差齊采用最小顯著差法(least significant difference,LSD)檢驗,方差不齊者采用Dunnett’s T3檢驗,結果以(±s) 進行描述。以P<0.05為差異有統計學意義。
2 結 果
2.1 丹參酮ⅡA對COPD大鼠肺組織炎癥反應的影響 鏡下觀察可見對照組肺組織未出現明顯病理改變及炎癥反應,氣管支氣管管腔正常,無異常滲出物,黏膜下層未見炎癥細胞浸潤;肺泡完整,肺泡間隔正常且未見炎癥細胞浸潤。模型組可見明顯炎癥反應及病理改變,氣管管腔呈不規則擴張,平滑肌增厚,內有黏液滲出物,黏膜下層和肌層內可見大量嗜酸性粒細胞及單核細胞等炎癥細胞浸潤;肺泡間隔增厚,出現塌陷并伴有炎癥細胞浸潤。與模型組相比,丹參酮ⅡA低劑量組炎癥細胞減少,氣管管腔內分泌物減少。丹參酮ⅡA高劑量組肺組織結構趨于正常,只有極少量炎性細胞浸潤。見圖1(封二)。
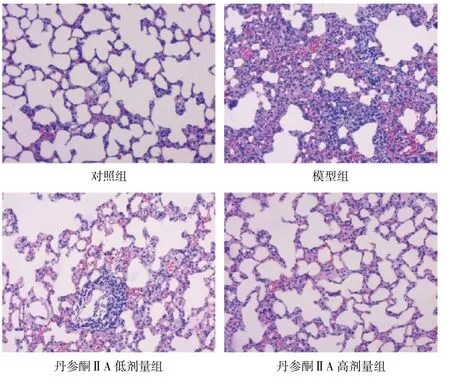
圖1 各組大鼠肺組織病理情況(HE染色,×100)
2.2 丹參酮ⅡA對COPD大鼠血清及肺泡灌洗液炎癥因子TNF-α、IL-1β、IL-6、IL-8的影響 模型組大鼠血清及肺泡灌洗液炎癥因子TNF-α、IL-1β、IL-6、IL-8含量均較對照組明顯升高(P<0.01)。丹參酮ⅡA低劑量組大鼠血清及肺泡灌洗液TNF-α、IL-1β、IL-6、IL-8的含量較模型組有所下降(P<0.05,P<0.01),但較對照組仍明顯升高(P>0.05)。丹參酮ⅡA高劑量組大鼠血清及肺泡灌洗液TNF-α、IL-1β、IL-6、IL-8的含量較模型組明顯下降(P<0.05,P<0.01),但未完全恢復。見表1~2。
表1 各組大鼠血清 TNF-α、IL-1β、IL-6、IL-8比較(pg/mL,±s)

表1 各組大鼠血清 TNF-α、IL-1β、IL-6、IL-8比較(pg/mL,±s)
注:與模型組比較,*P<0.05,**P<0.01;TNF-α:腫瘤壞死因子-α;IL-1β:白細胞介素-1β;IL-6:白細胞介素-6;IL-8:白細胞介素-8
組別對照組模型組丹參酮ⅡA低劑量組丹參酮ⅡA高劑量組只數10101010TNF-α 117.39±4.89**250.21±12.07197.89±6.56**166.27±4.74**IL-1β 29.91±2.31**50.14±3.0643.11±2.2137.80±2.01**IL-694.50±5.37**167.58±6.01141.05±8.85*122.92±9.04**IL-898.80±5.00**168.90±8.63140.58±8.43*118.84±4.73**
表2 各組大鼠肺泡灌洗液 TNF-α、IL-1β、IL-6、IL-8比較(pg/mL,±s)

表2 各組大鼠肺泡灌洗液 TNF-α、IL-1β、IL-6、IL-8比較(pg/mL,±s)
注:與模型組比較,*P<0.05,**P<0.01;TNF-α:腫瘤壞死因子-α;IL-1β:白細胞介素-1β;IL-6:白細胞介素-6;IL-8:白細胞介素-8
組別對照組模型組丹參酮ⅡA低劑量組丹參酮ⅡA高劑量組只數10101010TNF-α 80.53±4.43**132.45±7.25100.26±3.33**91.07±2.96**IL-1β 25.89±1.34**41.18±2.8934.34±2.5432.87±2.53*IL-666.17±5.01**121.91±6.5195.66±5.64**82.35±4.58**IL-867.32±7.44**116.03±9.3398.925±5.3187.58±6.37*
2.3 丹參酮ⅡA對COPD大鼠肺組織NF-kB pp65表達的影響 通過Image J軟件分析獲得各組相應灰度值,以GAPDH為內參,計算磷酸化核因子kB p65(nuclear factor kB p65phosphorylation,NF-kB p-p65)和核因子 kB p65(nuclear factor kB p65,NF-kB p65)的相對表達量。與對照組比較,模型組大鼠肺組織NF-kB p-p65表達水平明顯升高(P<0.05),即NF-kB明顯激活。與模型組比較,丹參酮ⅡA高、低劑量組NF-kB p-p65表達水平明顯降低(P<0.05),即丹參酮ⅡA抑制了NF-kB的激活。另外,各組之間NF-kB p65表達量比較無明顯差異,即丹參酮ⅡA不影響NF-kB表達總量,見圖2(封二)。以上結果表明,丹參酮ⅡA改善COPD及相關炎癥反應的作用可能與其抑制炎癥反應的中心通路NF-kB的激活相關。

圖2 各組大鼠肺組織NF-kB p-p65和NF-kB p65表達比較
3 討論
丹參酮ⅡA是丹參的有效成分,呈脂溶性,傳統觀點認為其具有活血化瘀、安神養心的功效,近年來其抗炎、抗菌等作用日趨被重視,是一種潛在的安全性藥物。前期研究[5-7]表明,COPD與炎癥反應密切相關,其中參與COPD發病的炎癥細胞主要為中性粒細胞、巨噬細胞及T淋巴細胞等,此外還有TNF-α、IL-1β、IL-6、IL-8等炎癥物質。其中TNF-α是目前發現的炎癥作用最強的細胞因子,能夠直接激活炎癥細胞,促使炎性反應進一步擴大,被認為是機體炎性狀態的直觀反映,也是判定療效的重要指標[8]。而白細胞介素可趨化中性粒細胞并使其持續活化,進而釋放炎性介質,連鎖加重炎癥[9]。實驗應用氣管內滴注脂多糖聯合煙熏法構建的大鼠COPD模型[10-11],該模型與人類慢性阻塞性肺疾病在病理生理學上具有相似的改變,可有效的模擬臨床病人COPD的發展過程。結果顯示,COPD模型組大鼠肺組織有明顯的以淋巴細胞為主的炎性細胞浸潤現象,且明顯促進血清及肺泡灌洗液炎癥因子TNF-α、IL-1β、IL-6、IL-8的釋放,該現象與前期文獻報道一致。而給予丹參酮ⅡA高、低劑量處理后,能明顯降低該炎癥反應(P<0.05,P<0.01),且呈劑量依賴性。
NF-kB激活是COPD的發病機制中非常重要的環節[12-13]。有實驗報道,CODP患者氣道上皮NF-kB表達顯著增高[14]。另外有研究發現脂多糖進入肺臟后與Toll樣受體4(TLR-4)結合,通過髓樣分化因子(MyD88)依賴性和MyD88非依賴性兩種信號轉導途徑激活NF-kB和干擾素調節因子3,進一步刺激單核細胞、內皮細胞及中性粒細胞,合成釋放一系列炎性介質(如TNF-α、IL-1等),介導氣道及肺組織的炎癥反應[15-16]。本實驗結果表明,模型組與對照組相比,NF-kB顯著激活(P<0.05),與之前研究報道的結果一致。進一步與模型組相比,丹參酮ⅡA抑制NF-kB的激活。提示丹參酮ⅡA對炎癥因子的抑制作用可能是通過抑制NF-kB的激活所產生。綜上,我們認為丹參酮ⅡA能減少COPD大鼠肺組織炎癥反應,抑制炎癥因子釋放,這可能與其抑制炎癥反應的中心通路NF-kB的激活相關。
[1] V e s t b oJ,H u r dS S,A g u s t i A G,e t a l.G l o b a l s t r a t e g yf o r t h e diagnosis,management,and prevention of chronic obstructive pulmonary disease:gold executive summary[J].Am J Respir Crit Care Med,2013,187(4):347-365.
[2] A g u s t i A G,N o g u e r aA,S a u l e d aJ,e t a l.S y s t e m i ce f f e c t so f chronic obstructive pulmonary disease[J].Eur Respir J,2003,21(2):347-360.
[3]M i nX u.T a n s h i n o n eI I Ar e d u c e s l e t h a l i t ya n da c u t elung injury in LPS-treated mice by inhibition of PLA2activity[J].European Journal of Pharmacology,2009,607(1-3):194-200.
[4]陳利平.丹參酮ⅡA磺酸鈉注射液聯合降脂方治療非酒精性脂肪肝療效觀察[J].新中醫,2014,46(7):67-69.
[5]L a n g e nR C,G o s k e r H R,R e m e l s A H,e t a l.T r i g g e r s a n dm echanisms of skeletal muscle wasting in chronic obstructive pulmonary disease[J].Int J Biochem Cell Biol,2013,45(10):2245-2256.
[6] F r o s t R A,N y s t r o mG J,J e f f e r s o nL S,e t a l.H o r m o n e,c y tokine,and nutritional regulation of sepsis-induced increases in atrogin-1and MuRF1in skeletal muscle[J].Am J Physiol Endocrinol Metab,2007,292(2):E501-512.
[7] G e rE B,I s l a m J,B u e t n e r C,e t a l.M e c h a n i s m so f g l u c o c o r t icoid-induced insulin resistance:Focus on adipose tissue function and lipid metabolism[J].Endocrinol Metab Clin North Am,2014,43(1):75-102.
[8]張文輝,陳永鳳,左麗娜,等.慢性阻塞性肺疾病血漿 IL-16、TNF-α 和 FIB 的表達[J].臨床肺科雜志,2014,19(12):2142-2144.
[9]杜秀婷,林海雄,卓桂鋒,等.蘇子降氣湯對慢性支氣管炎模型小鼠 TNF-α、IL-8表達的影響[J].時珍國醫國藥,2015,26(10):2311-2313.
[10]李紅梅,崔德健,佟欣,等.熏香煙加氣管注內毒素和單純熏香煙法建立大鼠COPD模型[J].中國病理生理雜志,2002,18(7):808-812.
[11]孟瑩,余常輝,李婷,等.T o l l樣受體4在煙熏和脂多糖聯合煙熏所致肺損傷大鼠中的表達及意義[J].中華醫學雜志,2013,93(28):2230-2234.
[12] Y a n gS R,C h i d aA S,B a u t e r M R,e t a l.C i g a r e t t es m o k einduces proinflammatory cytokine release by activation of NF-Kappa B and posttranslational modi cations of histone deacetylase in macrophages[J].Am J Physiol Lung Cell Mol Physiol,2006,291(1):L46-57.
[13]B a r n e s P J.R o l e o f H D A C 2i nt h e p a t h o p h y s i o l o g y o f C O P D[J].Annu Rev Physiol,2009,71(1):451-464.
[14]Yagi O,Aoshiba K,Nagai A.Activation of nuclear factorkappa B in airway epithelial cells in patients with chronic obstructive pulmonary disease[J].Respiration,2006,73(5):610-616.
[15]Cronin JG,Turner ML,Goetze L,et al.Toll-like receptor 4and MYD88-dependent signaling mechanisms of the innate immune system are essential for the response to lipopolysaecharide by epithelial and stromal cells of the bovine endometrium[J].Biol Reprod,2012,86(2):51.
[16]周敏,萬歡英,黃紹光.Toll樣受體4在人肺泡上皮細胞株中的表達及其在細胞炎癥反應中的作用[J].中華醫學雜志,2008,88(30):2112-2116.

