慢性阻塞性肺疾病患者的營養評估及營養支持現況調查
石 勱,陳 杰,陳 禹,馬小陶,金江麗
(1中日友好醫院營養科,北京 1000292; 2中日友好醫院預防保健科,北京 100029;3中日友好醫院高干醫療科,北京 100029)
1998年,慢性阻塞性肺疾病(chronic obstructive pulmonary disease,COPD,簡稱慢阻肺)全球倡議(Global Initiative for Chronic Obstructive Lung Disease,GOLD)啟動,目標是根據最佳研究結果制訂慢阻肺的推薦管理策略,現已更新GOLD 2015版。早在2011年底,COPD的診斷、處理和預防全球策略就指出營養不良是COPD預后不良的獨立因子[1]。門診COPD患者營養不良的發生率約25%,住院患者高達50%,合并呼吸衰竭的COPD危重病人高達60%,應用機械通氣治療的患者甚至達到71%[2]。無論自主呼吸或機械通氣的呼吸疾病患者,營養不良均損害呼吸肌功能、通氣動力、肺防衛機制,最終削弱肺功能。營養治療是COPD治療中的重要組成部分,患者對熱量需求量高,但疾病本身造成患者攝食受限,經口自然進食往往無法滿足患者的營養需求。如何聯合應用自然進食及腸內營養(enteral nutrition,EN)和腸外營養(parenteral nutrition,PN)以保證熱量的適宜攝入及營養素的合理供給,改善患者的營養狀況,改善受損的肺功能、促進疾病康復,為此筆者進行了專題研究。
1 對象與方法
1.1 研究對象
我院營養科2016年7月1日—2017年6月30日共會診和隨診COPD患者197例,年齡50~87歲,平均年齡76.4±12.7歲,男108例,女89例,病程2~52年。患者入院后,測定血清白蛋白(ALB)、測量患者的身高和體重,計算體重指數(BMI)。COPD診斷參照《慢性阻塞性肺疾病診治指南》(2013修訂版)[3]的診斷標準。
1.2 營養評估
(1)營養風險:營養風險篩查2002(Nutritional Risk Screening 2002,NRS2002)[4]進行營養風險篩查,NRS2002評分≥3分即認為存在營養風險。
(2)營養不良:(1)BMI<18.5 kg/m2并伴有一般情況差者。(2)或無準確BMI及肝腎功能明顯異常,ALB<30g/ L為營養不良。(3)亦可測量小腿圍、三頭肌皮褶厚度(triceps skinfold thickness,TSF)和上臂肌圍(arm muscle circumference,AMC),小腿圍<31 mm、男性TSF<8.3 mm、女性TSF<15.3mm、AMC<20.83 cm為營養不良。
(3)能量及營養素攝入評估:能量達到推薦攝入量±10%,可認為合理;三大營養素攝入比例滿足蛋白質、脂肪、碳水化合物的供能比例分別為15%~20%、30%~35%、50%,可視為合理。
1.3 醫學營養治療(medical nutrition treatment,MNT)現況調查
COPD的常規治療包括抗感染、止咳化痰、平喘治療、營養支持。營養支持現況調查包括兩方面:營養支持途徑和營養供給方案。
(1)結合患者的臨床情況,選擇營養支持的途徑。營養支持途徑包括經口自然進食、經口營養補充(oral nutritional supplements,ONS)、EN(可管飼)和PN[5]。胃腸功能正常的情況下優選經口自然進食和經口營養補充(ONS),經口攝入不足可EN(管飼)支持。胃腸的耐受性受限,需要PN支持協同治療,待胃腸功能恢復,EN逐漸取代PN,逐步向經口自然進食過渡。營養攝入可通過飲食日記,數據錄入中西醫結合營養治療計算機專家系統MX1.1版,評估進食方式及營養素攝入情況。
(2)經口天然食物不足能量60%時,優先考慮ONS,可選用勻漿、整蛋白營養粉等。如患者胃腸功能正常,但進食時喘憋是干擾進食量的主要因素。建議患者在現在進食的基礎上,用EN(鼻飼)途徑補充熱量,日加餐1~2次(500~1 000kcal),補充乳清蛋白粉10~20g,以實現三大營養素的合理配比。EN包括能全力、百普力、瑞代、安素、勻漿、蛋白粉等。
(3)MNT方案(高脂肪低碳水化合物是基本原則)的制定流程[6]:①每日熱量總需求≌靜息能量消耗(rest energy expenditure,REE),REE=每日基礎熱量消耗(basal energy expenditure,BEE)×應激系數,BEE采用Harris-Benedict公式計算;穩定期COPD患者應激系數1.0~1.1,急性期應激系數為1.25~1.3,若合并呼吸衰竭、應用機械通氣時應激系數為1.5~1.6。②營養素的配給:經口自然進食、ONS和EN(鼻飼):蛋白質、脂肪、碳水化合物的合理供能比例應為15%~20%、30%~35%、50%,注意維生素B、胡蘿卜素、磷、鈣、鎂的補給。對食欲減退的病人,除了設法刺激食欲外,可采用少食多餐的辦法。PN:葡萄糖每日最低供給150g/d,COPD患者非蛋白熱能中糖脂比2∶3~1∶1。注意各種維生素、微量元素、谷氨酰胺、精氨酸、ω-3脂肪酸等的補充。
(4)監測和評估:MNT需3~5d時間逐步過渡到推薦量。日常監測患者的胃腸耐受情況(有無腹瀉、腹脹、便秘等)熱量攝入及營養素攝入達標情況。觀察記錄體重及握力的變化,以評價整體營養狀況和肌肉力量的恢復情況。
1.4 統計學處理
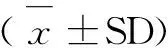
2 結果
2.1 COPD營養風險篩查及營養不良情況
197名COPD患者中,營養風險的發生率為72.59%(143/197),營養不良的發生率為49.75%(98/197),僅有27.42%的患者營養狀況尚可。
2.2 入院時COPD患者的營養指標、營養途徑及營養攝入情況
表1列出了入院時COPD患者的營養指標、營養途徑及營養攝入情況。
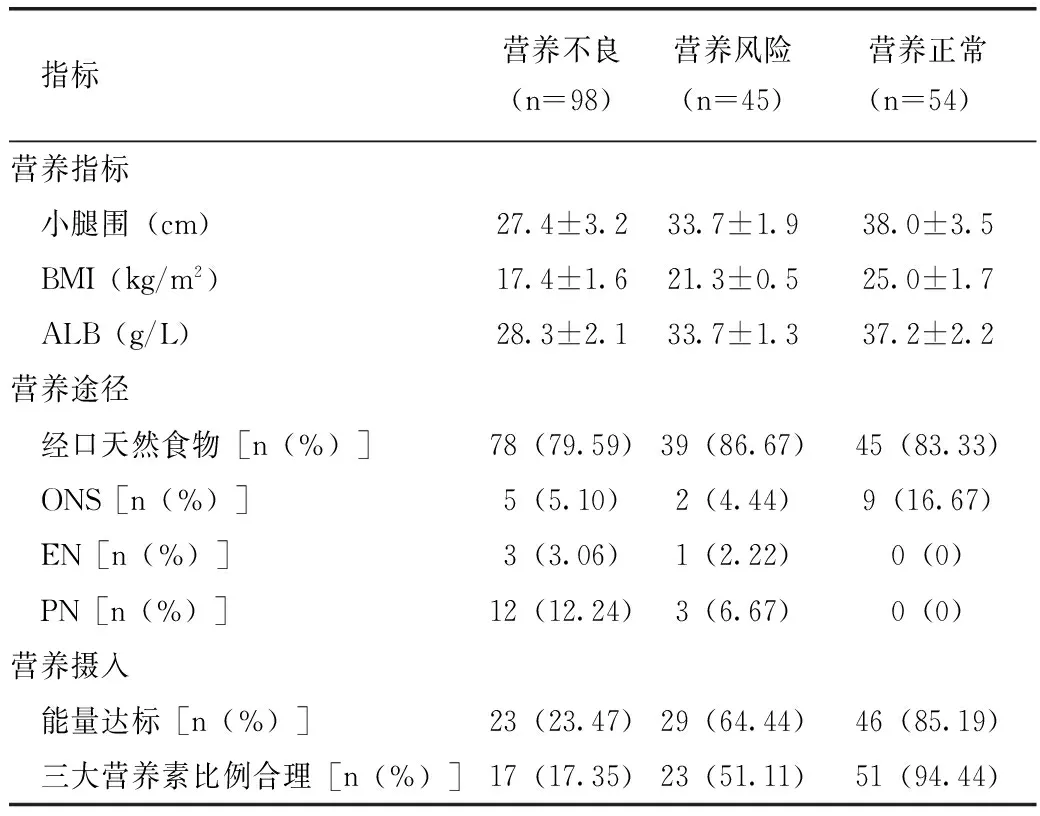
表1 入院時COPD患者的營養指標、營養途徑及營養攝入情況
注:營養指標采用方差分析,F值分別為5.86、370.02、117.34,P均<0.001;營養途徑采用χ2檢驗,χ2=15.45,P=0.017;能量達標采用χ2檢驗,χ2=58.09,P<0.001;營養素比例合理采用χ2檢驗,χ2=83.83,P<0.001
2.3 營養評估和干預后COPD患者的營養指標、營養途徑及營養攝入情況
COPD患者的營養干預包括途徑的選擇和營養素的合理補充,患者每3d進行一次營養評估,如經口天然食物不足推薦熱量的60%,可考慮ONS,必要時采用管飼營養;如前兩種營養攝入仍不足推薦熱量的60%,可考慮PN。
患者出院前一天重新進行營養風險篩查及營養評估,制定居家營養支持方案。197名COPD患者,仍有82名患者存在營養風險,占41.62%(82/197),其中45名患者存在營養不良,占22.84%(45/197)。表2是COPD患者出院前一天的營養指標、營養途徑及營養攝入情況。
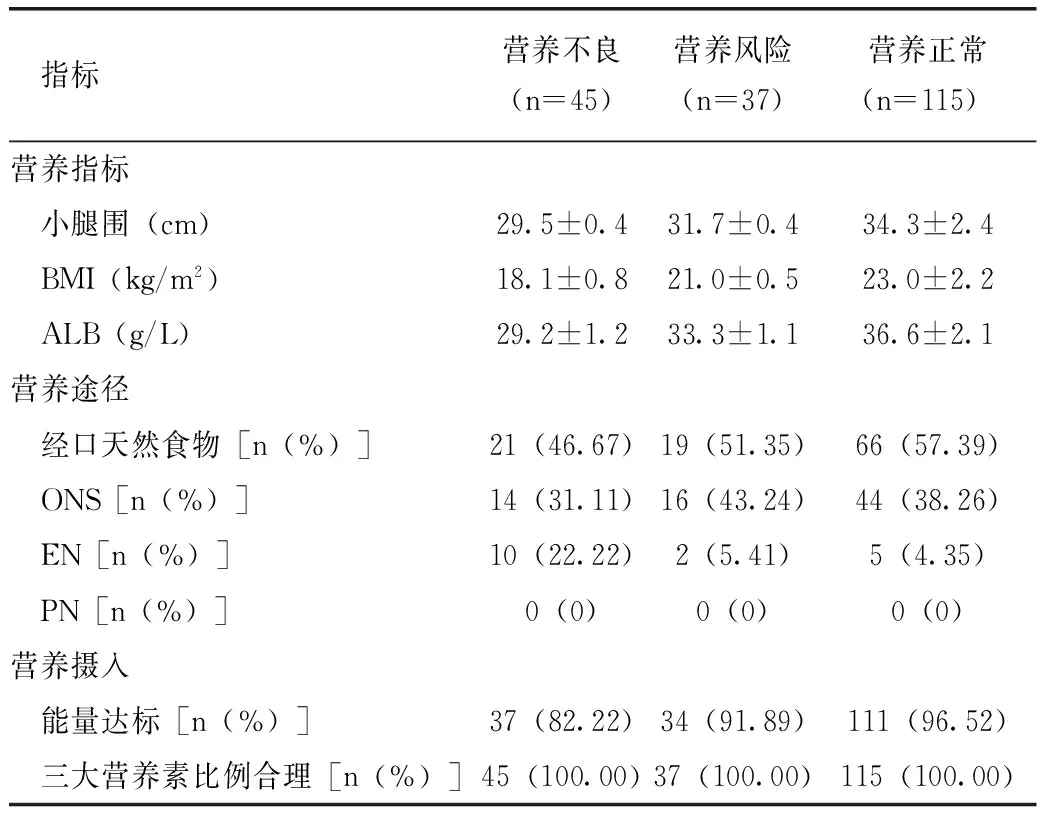
表2 出院前COPD患者的營養指標、 營養途徑及營養攝入情況
注:營養指標采用方差分析,F值分別為13.62、10.88、138.95,P均<0.001;營養途徑采用χ2檢驗,χ2=14.10,P=0.007;能量達標采用χ2檢驗,χ2=9.42,P=0.009
3 分析與結論
3.1 COPD發生營養不良的機制
COPD患者處于高代謝狀態,由于氣流受限呈進行性發展,持續存在呼吸能耗增加,如果沒有增加熱量攝入,體重必然會逐步下降。COPD患者運動受限會造成肌肉減少,COPD營養不良患者的蛋白質分解活性增加會加重肌肉萎縮。細胞因子TNF-α可增加細胞內蛋白質分解造成新陳代謝紊亂,增齡性瘦組織群減少,COPD患者普遍存在進食量減少、熱量不足,多方面加劇COPD營養不良的進展[7]。
3.2 營養不良對COPD的影響
營養不良是COPD的一種較為多見并發癥,表現為體質量減輕、白蛋白減少、免疫功能低下及肺功能進行性損傷,病人住院次數及死亡率增加。肺功能的減退與營養狀態的惡化相平行。COPD合并營養不良患者多有體重下降現象,特別是非脂肪組織群的減少比較明顯。營養不良能夠直接造成患者肺和胸廓出現結構性改變,患者膈肌和肋間肌肉出現結構紊亂,造成額外的代謝壓力,患者出現呼吸肌效率下降問題,直接造成肺部彈力纖維及活性物質的減少,導致肺功能下降。患者非脂肪群減少,骨骼肌結構出現變化,直接導致骨骼肌功能發生明顯下降,COPD患者的日常活動量大幅度減少,活動能力降低。營養不良患者因免疫系統受損且活動量大幅下降,較易出現反復感染,再住院率較高,有研究認為,超重和肥胖患者預后情況好于營養不良患者[8]。
3.3 MNT多途徑聯合治療的要點及意義
補充熱量是營養支持的基礎,適宜的熱量有利于控制病情發展,熱量不足不能為機體提供足夠的能源用以維持或修復組織器官的結構和功能[9]。應糾正目前普遍存在的“COPD飲食攝入不足是疾病導致的,等疾病恢復后逐步恢復進食量”的錯誤認識,目前營養支持的途徑及EN制劑逐漸增多,特殊醫學用途配方食品的興起,都為COPD早期營養干預提供了保證。由于疾病本身的特點,MNT方案中著重指出,避免過多地攝入碳水化合物,產生過多CO2,加重高碳酸血癥,增加呼吸負擔;患者多伴有肌肉減少,故應注意優質蛋白質的補充,同時輔以耐力訓練,利于患者肌肉量的增長;可選用MCT油保證熱量的供給等。COPD患者蛋白質、脂肪、碳水化合物的合理供能比例應為15%~20%、30%~35%、50%,還應關注維生素B、胡蘿卜素、磷、鈣、鎂等對呼吸功能的作用,注意及時補充[6]。COPD患者營養支持的成敗在于既能改善呼吸功能,又不增加呼吸肌負擔,防止減輕病人體質量和呼吸功能及免疫功能的進一步下降,提高病人的生存質量[10]。
COPD患者如達到營養不良狀態,營養干預是必須的,但營養治療要注意循序漸進,患者已經長時間熱量不足,進食量過少,選用食物及制劑時必須注意對胃腸道的耐受性,比如蛋白類食物的胃儲留時間,單一制劑或藥物對腸道菌群的影響,如發生腹脹、腹瀉時如何進行判別、診斷和處理。營養治療的開展也需要呼吸科、康復科、臨床藥師等醫護人員的配合,多學科聯合治療的重要性,在于發現COPD患者即開始健康教育,預防營養不良的發生,發揮營養治療提高COPD患者的呼吸肌肌力及耐力、改善呼吸功能,預防急性發作的作用。
綜上所述,COPD患者營養不良的發病率較高,多種營養支持途徑聯合應用的MNT能夠改善患者的營養狀況,有利于肺功能的恢復。營養不良的發病機制是多方面的,采取綜合干預,包括常規治療、運動訓練及營養支持治療等綜合治療可能會獲得更好的臨床效果。在今后的臨床工作中,不斷完善COPD患者的營養評估方法,鞏固患者個體化MNT的療效。◇
[1]Han MK,Muellerova H,Curran-Everett D,et al.GOLD 2011 disrase severity classification in COPD Gene:a prospective cohort study[J]. Lancet Respir Med,2013,1(1):43-50.
[2]Sehgal IS,Dhooria S,Agarwal R. Chronic obstructive pulmonary disease and malnutrition in developing countries[J]. Curr Opin Pulm Med,2017,23(2):139-148.
[3]中華醫學會呼吸病學分會慢性阻塞性肺疾病學組. 《慢性阻塞性肺疾病診治指南》(2013修訂版)[J]. 中華結核和呼吸雜志,2013,36(4):255-264.
[4]Arslan M,Soylu M,Kaner G,et al. Evaluation of malnutrition detected with the Nutritional Risk Screening 2002 (NRS-2002)and the quality of life in hospitalized patients with chronic obstructive pulmonary disease[J]. Hippokratia,2016,20(2):147-152.
[5]Benito-Martinez MDP,La-Serna-Infantes JE,Guarro-Riba M,et al. Nutritional and functional state of patients with chronic obstructive pulmonary disease:effects of oral nutritional supplementation (OFOS study)[J]. Nutr Hosp,2017,34(4):776-783.
[6]顧景范主編. 現代臨床營養學(第2版)[M]. 北京:科學出版社,2009.
[7]林志勇,梁志科. COPD營養狀態模型對呼吸機蛋白質分解代謝的影響[J]. 中國醫藥科學,2015,5(5):24-26.
[8]崔金波,萬群芳,吳小玲. NRS2002預測無創通氣治療慢性阻塞性肺疾病伴Ⅱ型呼吸衰竭患者臨床結局的探討[J]. 中國實用護理雜志,2014,30(19):10-15.
[9]肖安東.早期腸內腸外聯合營養與腸內營養支持治療COPD急性加重期臨床對比研究[J]. 中國傷殘醫學,2014,22(9):163-164.
[10]van de Bool C,Rutten EPA,van Helvoort A,et al. A randomized clinical trial investigation the efficacy of targeted nutrition as adjunct to exercise training in COPD[J]. J Cachexia Sarcopenia Muscle,2017,8(5):748-758.

