大鼠骨髓間充質干細胞培養、鑒定及神經樣細胞分化
康湘萍 陳 超 梁 超 戴薇薇 龔張斌 金國琴
(上海中醫藥大學基礎醫學院,上海 201203)
骨髓間充質干細胞(BMSCs)是一種來源于骨髓基質中具有多向分化潛能的成體干細胞,在一定的誘導條件下可分化為神經外胚層細胞如少突膠質細胞、星形膠質細胞及神經元細胞等〔1,2〕,其向神經樣細胞分化潛能為治療神經系統損傷相關疾病(如早老性癡呆、帕金森病、腦卒中等)提供了新的干細胞來源,具有非常重要的意義及研究價值〔3,4〕。然而BMSCs在骨髓中的含量非常少,占有核細胞總數的0.01%~0.1%。因此,培養、分離足夠數量、高純度的BMSCs可為后續體內、外實驗的順利開展提供必需的種子細胞。本實驗旨在探討BMSCs向神經樣細胞分化的可行性,建立穩定的實驗體系,為BMSCs移植治療中樞神經系統相關疾病提供實驗基礎與依據。
1 材料與方法
1.1實驗動物 SD大鼠,SPF級,4周齡,體重(100±20)g,雄性,由上海中醫藥大學實驗動物中心提供〔上海西普爾-必凱實驗動物有限公司,SCXK(滬)2013-0016〕。
1.2主要試劑和儀器 試劑:α-MEM培養基、胰蛋白酶、胎牛血清(FBS)、堿性成纖維細胞生長因子(bFGF)購于Gibco公司,β-巰基乙醇購于Genview公司,CD90、CD29、CD34、CD45、神經巢蛋白(Nestin)、膠質纖維酸性蛋白(GFAP)、神經元特異烯醇化酶(NSE)抗體及相關二抗均購于Abcam公司,GAPDH抗體購于CST公司,電化學發光(ECL)試劑盒購自Pierce公司;儀器:臺式冷凍離心機(德國Eppendorf公司),垂直式無菌無塵操作臺(造鑫企業有限公司),酶標儀(美國BIOTEK公司),倒置相差顯微鏡(Olympus公司),流式細胞儀(美國BD公司),蛋白電泳儀、電泳槽、轉移槽(Bio-Rad公司),凝膠成像分析系統(美國ProteinSimple公司)。
1.3方法
1.3.1大鼠BMSCs的分離、原代培養及傳代培養〔5〕將實驗大鼠斷頭處死,置于75%乙醇中浸泡15 min,在無菌條件下分離雙側股骨、脛骨,剪掉兩端,用5 ml注射器吸取 α-MEM培養基5 ml反復沖洗骨髓腔3~5次,收集骨髓細胞懸液,吹打分散,1 000 r/min離心5 min棄上清,以10% FBS α-MEM培養基5 ml重懸細胞,混勻,移至6 cm培養皿中,置37℃、5% CO2飽和濕度培養箱中培養,原代培養標記為P0。48 h后首次更換培養基并去除非貼壁細胞,以后每隔3 d換液1次。當貼壁細胞生長融合達培養皿80%左右時用0.25%胰蛋白酶及0.02%EDTA混合消化液消化,1∶3比例進行傳代培養,標記為P1,放回培養箱內繼續培養,隔天觀察細胞生長情況。
1.3.2大鼠BMSCs表面標記物(CD90、CD29為的鑒定BMSCs表面抗原,CD34、CD45為造血干細胞表面抗原)的鑒定
1.3.2.1細胞免疫化學染色 取第3代(P3)細胞接種于24孔板,待細胞生長融合達70%~80%時進行染色實驗:棄原培養基,預熱的PBS洗細胞2次,加入200 μl預冷的甲醇室溫下固定5 min,室溫封閉30 min(10%山羊血清),一抗室溫孵育1 h(避光,所有一抗的稀釋倍數均參考抗體說明書),PBS洗細胞1次,加入熒光標記二抗(1∶800倍稀釋),室溫避光孵育1 h,PBS洗細胞3次后封片,熒光顯微鏡觀察細胞標記情況。
1.3.2.2流式細胞術檢測 細胞傳代至P3時消化收集細胞,1.2 ml 3%FBS/PBS重懸細胞,調節細胞濃度至1×106個/ml;各取100 μl細胞懸液,分別加入稀釋好的一抗(所有一抗的稀釋倍數均參考抗體說明書),室溫避光孵育30 min;PBS洗細胞2次,1 200 r/min,離心3 min,預冷的3%FBS/PBS重懸細胞;加入熒光標記二抗(稀釋倍數參考抗體說明書),室溫避光孵育30 min;PBS洗細胞2次,1 200 r/min,離心5 min,500 μl預冷的3%FBS/PBS重懸細胞;應用流式細胞儀檢測細胞表面標記物CD90、CD29、CD34和CD45的表達情況。
1.3.3大鼠BMSCs的誘導分化及神經標志物檢測
1.3.3.1定向誘導分化〔6,7〕取第3代細胞以1×105/ml的密度接種于事先放置有消毒蓋玻片的12孔板內制備細胞爬片,當細胞貼壁生長達到80%融合時,應用不同方法對其進行誘導,以此分為3組(每組4孔細胞):(1)空白對照組:10%FBS的α-MEM培養基;(2)化學方法誘導組:誘導前培養板孔內加入1 mmol/L的β-巰基乙醇預誘導24 h,更換無血清α-MEM培養基及5 mmol/L的β-巰基乙醇誘導6 h;(3)生長因子誘導組:給予含20 ng/ml bFGF的無血清α-12培養液誘導72 h。
1.3.3.2Western印跡檢測神經標志蛋白(Nestin,NSE,GFAP)的表達 加入RIPA緩沖液裂解細胞,雙縮脲法測定蛋白濃度。SDS-PAGE電泳,上樣量為40 μg蛋白/孔;電泳結束后,300 mA恒流轉膜60 min;37℃,5%脫脂奶粉封閉1 h;一抗4℃孵育過夜(所有一抗的稀釋比例均參照抗體說明書)。次日,0.1 mol/L PBST(pH7.4)洗膜后加入二抗(1∶10 000倍稀釋),37℃孵育45 min;PBST洗膜后ECL顯色檢測結果,計算積分密度值(IOD)。
1.4統計學處理 采用SPSS17.0統計學軟件進行t檢驗。
2 結 果
2.1細胞形態學觀察 原代培養5 d后貼壁細胞呈短梭形、多角形,散在分布,可見核仁;培養至13 d,細胞體狹長,細胞相互融合,出現集落;傳代后細胞生長迅速,生長均勻,呈紡錘形、漩渦狀分布,核仁清晰,折光性好。見圖1。
2.2BMSCs表面標記物的鑒定 細胞免疫化學染色(圖2)及流式細胞儀檢測(圖3)結果顯示:CD29、CD90表達陽性(陽性率分別為97.51%、96.85%),CD34和CD45表達陰性(陽性率分別為2.5%、3.8%),故認為體外分離培養的細胞為BMSCs。

A~C分別為原代細胞5、7、13 d,D為傳代細胞P2圖1 大鼠BMSCs形態圖(×100)

圖2 細胞免疫化學染色結果(×200)
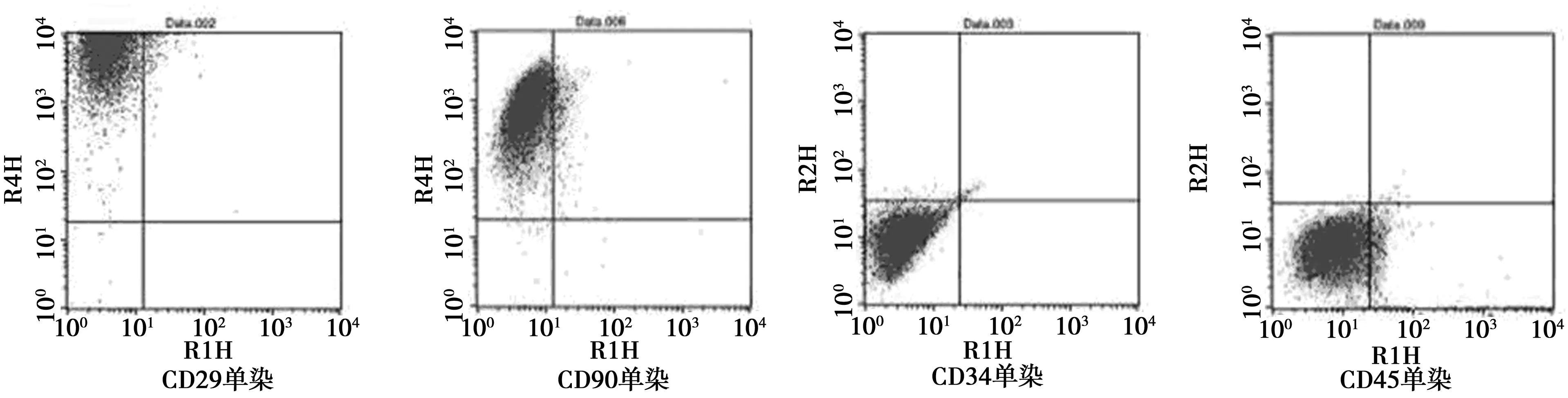
圖3 流式細胞儀檢測細胞表面標記物
2.3誘導分化后的細胞形態觀察 誘導前細胞大部分呈梭形,部分呈現橢圓形或圓形(圖4A);β-巰基乙醇誘導2 h后,胞體收縮,折光性增強,個別細胞伸出突起,6 h后出現較典型的神經元細胞形態改變,呈雙極或多極,部分突起連成網狀(圖4B);bFGF誘導24 h后,部分細胞胞體收縮成錐形,折光性增強,72 h后細胞可見明顯突起,細長呈樹枝狀,并交織成網狀,為典型的神經樣細胞形態改變,呈雙極或多極(圖4C)。
2.4Western印跡檢測神經標志蛋白(Nestin,NSE,GFAP)的表達 Nestin是神經干細胞標志物,NSE是神經元標志物,GFAP是神經膠質細胞標志物。Western印跡檢測結果顯示:與空白對照組相比,β-巰基乙醇及bFGF誘導后,Nestin、NSE及GFAP蛋白表達均明顯升高(P<0.05),兩誘導組之間無顯著差異,說明在上述誘導劑的作用下,BMSCs可向神經樣細胞定向分化,且分化細胞主要為神經干細胞及神經元細胞,見圖5,圖6。
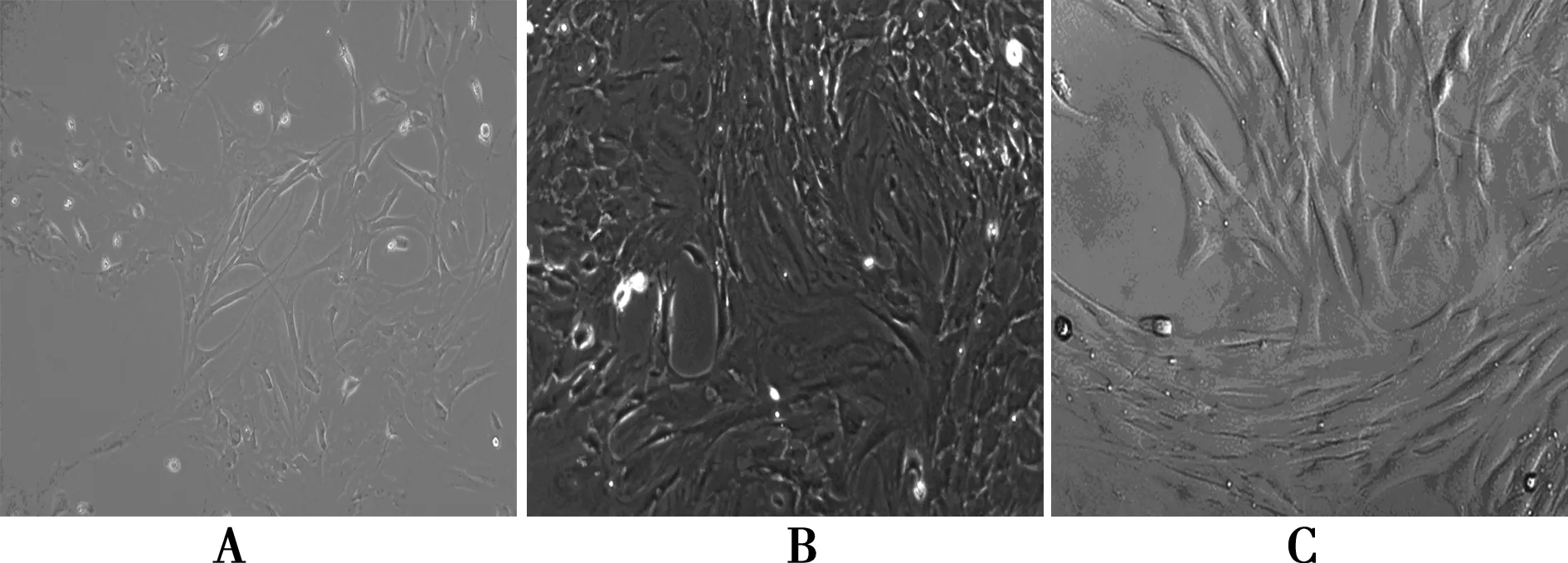
A.空白對照組;B.β-巰基乙醇誘導分化6 h后;C.bFGF誘導分化72 h后圖4 誘導BMSCs分化前后細胞形態圖(×200)
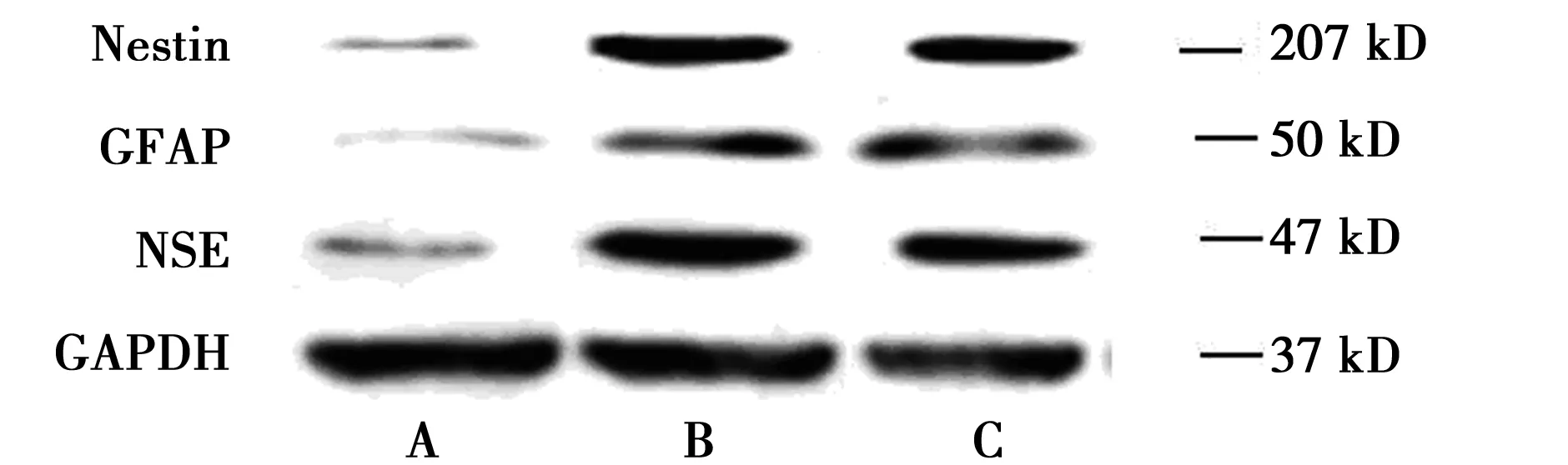
A.空白對照組;B.化學方法誘導組;C.生長因子誘導組圖5 Western印跡檢測各組細胞神經標志蛋白(Nestin,NSE,GFAP)表達
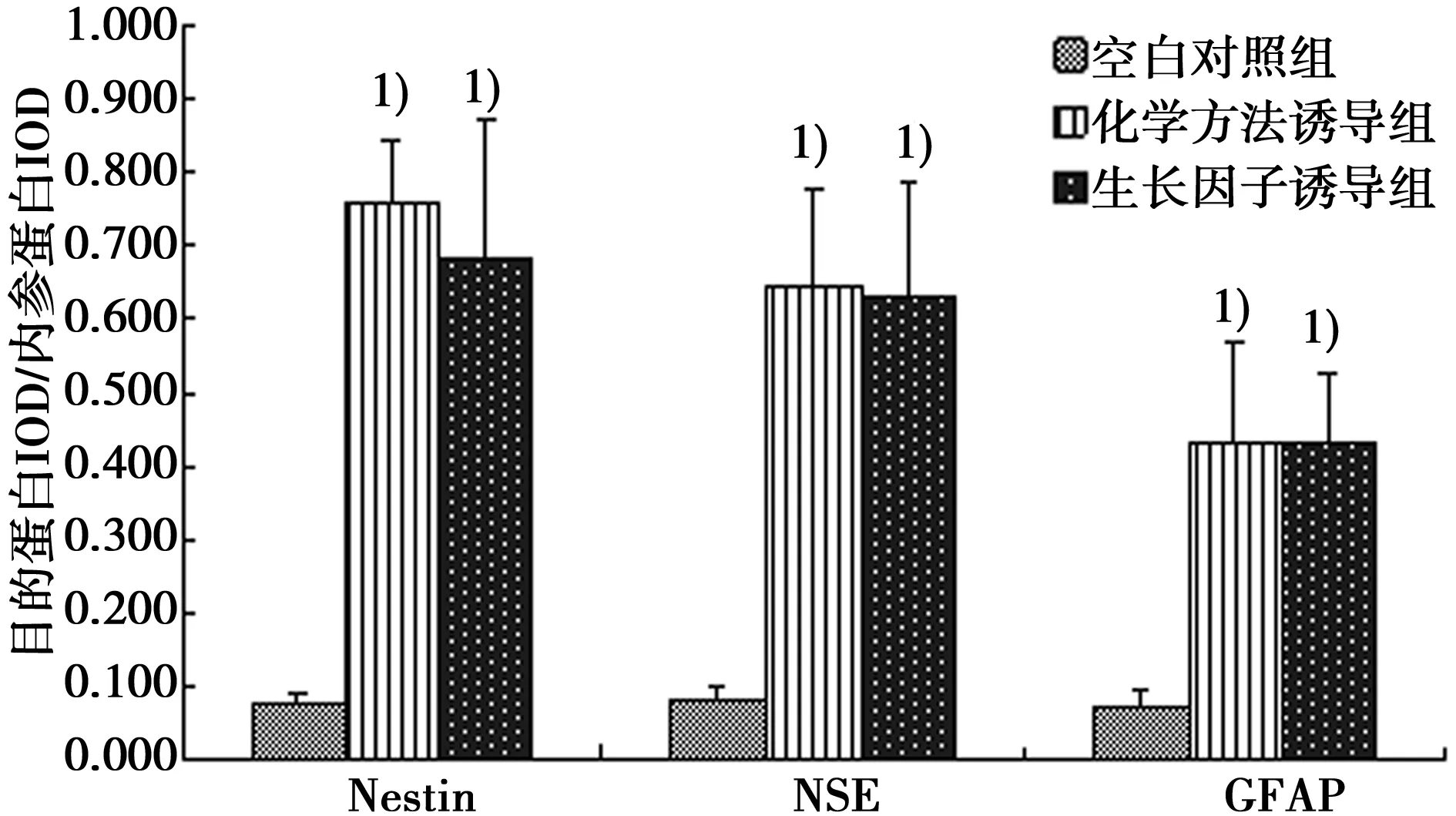
與空白對照組比較:1)P<0.05圖6 各組神經標志蛋白表達水平
3 討 論
神經細胞起源于外胚層,傳統認為成體內神經細胞數目恒定不可再生,現在的研究也表明中樞神經系統損傷后自身修復能力非常有限,其損傷與再生一直是困擾醫學的難題。BMSCs是一種來源于中胚層但卻可以向內、中、外三個胚層分化,具有強大的自我更新能力及多向分化潛能,在特定條件下可誘導分化為多個細胞系,包括成骨細胞、脂肪細胞、心肌細胞、肝細胞、肌成纖維細胞及神經細胞等〔8〕。由于BMSCs來源于骨髓,具有取材容易,易于分離、培養,無免疫排斥反應,可在體外擴增,無倫理問題等特點;因此可作為理想的種子細胞或載體細胞用于細胞移植、基因治療和細胞治療等方面。
但是BMSCs在骨髓中的含量非常少,而體外實驗及臨床治療一般需要大量高純度的BMSCs,必須依賴于BMSCs的體外擴增。目前,比較公認的分離培養BMSCs的方法主要有4種:全骨髓貼壁培養法、密度梯度離心法、流式細胞儀分選法及免疫磁珠分選法。其中,全骨髓貼壁培養法是獲得BMSCs最為簡單的方法,可以很好地保護細胞的活力,經過換液、傳代可去除大量雜細胞,獲得高純度、并具備分化潛能的BMSCs。本實驗采用全骨髓貼壁法進行大鼠BMSCs的分離、純化,培養至第3代時應用細胞免疫化學染色和流式細胞術進行細胞表面標志物的檢測和鑒定,結果提示分離培養的為純度較高的BMSCs,且增殖能力比較穩定、適于誘導分化,可選取第3代BMSCs進行后續實驗研究。
研究表明,骨髓中的細胞能夠分化為神經元和膠質細胞,在腦組織受損傷后尤為明顯〔9〕,因此BMSCs是治療腦外傷、腦梗死、帕金森病及老年癡呆等神經系統疾病的種子細胞〔10~12〕。趙慧新等〔13〕通過移植腦源性神經營養因子(BDNF)轉染的BMSCs治療AD大鼠,發現其對AD大鼠的認知有改善作用,且能促進海馬區N-甲基-D-天冬氨酸受體(NMDAR)1的表達。目前,體外誘導BMSCs分化為神經樣細胞的方法主要有3種〔14〕:化學誘導、生長因子誘導及抗氧化劑誘導。因誘導后的細胞從形態上看類似于神經細胞,故多稱之為“神經元樣細胞”或“神經樣細胞”。其中化學誘導包括β-巰基乙醇、硫代甘油、維甲酸(RA)等〔15,16〕;生長因子誘導如bFGF、BDNF等〔17〕;抗氧化劑誘導如中藥及其有效成分、褪黑素等。本研究分別采用β-巰基乙醇及bFGF誘導BMSCs定向分化,結果表明,在上述誘導劑的作用下,BMSCs可進行分化,且分化細胞具備神經細胞的形態及特征。
本研究成功建立BMSCs的體外培養體系,并可在適當條件下誘導分化為神經樣細胞,為BMSCs移植治療中樞神經系統相關疾病提供實驗基礎與依據;但是誘導分化過程中的作用機制仍不清楚,有待進一步深入研究。
1de Girolamo L,Lucarelli E,Alessandri G,etal.Mesenchymal stem/stromal cells:a new “cells as drugs” paradigm.Efficacy and Critical Aspects in Cell Therapy 〔J〕.Curr Pharm Des,2013;19(13):2459-73.
2Cunha M,Lima Fda S,Vinolo M,etal.Protein malnutrition induces bone marrow messenchymal stem cells commitment to adipogenic differentiation leading to hepmatopoietic failure 〔J〕.PLoS One,2013;8(3):e58872.
3Wu R,Tang Y,Zang W,etal.MicroRNA-128 regulates the differentiation of rats bone mesenchymal stem cells into neuron-like cells by Wnt signaling 〔J〕.Mol Cell Biochem,2014;87(1-2):151-8.
4Huang W,Mo X,Qin C,etal.Transplantation of differentiated bone marrow stronal cells promotes motor functional recovery in rats with stroke〔J〕.Neurol Res,2013;35(3):320-8.
5Masoud S,Samad N.A protocol for isolation and culture of mesenchymal stem cells from mouse bone marrow 〔J〕.Nat Protoc,2009;4(1):102-6.
6張 進,黃 進,徐志偉.何首烏含藥血清促進MSCs增殖的效應及機理研究〔J〕.中藥新藥與臨床藥理,2011;22(1):12-5.
7何丁文,殷嫦嫦,殷 明,等.不同血清濃度對bFGF聯合EGF誘導BMSCs向神經細胞分化的影響〔J〕.神經解剖學雜志,2013;29(1):18-24.
8Philippe C.Programming differentiation potential in mesenchymal stem cells 〔J〕.Eplgenetics,2010;5(6):476-82.
9Maeda M,Nahi Y,Ahmad A,etal.Production of neural progenitors from bone marrow mesenchymal stem cells 〔J〕.Stem Cell Discov,2016;6(1):1-12.
10Wei L,Fraser JL,Lu ZY,etal.Transplantation of hypoxia preconditioned bone marrow mesenchymal stem cells enhances angiogenesis and neurogenesis after cerebral ischemia in rats 〔J〕.Neurobiol Dis,2012;46(3):635-45.
11Frattini F,Lopes FR,Almedia FM,etal.Mesenchymal stem cells in a polycaprolactone conduit promote sciatic nerve injury 〔J〕.Tissue Eng Part A,2012;18(19-20):2030-9.
12Oh SH,Kim HN,Park HJ,etal.Mesenchymal stem cells increase hippocampal neurogenesis and neuronal differentiation by enhancing the Wnt signaling pathway in an Alzheimer′s disease model〔J〕.Cell Transplantation,2015;24(5):1097-109.
13趙慧新,趙鋼勇,張 平.移植腦源性神經營養因子轉染的骨髓間充質干細胞對AD大鼠的影響〔J〕.神經損傷與功能重建,2014;10(1):195-8.
14馮燁軍,陳 明.骨髓間充質干細胞在神經修復中的研究進展〔J〕.神經損傷與功能重建,2016;11(5):426-8.
15Hofsteter CP,Schwarz EJ,Hess D,etal.Marrow stromal cells form guiding strands in the injured spinal cord and promote recovery 〔J〕.Proc Natl Acad Sci USA,2002;99(4):2199-204.
16項 鵬,夏文杰,張麗蓉,等.成人骨髓間充質干細胞定向誘導為神經元樣細胞的研究〔J〕.中國病理生理雜志,2001;17(5):385-7.
17王 冠,李靜雅,楊聲坪,等.骨髓間充質干細胞向神經元樣細胞分化中黃芪多糖的誘導作用〔J〕.中國組織工程研究,2015;19(45):7259-62.

