絲膠對糖尿病大鼠海馬生長激素及其受體表達的調節作用
李東哲 王丹丹 史 碩 宋妤軒 宋成軍 陳志宏
(承德醫學院人體解剖學教研室,河北 承德 067000)
糖尿病性昏迷、腦血管意外等糖尿病中樞神經系統并發癥已經得到了醫務工作者的廣泛關注,但由糖尿病引發的認知功能障礙,即糖尿病腦病,因其進展緩慢,癥狀、表現缺乏特異性而受到了忽視〔1〕。海馬作為邊緣系統的主要組成部分,具有學習、記憶和空間定位的作用,與認知功能密切相關〔2〕。在此之前,本研究團隊初步探討了蠶繭水提物——絲膠的抗糖尿病作用,發現絲膠不僅可以明顯降低2型糖尿病(T2DM)模型大鼠的血糖,還能夠抑制造模大鼠血糖升高〔3〕,同時還發現絲膠能改善糖尿病腎臟功能和生精功能的損傷〔4,5〕。本研究擬分析絲膠灌胃后T2DM模型大鼠海馬生長激素(GH)和生長激素受體(GHR)表達的變化,以期為糖尿病認知功能障礙的研究提供理論依據。
1 材料與方法
1.1大鼠分組及處置 將10~12周齡的雄性清潔級SD大鼠(購自河北醫科大學實驗動物中心,許可證號712024),隨機分組,每組12只:①空白對照組,大鼠不給予任何處置,可以自由進食;②T2DM模型組,制備T2DM大鼠模型,造模后大鼠常規飼養,不予任何處理;③絲膠組,制備T2DM大鼠模型,造模后在常規飼養的同時用2.4 g/kg的絲膠1次/d灌胃治療35 d。
絲膠的獲取及使用方法:承德醫學院蠶業研究所提供彩色蠶繭,將蠶繭用純水浸泡后煎煮2次,過濾后合并2次的濾液,濃縮至所需濃度,4℃冰箱保存,灌胃前用37℃水浴箱復溫。
1.2大鼠T2DM模型的建立 用pH 4.4的枸櫞酸-枸櫞酸鈉緩沖液,在臨用時配制鏈脲佐菌素(streptozotocin,購自美國Sigma公司)溶液,濃度是2%,給予大鼠腹腔連續注射3 d(25 mg·kg-1·d-1)。1 w后以大鼠血糖(BG)≥16.7 mmol/L作為模型成功建立的標準。
1.3處死大鼠、取材、檢測相關指標 配制4%的水合氯醛,以腹腔注射的方式麻醉大鼠,用毛細玻璃管從眼內靜脈叢采集大鼠空腹靜脈血。然后斷頭處死大鼠,在冰盤上迅速剝離腦組織并取雙側海馬,液氮速凍后保存于-80℃冰箱。
1.3.1測定大鼠血液參數 血液標本3 000 r/min、離心20 min,取上層血清,BG采用葡萄糖氧化酶法,采用ELISA法檢測GH水平(GH ELISA試劑盒,購自美國Rb公司)。
1.3.2檢測大鼠海馬GH和GHR的表達 (1)Weston印跡法檢測GH和GHR蛋白的表達:提取海馬組織中總蛋白;應用BCA蛋白試劑盒(購自北京泰格美科技有限公司)定量,蛋白上樣量100 μg;15% SDS-PAGE凝膠電泳后轉膜;5%脫脂奶粉封閉過夜;4℃搖床孵育一抗〔GH 1∶200(小鼠抗大鼠單克隆抗體,購自美國Santa Cruz公司),β-actin 1∶1 000(小鼠抗大鼠單克隆抗體,購自美國Abcam公司),GHR 1∶100(兔抗大鼠多克隆抗體,購自上海滬峰化工有限公司)〕過夜;室溫下搖床孵育二抗〔山羊抗小鼠、兔IgG 1∶5 000(購自美國Sigma公司)〕2 h;應用電化學發光法(ECL)化學超敏發光液進行顯影;應用EPSON掃描儀掃描膠片,應用Quantity One-v 4.6.2軟件對目標條帶的灰度值進行分析,以目標條帶灰度值/內參條帶灰度值作為GH和GHR蛋白的相對表達水平。(2)逆轉錄PCR法(RT-PCR)檢測GH和GHR mRNA的表達:提取海馬組織總RNA;鑒定RNA的完整性,逆轉錄為cDNA(逆轉錄反應條件:30℃加熱10 min;55℃加熱30 min;99℃加熱5 min;5℃冷卻5 min;終止反應);對cDNA進行擴增(PCR引物序列及擴增條件見表1);取擴增產物行2%瓊脂糖凝膠電泳(90 V,40 min);應用ZF型紫外透射反射分析儀進行攝像,應用Quantity One-v 4.6.2軟件對目標條帶進行分析,以目標條帶光密度值/內參照條帶光密度值作為GH和GHR mRNA的相對表達水平。
1.4統計學處理 使用SPSS20.0軟件進行方差分析,組間的兩兩比較采用SNK法。
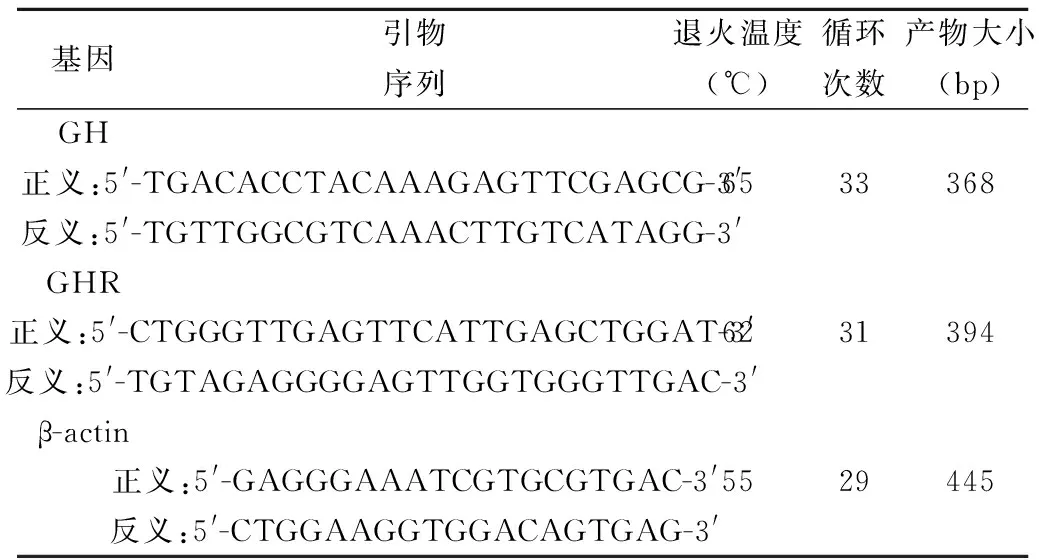
表1 PCR引物序列和擴增條件
2 結 果
2.1三組大鼠BG和血清GH水平比較 與空白對照組大鼠相比,T2DM模型組大鼠的BG和血清GH水平明顯升高(P<0.05);絲膠能明顯降低T2DM模型大鼠的血糖和血清GH水平(P<0.05)。見表2。
2.2三組大鼠海馬GH和GHR表達情況比較 與空白對照組大鼠相比,T2DM模型組大鼠海馬GH蛋白和mRNA的表達水平明顯升高,GHR蛋白和mRNA的表達水平明顯降低(P<0.05);與T2DM模型組大鼠相比,絲膠組大鼠海馬GH蛋白、mRNA的表達水平明顯降低,GHR蛋白、mRNA的表達水平明顯升高(P<0.05)。見表3,圖1,圖2。
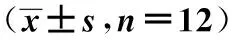
表2 各組大鼠的BG和血清GH水平
與T2DM模型組比較:1)P<0.05,下表同
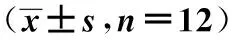
表3 各組大鼠海馬GH和GHR的表達比較

1.空白對照組,2.T2DM模型組,3.絲膠組;下圖同圖1 各組大鼠海馬GH和GHR蛋白的表達
3 討 論
GH是由腺垂體分泌的含有191個氨基酸的肽類激素,具有促進生長發育、調節新陳代謝及機體多種生理功能的作用,在哺乳動物GH還參與調節機體的免疫功能和神經系統的活動〔6〕。GH發揮作用的方式包括直接作用于靶細胞發揮作用;由胰島素樣生長因子(IGF)家族介導,通過GH/IGFs軸發揮作用;依賴JAK2激活的信號通路,其中JAK2-STAT5是GH誘導的改善代謝功能、促進機體生長的核心通路〔7〕;不依賴JAK2激活的信號機制,如GH可激活Src和ERK1/2,從而發揮相應的生理功能〔7〕。無論是哪一種方式,GH都需要首先與靶細胞膜表面的GHR結合,通過GHR介導,以不同的方式將信號傳入細胞內,發揮GH的生理作用。有研究顯示,GHR的含量、功能等均可影響GH生理功能的發揮〔8〕。在GH發揮作用的方式中,GH-GHR/IGF-1軸對中樞神經系統的作用逐步得到了學者們的關注。
目前,海馬被認為是學習記憶的關鍵區域,而對于嚙齒類動物來說,海馬是空間學習的基本結構。有研究發現,不論1型糖尿病還是T2DM,均存在GH-GHR/IGF-1軸異常,且與糖尿病(DM)海馬損傷導致的認知功能障礙密切相關〔9,10〕。DM時,高BG狀態降低了下丘腦對葡萄糖的調節作用,從而減弱了葡萄糖對GH分泌的抑制作用,進而使GH水平升高〔11〕。DM伴隨GH升高的情況下,不但更加難以控制BG,而且還會影響DM慢性并發癥的發生發展;并且,過多的GH還能抑制GHR的表達,揭示了GH和GHR之間的自我調節機制,同時也提示了組織對GH的敏感性降低,因此導致了GH作用減弱〔12〕。而敲除或下調GHR的表達水平,可通過GH抵抗使IGFs介導的GH的多種作用減弱,在海馬表現為神經元凋亡增加,認知功能下降〔13,14〕。
中醫認為DM屬于“消渴病”,病因比較復雜,先天稟賦不足是重要內因;長期飲食不節、積熱,情志失調,勞欲過度、腎精虧損,終致腎虛肺燥而發消渴,治療原則是清熱生津、滋陰潤燥、養陰益氣。《本草綱目》記載,蠶繭“煮湯治消渴,古方無他”。中醫認為蠶繭性味甘、溫,和緩,溫而不燥,補而不膩,以血肉友情之身,善補至虛至損之精氣。現代藥理研究證明蠶絲纖維中的絲膠有擬膽堿作用,并含鐵、氟、錳、鋅等微量元素,降糖解渴、治小便過多,民間亦有蠶繭泡水降BG的驗方。本課題組前期觀察了絲膠對T2DM模型大鼠腎臟損傷和生精功能障礙的保護作用〔5,6〕。本研究結果提示絲膠可能通過調節DM時海馬GH和GHR的表達,進而通過改善海馬GH-GHR/IGF-1軸的功能改善學習記憶能力,但相關機制有待進一步探討。
本研究中使用的絲膠,為蠶繭中占25%~30%的水溶性蛋白,但在繅絲的時候被丟棄,造成了巨大的浪費。本課題組對絲膠抗DM的研究,不但可為臨床治療DM提供新思路,也可以避免浪費大量優質的蛋白質,對蠶業產品的有效利用及新產品的開發將具有較好的促進作用。
1Li HY,Wang XC,Xu YM,etal.Berberine improves diabetic encephalopathy through the SIRT1/ER stress pathway in db/db mice〔J〕.Rejuvenation Res,2017;doi:10.1089/rej.2017.1972〔Epub ahead of print〕.
2Li J,Zhang L,Li JJ,etal.Effects of estrogen on learning-memory and expression of calbindin-D28K in hippocampus in vascular dementia rats〔J〕.Pak J Pharm Sci,2017;30(4 Suppl):1403-6.
3付秀美,鐘美蓉,付文亮,等.絲膠對2型糖尿病大鼠血糖和血脂的影響〔J〕.中國老年學雜志,2011;31(1):103-5.
4Song CJ,Yang ZJ,Tang QF,etal.Effects of sericin on the testicular growth hormone/insulin-like growth factor-1 axis in a rat model of type 2 diabetes〔J〕.Int J Clin Exp Med,2015;8(7):10411-9.
5楊振軍,劉東慧,宋成軍,等.結締組織生長因子在糖尿病大鼠腎臟損傷中的作用及絲膠的干預效果〔J〕.中國老年學雜志,2014;34(24):6994-6.
6Pérez-Ibave DC,Rodríguez-Sánchez IP,Garza-Rodríguez Mde L,etal.Extrapituitary growth hormone synthesis in humans〔J〕.Growth Horm IGF Res,2014;24(2-3):47-53.
7吳天成,蘭海楠,馬思慧,等.生長激素受體介導的信號轉導機制研究進展〔J〕.中國畜牧獸醫,2014;41(12):186-9.
8張明哲,葉 丹,張志和,等.生長激素受體及其介導的信號轉導〔J〕.細胞生物學雜志,2005;(27):49-52.
9Raisingani M,Preneet B,Kohn B,etal.Skeletal growth and bone mineral acquisition in type 1 diabetic children;abnormalities of the GH/IGF-1 axis〔J〕.Growth Horm IGF Res,2017;34(1):13-21.
10Berryman DE,Glad CA,List EO,etal.The GH/IGF-1 axis in obesity:pathophysiology and therapeutic considerations〔J〕.Nat Rev Endocrinol,2013;9(6):346-56.
11宰國田.2型糖尿病慢性并發癥與血清生長激素關系探討〔J〕.現代醫藥,2004;20(14):1325-6.
12Meinhardt U,Eblé A,Besson A,etal.Regulation of growth-hormone-receptor gene expression by growth hormone and pegvisomant in human mesangial cells〔J〕.Kidney Int,2003;64(2):421-30.
13Chandrashekar V,Dawson CR,Martin ER,etal.Age-related alterations in pituitary and testicular function in long-lived growth hormone receptor gene-disrupted mice〔J〕.Endocrinology,2007;148(12):6019-25.
14Wang Y,Wang W,Li D,etal.IGF-1 alleviates NMDA-induced excitotoxicity in cultured hippocampal neurons against autophagy via the NR2B/PI3K-AKT-mTOR pathway〔J〕.J Cell Physiol,2014;229(11):1618-29.

