序貫免疫療法對乳腺癌患者血清雌激素及炎性因子的影響
張紅霞 張一帆
(徐州醫科大學,江蘇 徐州 221000)
乳腺癌病因尚未完全明確,但與患者雌激素水平及不正常生活習慣存在一定規律性〔1〕。女性乳腺癌發生率隨著絕經期的到來呈峰值性改變,0~24歲處較低水平,25歲后逐漸上升,50~54歲達到高峰,55歲以后發病率逐漸下降〔2〕。相關腫瘤基因突變而引起的乳腺癌稱為遺傳性乳腺癌,占全部乳腺癌的5%~10%,5年復發率高于正常人群15.78%〔3〕。臨床常規治療方案以手術切除后聯合化放療為主,但對患者生理、心理傷害較大,且5年復發率較高,子宮、卵巢等轉移性腫瘤疾病高發。目前新出現序貫免疫治療,副作用、復發率低,治療療程短,預后康復快。本研究探討序貫免疫治療對乳腺癌患者血清雌激素及Treg細胞與轉化生長因子(TGF)-β1、白細胞介素(IL)-10水平的影響。
1 資料與方法
1.1臨床資料 收集徐州市中心醫院2014年1~12月確診為乳腺癌患者100例,均為女性,平均年齡(57.9±5.9)歲。根據治療方案不同分為對照組50例,平均年齡(52.1±6.7)歲,試驗組50例,平均年齡(55.3±5.3)歲。納入標準:診斷依據《乳腺癌診療指南》〔2〕;乳腺腫塊;多為單發,質硬,邊緣不規則,表面欠光滑;乳頭溢液;出現“酒窩征”、“橘皮樣改變”;“皮膚衛星結節”;乳頭回縮或抬高;乳頭皮膚瘙癢、糜爛、破潰、結痂、脫屑、伴灼痛;出現同側腋窩淋巴結腫大,腫大的淋巴結質硬、散在、可推動。排除肝、膽嚴重疾病;其他原發惡性腫瘤、白血病等患者;腦炎患者;既往神志異常患者。
1.2方法 對照組根據臨床常規用藥指南對癥治療,多西他賽注射液(江蘇恒瑞醫藥股份有限公司,國藥準字H20030561,生產批號:20100930)聯合注射用鹽酸表柔比星〔輝瑞制藥(無錫)有限公司,國藥準字H20000496,生產批號:20100930〕治療;表柔比星注射劑50 mg/m2,第1天靜脈滴注;多西他賽注射劑75 mg/m2加入250 ml生理鹽水,第2天,靜脈滴注3 h;在多西他賽給藥前12、6 h開始口服地塞米松20 mg,1次/d,第1~3天。應用多西他賽過程中,嚴密監測血壓、脈搏、呼吸,觀察有無過敏反應。同時給予止吐處理,間歇期,視血常規給予粒細胞集落刺激因子(G-CSF)治療,21 d為1個療程。試驗組在對照組基礎上,應用序貫免疫治療,在樹突細胞-細胞因子誘導殺傷細胞(DC-CIK)活化后,進行機體回輸,治療結束后第7天采集患者外周血,分別用CD4+、CD25+進行熒光標記,進行T細胞亞群的檢測。
1.3生化指標檢測 放射免疫法檢測雌二醇(E2)水平。DC-CIK細胞制備:采集患者外周血2×109~3×109個單核細胞及血漿80 ml,經Ficoll-Hypaque分離單個核細胞后,離心洗滌2次,用無血清RPMI1640重懸,調整細胞濃。加入腫瘤特異性抗原,誘導后12~16 h加入腫瘤壞死因子收集細胞,離心,生理鹽水洗滌3次,靜脈回輸。
1.4統計學方法 應用SPSS19.0進行t、χ2檢驗。
2 結 果
2.1兩組治療前后E2水平比較 治療后試驗組E2水平明顯低于對照組(P<0.05)。見表1。

表1 兩組治療前后E2水平比較
與對照組比較:1)P<0.05;下表同
2.2兩組各指標比較 治療后試驗組TGF-β1、干擾素(IFN)-γ、Treg細胞、CD4+、CD25+水平明顯優于對照組,白細胞介素(IL)-4、IL-6、IL-10水平明顯低于對照組(均P<0.05)。見表2。
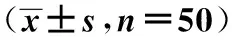
表2 兩組各指標比較
3 討 論
乳腺癌傳統療法以乳腺切除及聯合抗腫瘤藥物常規治療,用藥周期長,5年復發率較高,嚴重影響患者生命安全及身心健康。有研究顯示,目前臨床開展的DC-CIK免疫療法可明顯增強機體殺傷細胞及DC的腫瘤抗病毒效應及腫瘤細胞殺傷性,聯合常規化療進行序貫免疫治療,5年復發率較常規治療降低16.33%〔4〕。有研究顯示〔5〕,乳腺癌的發展與雌激素水平有著內在聯系。乳房組織中的雌激素水平高于血清中雌激素水平,并且乳腺癌組織中雌激素水平明顯高于正常乳腺組織。絕經后女性卵泡及子宮分泌的激素水平直線下降,但乳腺癌組織能夠保持E2的濃度高于絕經前乳腺癌組織10~20倍。臨床試驗證實〔6,7〕,控制患者雌激素水平可明顯控制腫瘤細胞的增殖活性,臨床上控制激素替代療法可明顯降低乳腺癌發病率及復發率。降低雌激素水平可控制腫瘤細胞表面雌激素受體活性,提高對抗腫瘤藥物敏感程度,促進組織細胞間黏連性水平,降低腫瘤細胞的脫落轉移。免疫序貫療法可通過自身免疫組織培養,加強殺傷細胞對腫瘤細胞的識別性,并在控制雌激素的前提下控制腫瘤細胞活性,從而降低預后復發水平,提高治療生存率。免疫序貫治療方案可良好的控制雌激素水平,降低乳腺癌復發率,重視病情及預后的評估,調控用藥量,提高臨床療效。免疫序貫治療方案可良好地控制TGF-β1及TFN-γ水平,優于傳統治療,為抗腫瘤藥物的耐藥性、敏感性及乳腺癌復發率提供理論基礎。有研究表明〔8〕,TGF-β1是一組新發現的調節細胞生長和分化的細胞因子。此類細胞因子可促進正常組織的成纖維細胞表面發生轉化,并在表皮生長因子的共同作用下,改變成纖維細胞貼壁生長特性而獲得在組織中生長的能力。TGF細胞因子可一直免疫活性細胞的增殖,并降低IFN-γ在機體的合成分泌水平,抑制胸腺細胞成熟,阻礙IL-2、IL-10等細胞因子的合成,促進腫瘤細胞分裂、增殖,抑制淋巴細胞分化,增強腫瘤細胞表面抗體及受體活性,提高耐藥性,加速原癌基因表達〔9〕。免疫序貫治療方案可提高DC在體內的抗原呈遞作用,激發宿主對特異性抗原的免疫反應,提高抗腫瘤藥物對腫瘤細胞表面抗體及受體的識別度,大量殺傷腫瘤細胞,并抑制TGF-β的分泌,CIK可促進大量免疫細胞因子及T淋巴細胞亞群等主要效應細胞異質細胞群的增殖,提高殺傷細胞的增值性、殺腫瘤活性〔10〕。序貫免疫治療方案較傳統化療降低調節性T細胞比率并升高T淋巴細胞亞群CD4+、CD25+水平,對乳腺癌的病情控制及預后評估提供臨床理論依據。有研究顯示,Treg細胞是機體內有自身免疫反應性的T細胞亞群,與自身免疫性疾病發生關系密切,可促進體內IL-10及TGF-β的分泌〔11〕。免疫序貫治療方案可通過活化DC及CIK水平,降低Treg細胞比率,控制機體自身免疫反應,降低腫瘤細胞表面受體活性,并促進CD4+、CD25+的大量分泌,提高自身免疫功能,間接加強DC及CIK細胞對腫瘤細胞的殺傷活性,提高特異性識別度。免疫序貫治療可提高表達轉錄因子Foxp3的合成,可作為CD4+、CD25+活性水平的標志分子,決定了CD4+、CD25+功能活性〔12〕。
序貫治療方案較傳統化療方案控制IL-4、IL-10水平更為優異,對患者特異性免疫功能水平評估提供重要意義。有研究顯示,乳腺癌患者機體的IL-6及IL-10由輔助性T細胞(Th1)細胞分泌,IL-4由Th2細胞分泌,其可加速B細胞分化成熟,是B細胞產生抗體所必須的分化因子。IL-6可輔助Th2細胞產生IL-4細胞因子,此類細胞因子在免疫復合物IgE、IgM等合成分泌中起到間接輔助作用。乳腺癌患者體內大量合成分泌的IL-4及IL-10與腫瘤細胞進行特異性免疫反應,通過序貫免疫治療后,大量DC及CIK細胞對腫瘤細胞殺傷吞噬,降低了腫瘤細胞活性,從而降低機體特異性反應的進行,并且序貫免疫治療可激活T細胞增殖活性,提高T細胞免疫和細胞免疫功能,提高患者免疫功能。因此,免疫序貫治療后對乳腺癌患者IL-4及IL-10水平的監測可反映機體腫瘤細胞活性,為預后評估及后續化療用藥量及治療期的調整提供關鍵性作用及依據。本實驗證實了序貫免疫治療可提高機體對腫瘤細胞的殺傷作用,并控制自身免疫反應的進行,降低腫瘤細胞與T淋巴細胞等免疫細胞的特異性反應,可作為乳腺癌的高效常規治療方案,為疾病的診斷、治療及預后評估提供敏感致病及重要依據。
1Agarwalla P,Barnard Z,Fecci P,etal.Sequential immunotherapy by vaccination with GM-CSF-expressing glioma cells and CTLA-4 blockade effectively treats established murine intracranial tumors〔J〕.J Immunother,2012;35(5):385-9.
2Hopfinger G,Busch R,Pflug N,etal.Sequential chemoimmunotherapy of fludarabine,mitoxantrone,and cyclophosphamide induction followed by alemtuzumab consolidation is effective in T-cell prolymphocytic leukemia〔J〕.Cancer,2013;119(12):2258-67.
3Woyach JA,Ruppert AS,Rai K,etal.Impact of age on outcomes after initial therapy with chemotherapy and different chemoimmunotherapy regimens in patients with chronic lymphocytic leukemia:results of sequential cancer and leukemia group b studies〔J〕.J Clin Oncol,2013;31(4):440-7.
4Kitawaki T.DC-based immunotherapy for hematological malignancies〔J〕.Int J Hematol,2014;99(2):117-22.
5Aznar M,Melero I,Quetglas JL.Routing cancer immunology and immunotherapy from the lab to the clinic 4-5 th March 2014,Center for Applied Medial Research and University Clinic,Pamplona,Spain〔J〕.J Transl Med,2014;202(1):1284-90.
6Prins RM,Soto H,Konkankit V,etal.Gene expression profile correlates with T cell infiltration and relative survival in glioblastoma patients vaccinated with dendritic cell immunotherapy〔J〕.Clin Cancer Res,2011;17(6):1603-15.
7Wilgenhof S,van Nuffel AM,Corthals J,etal.Therapeutic vaccination with an autologous mRNA electroporated dendritic cell vaccine in patients with advanced melanoma〔J〕.J Immunother,2011;34(5):448-56.
8Wierda WG,Kipps TJ,Dürig J,etal.Chemoimmunotherapy with O-FC in previously untreated patients with chronic lymphocytic leukemia〔J〕.Blood,2011;117(24):6450-8.
9Iclozan C,Antonia S,Chiappori A,etal.Therapeutic regulation of myeloid-derived suppressor cells and immune response to cancer vaccine in patients with extensive stage small cell lung cancer〔J〕.Cancer Immunol Immunother,2013;62(5):909-18.
10Chu CS,Boyer J,Schullery DS,etal.Phase Ⅰ/Ⅱ randomized trial of dendritic cell vaccination with or without cyclophosphamide for consolidation therapy of advanced ovarian cancer in first or second remission〔J〕.Cancer Immunol Immunother,2012;61(5):629-41.
11Oudard S,Rixe O,Beuselinck B,etal.A phase Ⅱ study of the cancer vaccine TG4010 alone and in combination with cytokines in patients with metastatic renal clear-cell carcinoma:clinical and immunological findings〔J〕.Cancer Immunol Immunother,2011;60(2):261-71.
12Wood LM,Pan ZK,Guirnalda P,etal.Targeting tumor vasculature with novel Listeria-based vaccines directed against CD105〔J〕.Cancer Immunol Immunother,2011;60(7):931-42.

