外周血幼稚淋巴細胞、染色體、E2A/PBX1、TEL/AML1、MLL融合基因聯合檢測用于兒童淋巴細胞白血病的早期診斷
趙理平,周傳恩,崔娓,李科成,蘇文
據報道,目前兒童急性淋巴細胞白血病(cALL)發病率有上升趨勢,嚴重威脅兒童生命健康[1,2]。一直以來,實行骨髓穿刺術抽取骨髓,檢查其細胞形態是白血病早期診斷的“金標準”,可這種取材方法創傷性大,對兒童尤其是低齡兒來說極其痛苦及不便。外周血細胞是由骨髓原始干細胞發育、分化而來,無論白血病的何種階段,理論上外周血都有相應的改變。抽取外周血相比骨髓穿刺創傷性小,能很大程度減輕患兒痛苦。白血病作為一種造血細胞克隆性疾病,細胞遺傳學改變在其發生、發展中起著重要作用[3],近年來,隨著細胞遺傳學和分子生物學技術的發展,染色體核型分析和融合基因檢測在白血病的診斷中逐漸占據重要位置,其不僅從分子水平上進一步闡明白血病發病機制,還用于白血病的分子生物學分型,本文通過抽血這種無創式取材,聯合檢測外周血幼稚淋巴細胞、染色體、融合基因,以探討其對兒童淋巴細胞白血病早期診斷或提示性診斷的臨床意義。
1 資料與方法
1.1 研究對象 我院2012年8月至2017年6月門診及住院兒童外周血涂片初查異常淋巴細胞的病例220例,年齡3月~12歲,其中男128例,女92 例,男:女=1.4:1。
1.2 試劑和儀器 外周血幼稚淋巴細胞形態學檢查所用瑞氏染料及染色體制備所用吉姆薩染料由廣州達暉生物技術有限公司提供;染色體培養基由廣州白云山拜迪生物醫藥有限公司提供;Imager Z2型號蔡司全自動染色體核型分析儀掃片;Vysis探針試劑盒;熒光顯微鏡。
1.3 方法
1.3.1 外周血涂片 常規消毒行外周血采集后制成血涂片,干燥固定,瑞氏染色,OLYMPUSCH2顯微鏡油鏡下觀察異常淋巴細胞并進行分類計數。
1.3.2 染色體制備 對外周血細胞形態檢查高度懷疑急性淋巴細胞白血病患者抽取靜脈血進行染色體培養、制備、G顯帶,核型報告參照《人類細胞遺傳學國際命名體制ISCN2013》進行描述。
1.3.3 融合基因檢測 對外周血細胞形態檢查高度懷疑急性淋巴細胞白血病患者抽取靜脈血FISH技術檢測融合基因。
2 結果
220例患者中,33例外周血異常淋巴細胞陰性,187例陽性,在陽性患者中有24例外周血涂片可觀察到一種“特殊類型”的異常幼稚淋巴細胞,這種細胞異型性更明顯,外形明顯不規則,細胞核粗顆粒狀,暫稱為“白血病型”幼稚淋巴細胞(圖1),在外周血細胞中占比范圍在1%~38%,其中比例范圍在1%~10%有3例,比例范圍在11%~20%有11例,比例范圍在21%~38%的有10例,這24例患者后經骨髓檢查驗證,除比例范圍在1%~10%中的2例外,其余22例均診斷為急性淋巴細胞白血病。對比例在11%~20%的11例患者及比例在21%~38%的10例患者均抽取靜脈血檢查染色體、融合基因(因比例高易于染色體、融合基因陽性的檢出),結果比例在11%~20%的11例患者染色體均未見異常,未檢出融合基因9例,檢出融合基因2 例,其中 1例 TEL/AML1 陽性(男性)(圖 2),1 例E2A/PBX1(即 PBX1/TCF3)陽性(男性)(圖 3)。 比例在21%~38%的10例患者中8例染色體未見異常,2例染色體異常(均為結構異常,男性),其中1例為 46,XY,t(1;19)(q23;p13)(圖 4),1 例為 46,XY,t(4;11)(q21;q23)(圖 5),未檢出融合基因 4 例,檢出融合基因6例,其中4例TEL/AML1陽性(男性2例, 女性2例),1例E2A/PBX1陽性 (男性),1例MLL陽性(男性)(圖6),圖中白色箭頭所示為陽性信號。結果見表1。
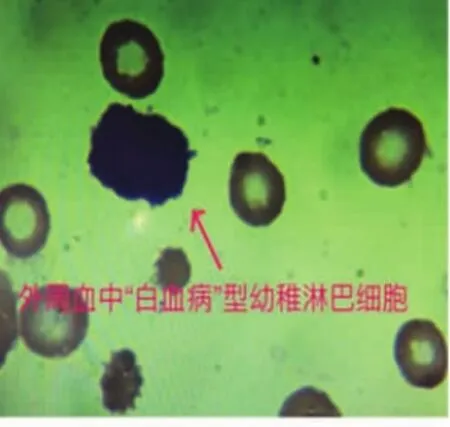
圖1 “白血病型”幼稚淋巴細胞 (瑞氏染色,×1000)
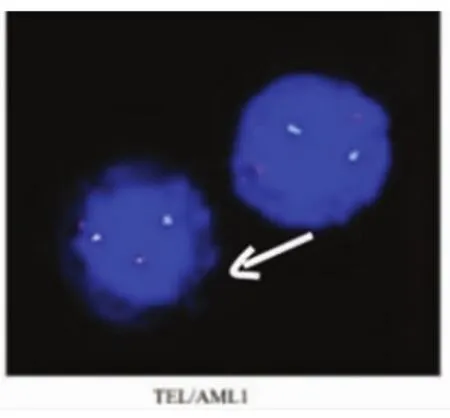
圖2 FISH檢測TEL/AML1陽性
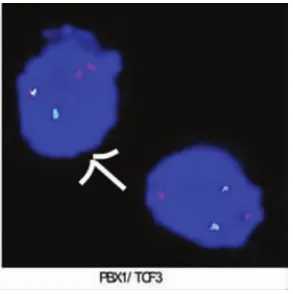
圖3 FISH檢測E2A/PBX1陽性
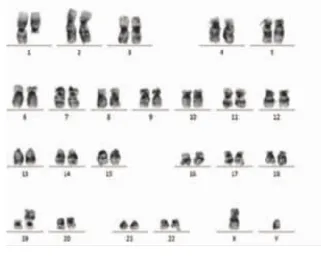
圖4 G顯帶染色體核型 t(1;19)(q23;p13)

圖5 G顯帶染色體核型 t(4;11)(q21;q23)
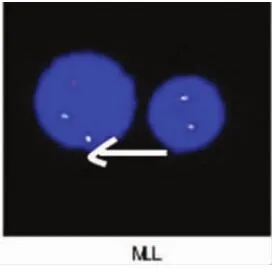
圖6 FISH檢測MLL陽性
3 討論
外周血出現異常淋巴細胞增多一部分是由于病毒感染等因素刺激淋巴細胞增生亢進,使之發生不平衡而導致的一種機體反應,一部分卻是惡性腫瘤細胞對骨髓及外周血的浸潤,是惡性腫瘤的早期提示。本文24例患者外周血涂片觀察到的“特殊類型”的異常幼稚淋巴細胞增多就是惡性腫瘤的早期提示,這種細胞(暫稱為“白血病型”幼稚淋巴細胞)具有共同特點:異型性更明顯,外形明顯不規則,細胞核粗顆粒狀,可見核溝等,本文研究中這種細胞在外周血細胞中占比范圍在1%~38%。這24例患者后經骨髓檢查驗證有22例均確診為急性淋巴細胞白血病,說明外周血幼稚淋巴細胞形態學檢查對兒童淋巴細胞白血病具有一定的早期診斷及提示性診斷作用。
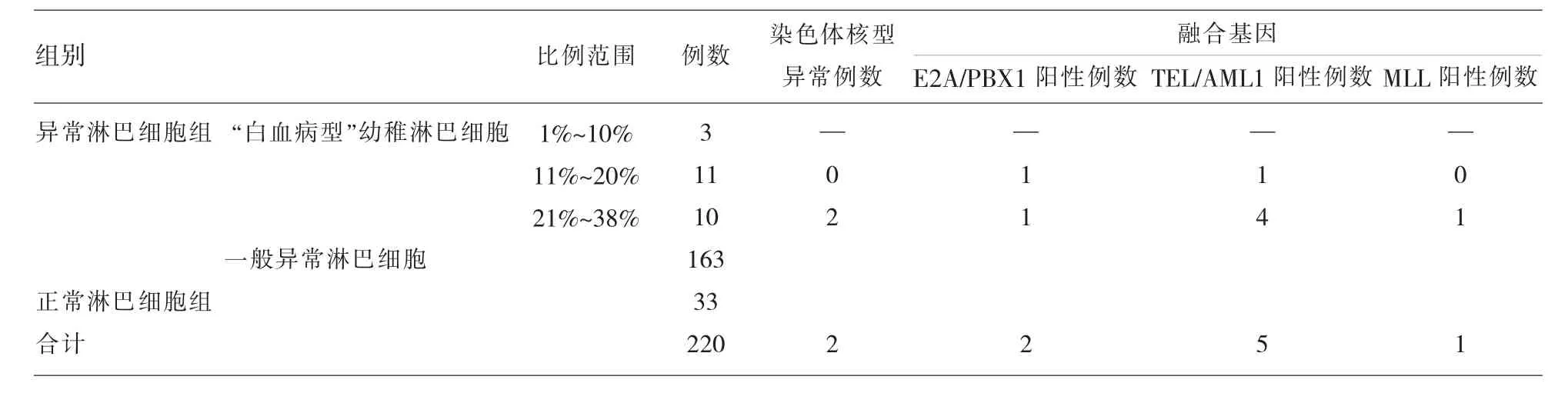
表1 220例患者外周血涂片結果及21例染色體、融合基因檢查結果
染色體畸變與白血病發病密切相關[4]。染色體畸變導致原癌基因或抑癌基因結構變異,原癌基因激活或抑癌基因失活,產生新的融合基因,編碼融合蛋白。迄今報道涉及50多種特異的染色體易位形成的融合基因[4]。兒童急性淋巴細胞白血病(cALL)中,染色體畸變檢出率最高的核型是t(12;21)(p13;q22);t(1;19)(q23;p13);t(9;22)(q34;q11);t(4;11)(q21;q23)等。 文獻[5-10]報道兒童 ALL 中最常見的融合基因包括t(12;21)易位形成的TEL/AML1融合基因,t(1;19)易位形成的E2A/PBX1融合基因,t(9;22)易位形成的BCR/ABL融合基因以及t(4;11)易位形成的AF4/MLL融合基因,而這4種融合基因中TEL/AML1是小兒ALL最常見的基因改變[11],本文21例檢查融合基因E2A/PBX1、TEL/AML1、MLL,有 5例 TEL/AML1陽性,僅有 2例E2A/PBX1陽性,1例MLL陽性,說明TEL/AML1較其他融合基因常見,與之相符。TEL/AML1基因融合是由t(12;21)(p13;q22)易位使12號染色體上的TEL基因的螺旋2環2螺旋結構域融合到21號染色體上的AML1基因的DNA結合域和轉錄活化域而形成的,常伴有其他TEL基因的缺失[12]。二者融合之后,AML1由轉錄活化因子轉變為抑制因子是白血病發病的分子基礎。由于t(12;21)易位片段G顯帶十分相似,通常不引起染色體的形態改變,常規核型分析對其的檢出率不足0.05%[13]。本文5例TEL/AML1陽性患者染色體核型未檢出異常,檢出率低,與報道相符。而FISH技術彌補了這一不足。染色體R顯帶與常規G顯帶相反,可使G顯帶不易檢出的易位片段易于檢出,建議染色體核型分析常規G顯帶的同時加做R顯帶可提高染色體畸變的檢出率。
兒童ALL中有不足10%的患兒存在t(1;19)(q23;p13),該易位形成 E2A/PBX1 融合基因[14],PBX1蛋白參與細胞的分化調控,融合蛋白使正常PBX1蛋白失活,是導致ALL發病的主要因素[15]。本文21例患者中有1例染色體核型為46,XY,t(1;19)(q23;p13),占 4.8%,融合基因 E2A/PBX1 陽性2例,占9.5%,均不足10%,與報道相符。2例E2A/PBX1陽性患者中1例染色體核型為46,XY,t(1;19)(q23;p13),其外周血異常淋巴細胞比例在21%~38%,而另1例染色體核型正常,其外周血異常淋巴細胞比例在11%~20%,可見染色體核型陽性檢出率可能與異常淋巴細胞比例有關。染色體核型分析技術有較多的影響因素,如培養成功率低、敏感性低等,FISH技術可直接檢測間期細胞.不需要細胞培養,能分辨較小的染色體易位或缺失區域(相對分子質量50×103左右),因此可以彌補染色體核型分析的不足[16]。
MLL基因位于11q23,白血病時MLL基因會發生重排[17]。MLL基因重排包括缺失、重復、插入及易位。重排的MLL基因丟失了SET和PHD結構域而不能發揮其原有正常功能,即對造血祖細胞的細胞周期及分化的負調控作用,這是MLL基因重排導致白血病的發病機制之一。兒童急性白血病約有5%~10%可檢測到MLL基因改變[4]。本文21例患者中有 1例染色體核型為 46,XY,t(4;11)(q21;q23),其融合基因 MLL 陽性,檢出率 4.8%,與文獻報道相近。此例患者染色體核型與融合基因檢測結果相互驗證及吻合,其外周血“白血病型”幼稚淋巴細胞比例在21%~38%,可見聯合檢測外周血幼稚淋巴細胞、染色體、融合基因,對兒童淋巴細胞白血病起到了早期診斷的作用。目前本文研究的例數有限,還有待后期進一步積累數據,加強研究。
綜上所述,外周血幼稚淋巴細胞形態學檢查對兒童淋巴細胞白血病具有一定的早期診斷及提示性診斷作用。而染色體核型分析與融合基因檢測技術從分子水平上進一步闡明白血病發病機制,用于白血病的診斷分型,此兩種技術之間又可相互驗證及補充。聯合檢測外周血幼稚淋巴細胞、染色體、E2A/PBX1、TEL/AML1、MLL 融合基因可用于兒童淋巴細胞白血病的早期診斷及提示性診斷,與經典有創的骨髓檢查相比,這種無創的檢查模式值得臨床推廣借鑒。

