耐鹽纖維素降解菌的篩選、鑒定及其配比優化的研究
王旭輝,葉 凱,徐 鑫,山其米克,王 卉,李 冠,鄧 宇
(1.新疆大學生命科學與技術學院,烏魯木齊 830046;2.新疆農業科學院生物質能源研究所,烏魯木齊 830091;3.新疆農業科學院糧食作物研究所,烏魯木齊 830091;4.農業部沼氣科學研究所,成都 610041)
0 引 言
【研究意義】纖維素是一種含量豐富的可再生能源,在自然界中分布十分廣泛。纖維素不易溶于水和一般溶劑,在環境中結構十分穩定,是很難被降解的污染物,并廣泛存在于畜禽養殖糞便和農作物秸稈中[1-4]。新疆土壤鹽堿化程度比較嚴重,面積達11×104km2,約占全國鹽堿土地面積的三分之一。因此從當地自然環境中篩選和分離耐鹽高效纖維素降解菌株,挖掘利用纖維素酶的酶解作用,解決當地環境污染和再生能源問題具有重要的研究意義。【前人研究進展】纖維素是由大分子多糖聚集而成,在其內部交錯形成了無定形區和結晶區域[5]。纖維素酶主要包括外切葡聚糖酶、β-葡萄糖苷酶和內切型葡聚糖酶,秸稈纖維素的分解需要這三種纖維素酶協同完成[6]。雖然在前人的研究工作中,已有關于常規環境下纖維素降解菌的報道[7-9],但在鹽堿環境下秸稈纖維素降解菌的研究卻剛剛起步,在鹽堿環境下高濃度鹽堿離子不但會造成土壤滲透系數降低,而且對常規纖維素降解菌活性有強烈抑制作用,使其降解效率大大降低,因此篩選適應鹽堿地區的高效耐鹽纖維素降解菌十分必要;而且纖維素降解菌的產酶種類比較單一[10]。【本研究切入點】要降解天然纖維素,需要重視不同菌株之間的相互協同效應,構建高效纖維素降解復合菌系[11-12],研究從玉米秸稈堆肥的鹽堿土壤分離篩選高效耐鹽秸稈纖維素降解菌株,并對其降解效果及菌種配比展開響應面優化試驗研究。【擬解決的關鍵問題】篩選出高效耐鹽纖維素降解菌和玉米秸稈的最佳降解工藝,為新疆鹽堿地區玉米秸稈的微生物降解提供科學依據。
1 材料與方法
1.1 材 料
1.1.1 樣品來源
在瑪納斯試驗站采集玉米秸稈堆肥的鹽堿土壤,放入無菌袋中于冰箱4℃冷藏[13]。
1.1.2 儀器和試劑
DNA提取試劑盒;dNTP;TaqDNA聚合酶;無水CaCl2、K2HPO4等分析純。
超凈工作臺SW-CJ-2FD:上海博迅實業有限公司;SPX-160生化培養箱:江南儀器廠;恒溫搖床ZWY-211B:上海智城分析儀器有限公司;高速冷凍離心機D-37520:Osterode Kendro Laboratory Products;立式壓力蒸汽滅菌器LDZX-50FBS:上海申安醫療器械有限公司;PCR擴增儀C1000:Bio-Rad。
1.1.3 菌種篩選培養基
肉汁胨培養基(NA):牛肉膏 3 g,蛋白胨 5 g,酵母浸膏 2 g,葡萄糖 8 g,瓊脂粉16 g,去離子水 1 L,pH=7.0。
赫奇遜氏無機鹽培養基:NaCl 0.1 g,MgSO4·7H2O 0.3 g,NaNO32.5 g,KH2PO41.0 g,CaCl20.1 g,加去離子水至 1 L,pH=7.2。
液體發酵培養基:在赫奇遜氏無機鹽培養基中添加纖維素 20 g/L。
平板濾紙培養基:在赫奇遜氏無機鹽培養基中添加瓊脂粉 18 g/L,倒好平板后鋪一張濾紙片在培養基表面。
種子培養基:馬鈴薯 200 g,切塊煮沸 20 min,用細紗布過濾,添加葡萄糖 20 g,瓊脂 18 g,加離子水至 1 L,120℃高壓滅菌 30 min。
CMC-Na平板培養基:馬鈴薯 200 g,切塊煮沸 20 min,用細紗布過濾,再加CMC-Na 10 g,瓊脂 18 g,加去離子水至 1 L,pH=7.2。
1.2 方 法
1.2.1 纖維素降解菌的富集和初篩1.2.1.1 富集
采集玉米秸稈堆肥的土壤,天平稱取20 g土壤放入經過高溫高壓滅菌的250 mL的三角瓶中,加入150 mL無菌去離子水,混合均勻,然后在30℃生化培養箱培養12 h。取10 mL上清液置于高溫高壓滅菌的250 mL的三角瓶中,加入150 mL的液體培養基,在30℃生化培養箱培養3 d,取上清液10 mL至液體培養基中,重復培養3次,富集得到含有纖維素降解菌的混合菌液。
1.2.1.2 初篩
取1 mL混合菌液加入高溫滅菌的250 mL的三角瓶中,加入99 mL無菌去離子水,在恒溫搖床中溫度30℃、轉速200 r/min條件下培養4 h后,取l mL菌懸液,用無菌去離子水進行濃度稀釋,取10-2、10-3、10-4不同的稀釋濃度,分別均勻涂布于平板濾紙培養基上,置于30℃生化培養箱再培養3 d,挑選出在平板濾紙培養基上生長良好,且對濾紙片有降解的菌落。
1.2.2 纖維素降解菌的復篩
上述分離得到的纖維素降解菌接種于CMC-Na平板培養基中,30℃生化培養箱培養3 d,將平板中有比較明顯水解圈的產酶菌株接種至NA培養基中進行再純化后再接種到種子斜面培養基上,在30 ℃生化培養箱培養3 d,然后置于4℃冰箱保藏。
CMC-Na水解圈試驗:將復篩得到的高效產酶菌株接種于CMC-Na平板培養基,培養3 d,用0.1%的剛果紅水溶液浸染30 min,再用1 mol/L的NaCl溶液脫色1 h,用游標卡尺對水解圈直徑(D/cm)和菌落直徑(d/cm)進行測定,以Dp值表示纖維素酶的水解能力:Dp=(D/d)2。
1.2.3 纖維素酶活力的測定1.2.3.1 粗酶液制備
將復篩得到的1 mL菌液加入滅菌的150 mL三角瓶,加入49 mL液體發酵培養基,于30℃恒溫搖床中200 r/min培養3 d,收取培養液至50 mL離心管中,高速冷凍離心機4℃、4 000 r/min離心15 min,離心管的上清液為粗酶液。
1.2.3.2 CMC酶活測定
將10 g CMC加入1 000 mL滅菌去離子水,混勻,吸取1.5 mL混合液加入到25 mL試管中,再加入0.5 mL粗酶液,搖勻后立即放入30℃水浴鍋中反應1 h。然后加入1.5 mL DNS終止酶解反應,沸水浴中反應10 min,自然冷卻后加入離子水定容至20 mL。用紫外分光光度計測定其在540 nm波長下的吸光值[14]。
1.2.4 耐鹽纖維素降解菌的篩選
利用添加1%、3%、5%、7%的NaCl濃度逐級篩選耐鹽高效纖維素降解菌株。將篩選的高效纖維素降解菌在CMC-Na平板培養基上劃線培養,30℃生化培養箱培養3 d,選取在不同鹽濃度生長良好的單菌落,經劃線純化的菌種在30℃生化培養箱培養3 d,然后置于4℃冰箱保藏。耐鹽纖維素降解菌多呈淡黃、淡粉、乳白色菌落,菌體多為桿狀或球狀,菌體在去離子水種放置1 d,在光學顯微鏡下觀察無破壁與變形狀態。
1.2.5 菌種鑒定
對篩選得到的4株高效耐鹽纖維素降解菌進行革蘭氏染色[15],對菌株的菌落結構和形態進行觀察。根據《常見細菌系統鑒定手冊》對4株高效耐鹽纖維素降解菌進行生理生化初步鑒定[16]。
采用鼎國昌盛生物技術有限公司的細菌基因組DNA提取試劑盒進行秸稈纖維素降解菌總DNA的提取,采用細菌PCR的通用引物1 492R和27F進行16S rRNA片段的擴增,PCR 擴增反應體系(50 μL)包括: DNA模板2 μL,5 U/μLTaq酶0.25 μL,2.5 mmol/L dNTPs 混合溶液 4 μL,10 mmol/L引物各1 μL,10×PCR 緩沖溶液 5 μL,ddH2O 36.75 μL,PCR反應條件為:94℃預變性9 min,94℃變性50 s,52℃退火40 s,72℃延伸70 s,32個循環,最后在72℃繼續延伸6 min,4℃冰箱保存。4株高效耐鹽纖維素降解菌的PCR產物用瓊脂糖凝膠電泳檢測,回收后送到上海生工進行雙向測序。將測序結果導入GenBank數據庫中,通過數據庫分析確定4株耐鹽高效纖維素降解菌的種屬。
1.2.6 單菌最優添加量以及菌種配比的響應面優化
1.2.6.1 單因素試驗
將篩選得到4株耐鹽高效纖維素降解菌進行活化,將菌液加入離心管中5 000 r/min離心5 min,棄除上清液,收集沉淀的菌體在無菌環境下常溫干燥24 h制成固體微生物菌劑,將固體菌劑WH2、WH4、WH7和WH9常溫條件下儲存備用。以4株菌的接種量為單因素進行試驗確定纖維素降解的最佳因素水平。準確稱重2.00 g的玉米秸稈粉,按不溶性碳為2%的量配制赫奇遜氏無機鹽培養基,將降解菌劑WH2、WH4、WH7和WH9分別接入上述培養基培養。WH2分別接種0.1、0.2、0.3、0.4和0.5 g時,另外三種降解菌初始添加量為0.1 g;WH4分別接種0.1、0.2、0.3、0.4和0.5 g時,WH2添加單因素篩選的最佳量,另外兩種降解菌初始添加量為0.1 g;WH7和WH9按照以上方法接種。在30℃,200 r/min條件下振蕩培養,在第7 d取出秸稈纖維素樣品,將殘余物置于80℃烘箱烘干并稱重,采用改進的Van Soest洗滌法測定樣品失重率[17-19]。玉米秸稈纖維素降解率公式如下:
W=(S-S1)/S×100%.
(1)
式中W代表秸稈降解百分比,S代表秸稈的原始干重,S1秸稈降解后的烘干量。
1.2.6.2 響應面優化
以BBK的中心組合試驗設計方式為基礎[20-22],結合單因素試驗的結果設計四因素三水平的響應面分析法,分別選取纖維素降解菌株WH2、WH4、WH7和WH9的接種量作為自變量,以秸稈纖維素降解率作為響應值設計響應面試驗,水平和因素取值。表1
表1 響應面法設計因素和水平
Table 1 Response surface methodology design factors and levels
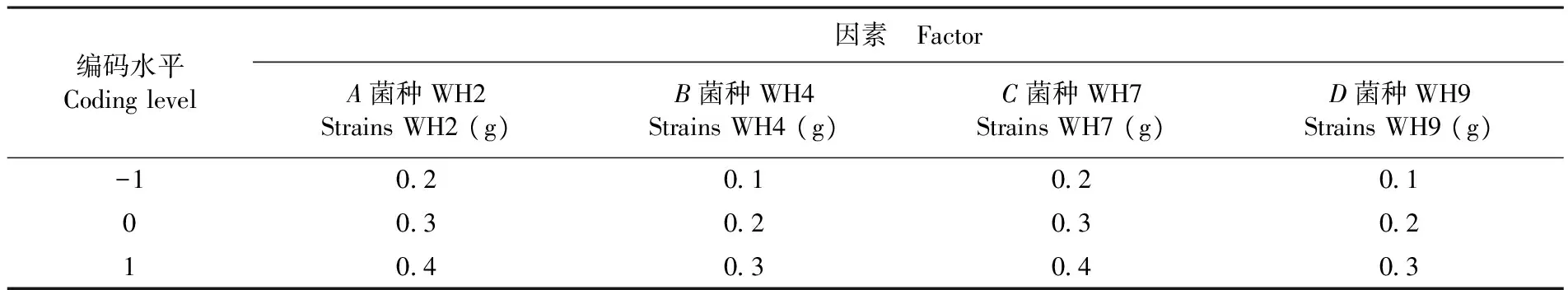
編碼水平Codinglevel因素 FactorA菌種WH2StrainsWH2(g)B菌種WH4StrainsWH4(g)C菌種WH7StrainsWH7(g)D菌種WH9StrainsWH9(g)-102010201003020302104030403
2 結果與分析
2.1 菌種的初篩和復篩
從玉米秸稈堆肥的鹽堿土壤中分離純化得到10株纖維素降解菌,分別標記為WH1~WH10,這些纖維素降解菌對玉米秸稈纖維素均具有一定的降解能力。然后以不接菌的赫奇遜氏培養基為對照組,以玉米秸稈粉為惟一碳源,對所篩選得到的WH1~WH10進行纖維素降解能力測定,通過纖維素降解率公式(1)計算得各菌株的降解效果。結果表明,經7 d培養后,不同降解菌的纖維素降解能力差異十分明顯,降解率最低的只有4.9%,而降解率最高達到32.6%,其中共有4株纖維素降解菌的降解率大于20%,選取菌株WH2、WH4、WH7和WH9為高效纖維素降解菌。表2
2.2 纖維素降解能力測定
將篩選獲得的10株纖維素降解菌進行CMC-Na水解和纖維素酶活試驗。結果表明,WH4菌株的Dp=64.85,纖維素酶活為28.42 U/mL,均為最高值,結果表明,菌株WH4具有最強的纖維素水解能力和纖維素酶活。表3
表2 10株細菌對纖維素的降解能力
Table 2 The ability of degrading cellulose of 10 strains
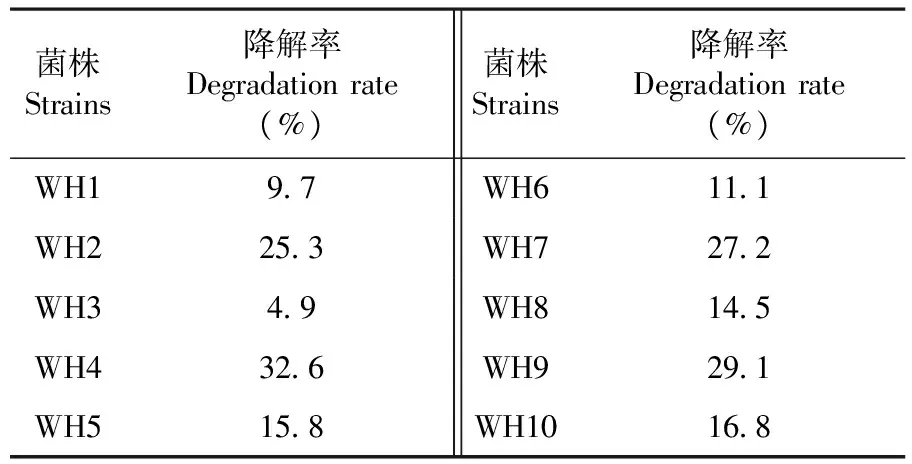
菌株Strains降解率Degradationrate(%)菌株Strains降解率Degradationrate(%)WH197WH6111WH2253WH7272WH349WH8145WH4326WH9291WH5158WH10168
表3 10株纖維素降解菌在 CMC-Na 固體培養基上的降解能力
Table 3 Degradation of ten cellulose-degrading strains in CMC-Na medium
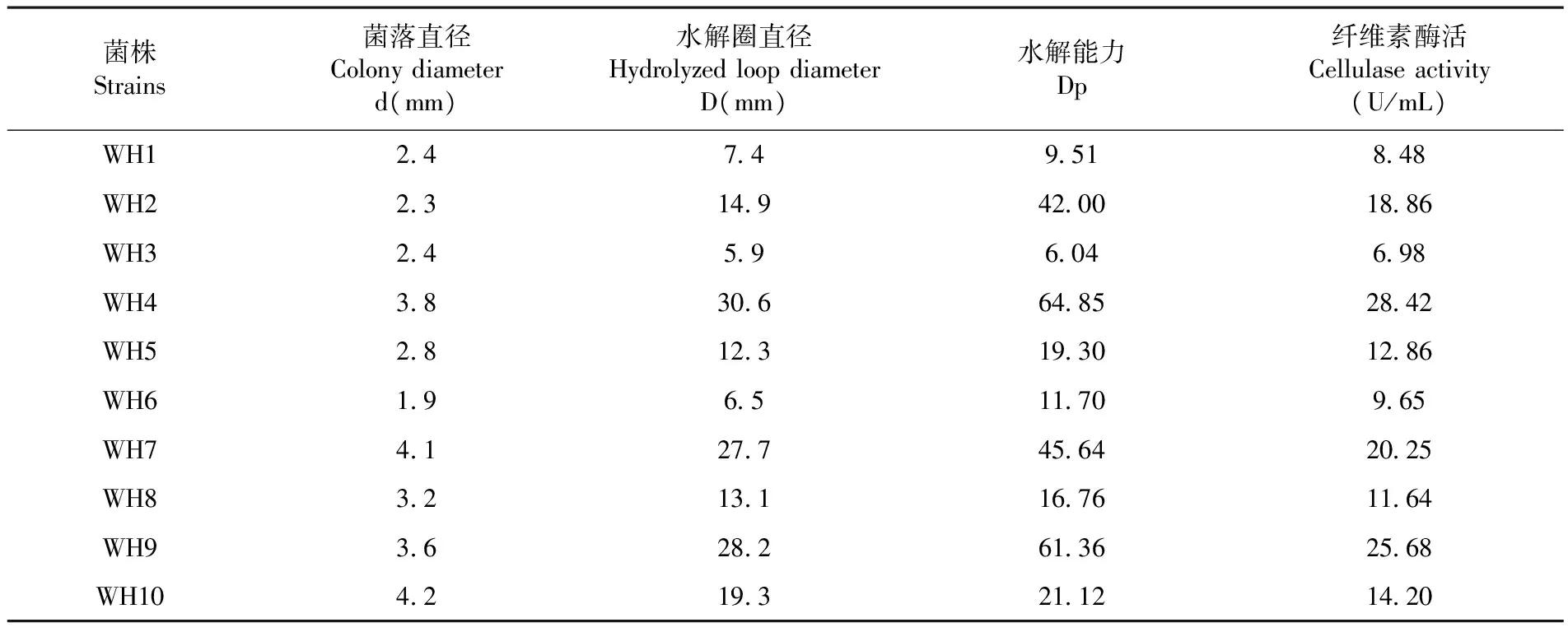
菌株Strains菌落直徑Colonydiameterd(mm)水解圈直徑HydrolyzedloopdiameterD(mm)水解能力Dp纖維素酶活Cellulaseactivity(U/mL)WH12474951848WH22314942001886WH32459604698WH43830664852842WH52812319301286WH619651170965WH74127745642025WH83213116761164WH93628261362568WH104219321121420
2.3 耐鹽能力測定
利用在培養基中添加1%、3%、5%、7%的NaCl濃度逐級篩選耐鹽高效纖維素降解菌株。研究表明,1%鹽濃度下10株降解菌都能很好的生長;鹽濃度達到3%,WH1和WH6不能正常生長;鹽濃度達到5%,只有WH9能很好生長;鹽濃度達到7%,所有菌株都不能正常生長;菌株WH9具有最佳的耐鹽性,可以耐5%鹽濃度。表4
2.4 菌種鑒定結果
分別采用生理生化實驗與形態學觀察相結合的方法對4株高效降解菌株WH2、WH4、WH7和WH9進行鑒定,研究表明,WH2和WH7有芽孢,為革蘭氏陽性菌;WH4和WH9沒有芽孢,為革蘭氏陰性菌,其形態特征都為桿狀。表5
研究表明,4株耐鹽纖維素高效降解菌PCR產物在1 500 bp處均有明顯條帶,符合序列測定要求。將回收的PCR產物送到上海生工進行雙向測序,得到WH2、WH4、WH7和WH9的16S rRNA的序列。通過BLAST進行同源性比較確定4株耐鹽高效纖維素降解菌WH2、WH4、WH7和WH9分別是蠟樣芽孢桿菌(Bacilluscereus)、熒光假單胞菌(Pseudomonasformosensis)、枯草芽孢桿菌(Bacillussubtilis)和松嫩假單胞菌(Pseudomonassongnenensis)。圖1
表4 耐鹽菌株在含鹽平板上生長情況
Table 4 Growth of salt tolerant bacteria on salt medium
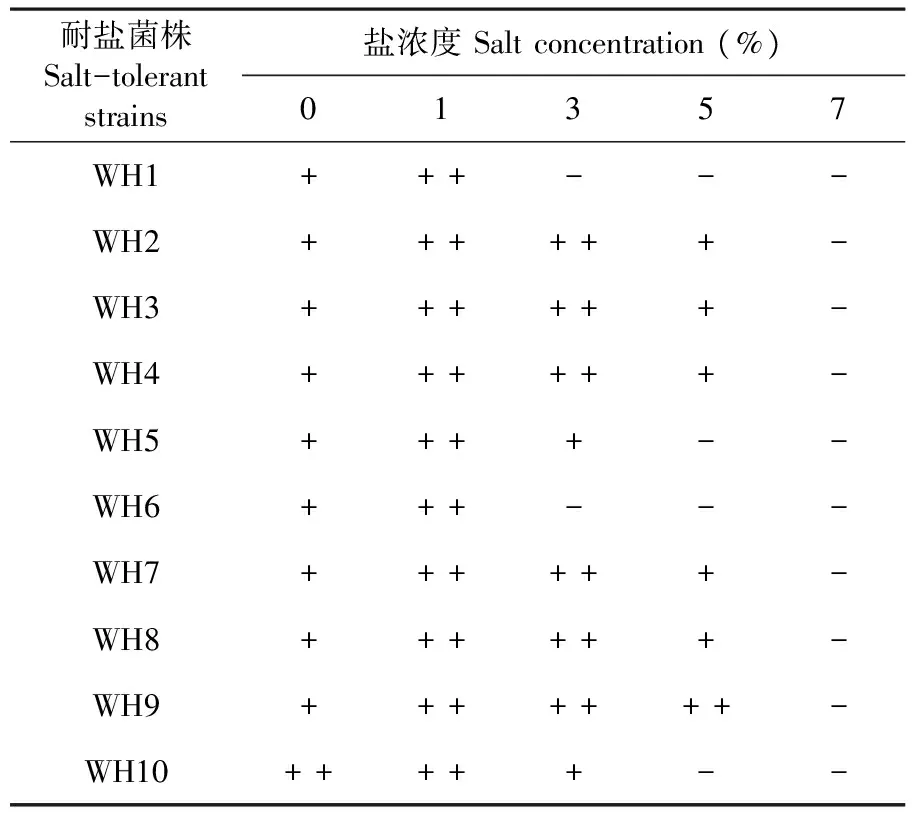
耐鹽菌株Salt-tolerantstrains鹽濃度Saltconcentration(%)01357WH1+++---WH2++++++-WH3++++++-WH4++++++-WH5++++--WH6+++---WH7++++++-WH8++++++-WH9+++++++-WH10+++++--
注:“ + ”代表菌株在含鹽平板上正常生長,“ - ”代表菌株在含鹽平板上生長受抑制或基本不生長
Note: "+" indicates that the strain grows normally on the salt-containing plate,and "-" means that the strain is inhibited from growing or does not grow substantially on the salt-containing plate
表5 四株耐鹽纖維素降解菌的生理生化特征
Table 5 Physiological and biochemical characteristics of four salt tolerant cellulose-degrading strains
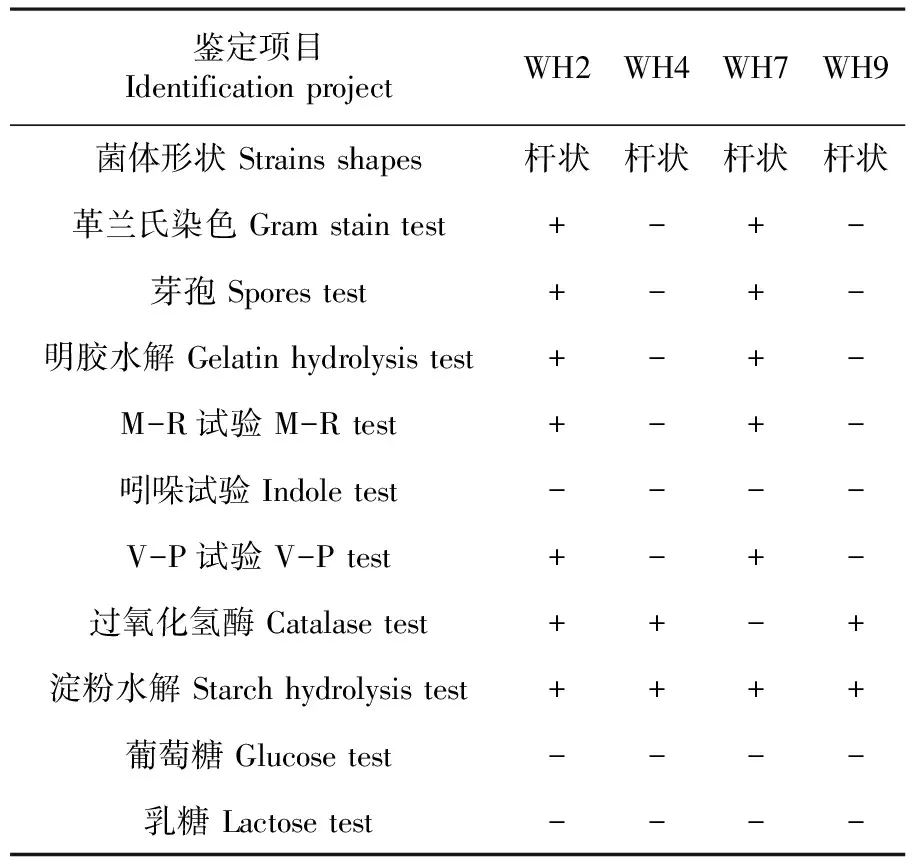
鑒定項目IdentificationprojectWH2WH4WH7WH9菌體形狀Strainsshapes桿狀桿狀桿狀桿狀革蘭氏染色Gramstaintest+-+-芽孢Sporestest+-+-明膠水解Gelatinhydrolysistest+-+-M-R試驗M-Rtest+-+-吲哚試驗Indoletest----V-P試驗V-Ptest+-+-過氧化氫酶Catalasetest++-+淀粉水解Starchhydrolysistest++++葡萄糖Glucosetest----乳糖Lactosetest----
注: 符號‘-’代表陰性反應;‘+’代表陽性反應
Note: The symbol '-' represents the negative reaction; '+' represents the positive reaction
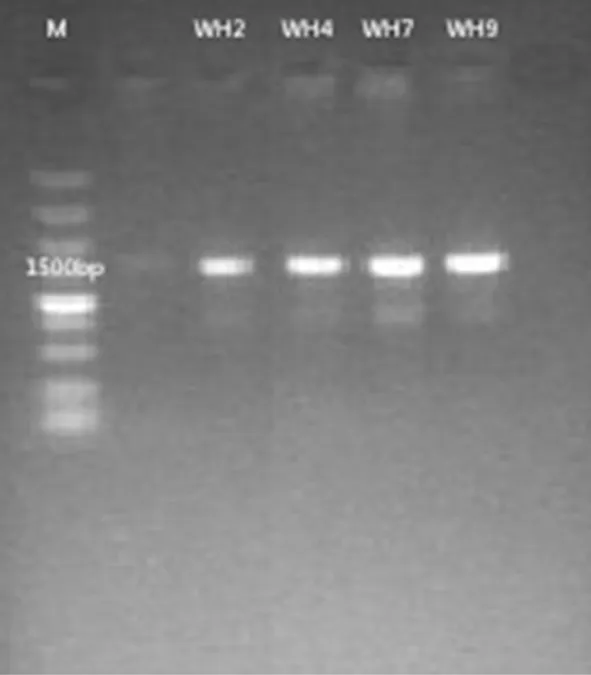
圖1 四株高效降解菌瓊脂糖凝膠電泳圖
Fig.1 The electrophoresis of PCR product of four cellulose-degrading strains
2.5 單因素試驗以及響應面對菌種配比的優化結果
2.5.1單因素試驗結果
當赫奇遜氏無機鹽培養基中秸稈纖維素添加量為2.0 g,對所分離到的4株耐鹽高效纖維素降解菌進行纖維素降解率測定,各菌株的降解率顯示,經過7 d的培養,不同菌株的降解率差異顯著,WH4降解率最高,WH2降解率最低,菌種WH2、WH4、WH7和WH9的最佳添加量分別是0.3、0.2、0.3和0.2 g時有最高降解率,玉米秸稈纖維素的降解率分別達到了34.2%、45.4%、36.9%和39.8%。圖2
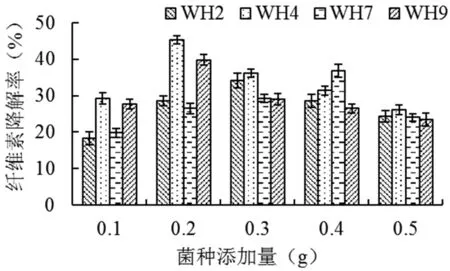
圖2 4株降解菌單因素試驗效果
Fig.2 Effect of Single Factor Test of four cellulose-degrading strains
2.5.2 響應面法試驗設計及結果
利用BBK的中心組合原理設計響應面優化試驗,以高效耐鹽纖維素降解菌WH2、WH4、WH7和WH9添加量為自變量,以玉米秸稈纖維素降解率為響應值,設計四因素三水平的響應面分析試驗。響應面法試驗設計與試驗結果表明,在29組實驗預測數據中,降解率最低為51.32%,降解率最高為61.17%,再用Design-Expert 8.0.5.0軟件對表6試驗結果進行多元擬合的回歸分析。表6
表6 響應面設計與試驗結果
Table 6 Response surface design and results
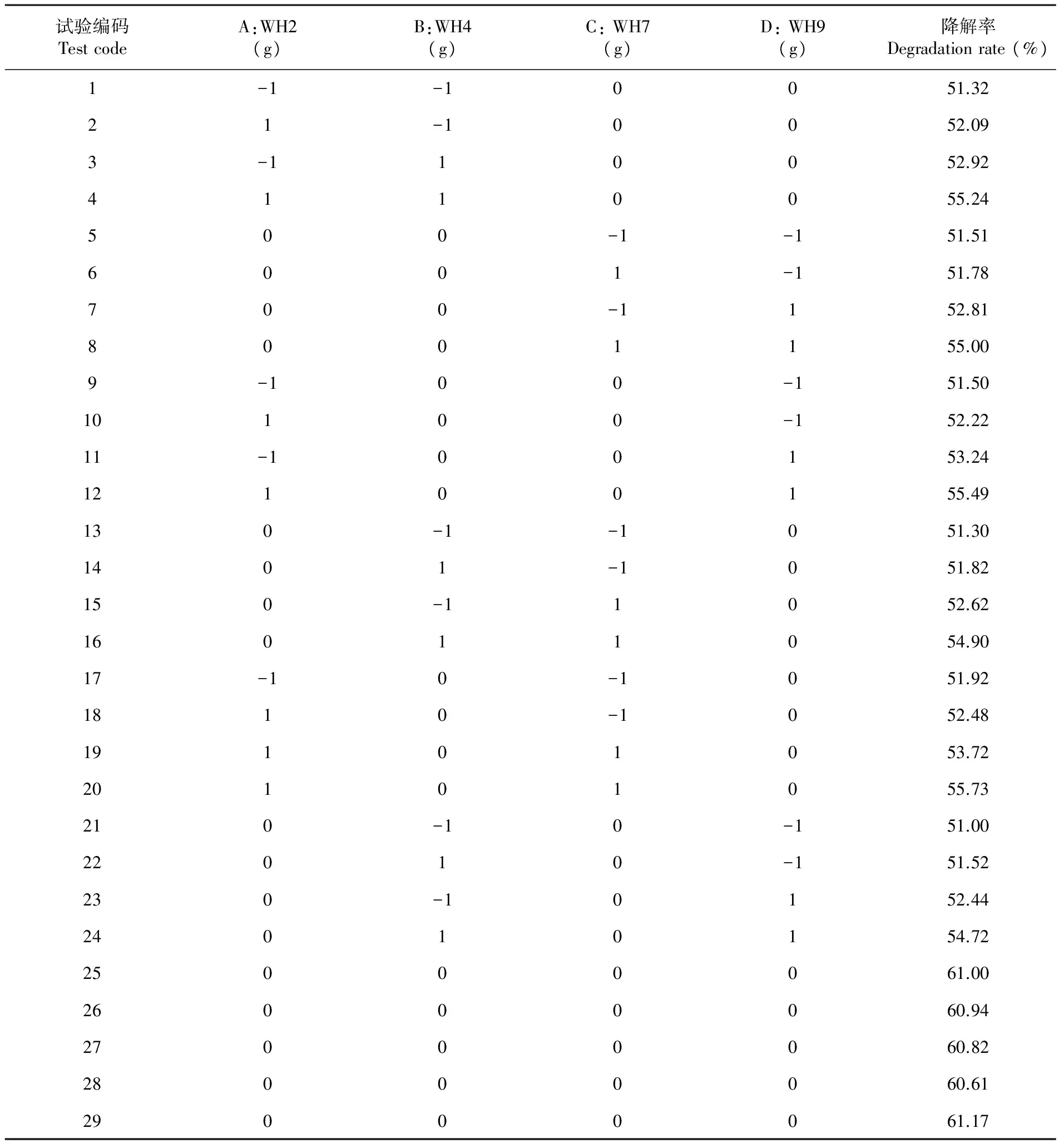
試驗編碼TestcodeA:WH2(g)B:WH4(g)C:WH7(g)D:WH9(g)降解率Degradationrate(%)1-1-10051.3221-10052.093-110052.924110055.24500-1-151.516001-151.78700-1152.818001155.009-100-151.5010100-152.2211-100153.2412100155.49130-1-1051.301401-1051.82150-11052.6216011054.9017-10-1051.921810-1052.4819101053.7220101055.73210-10-151.0022010-151.52230-10152.4424010154.7225000061.0026000060.9427000060.8228000060.6129000061.17
2.5.3 響應面法優化
采用Design-Expert 8.0.5.0軟件對所得數據進行多元回歸擬合,其方差分析結果見表7。對響應值與各個因素進行多元擬合,該模型對應的回歸方程:
為了檢驗方程的有效性,對纖維素降解率的數學模型進行方差分析,結果表明,纖維素降解率的顯著性檢驗F=179.69,該模型效應極顯著(P<0.000 1),表明方程高度顯著。該模型的R2Adj為0.988 9,說明模型能反映98.89%響應值的變化,因而該模型擬合程度較高,能很好的說明纖維素降解率與WH2、WH4、WH7和WH9關系,因此可以用此模型對纖維素降解率進行預測與分析。表7各因素之間存在交互作用,其中一次項A、B、C、D、二次項A2、B2、C2、D2以及交互項BD、CD、BC都是極顯著的。表7
表7 回歸模型方差
Table 7 The variance analysis of regression model
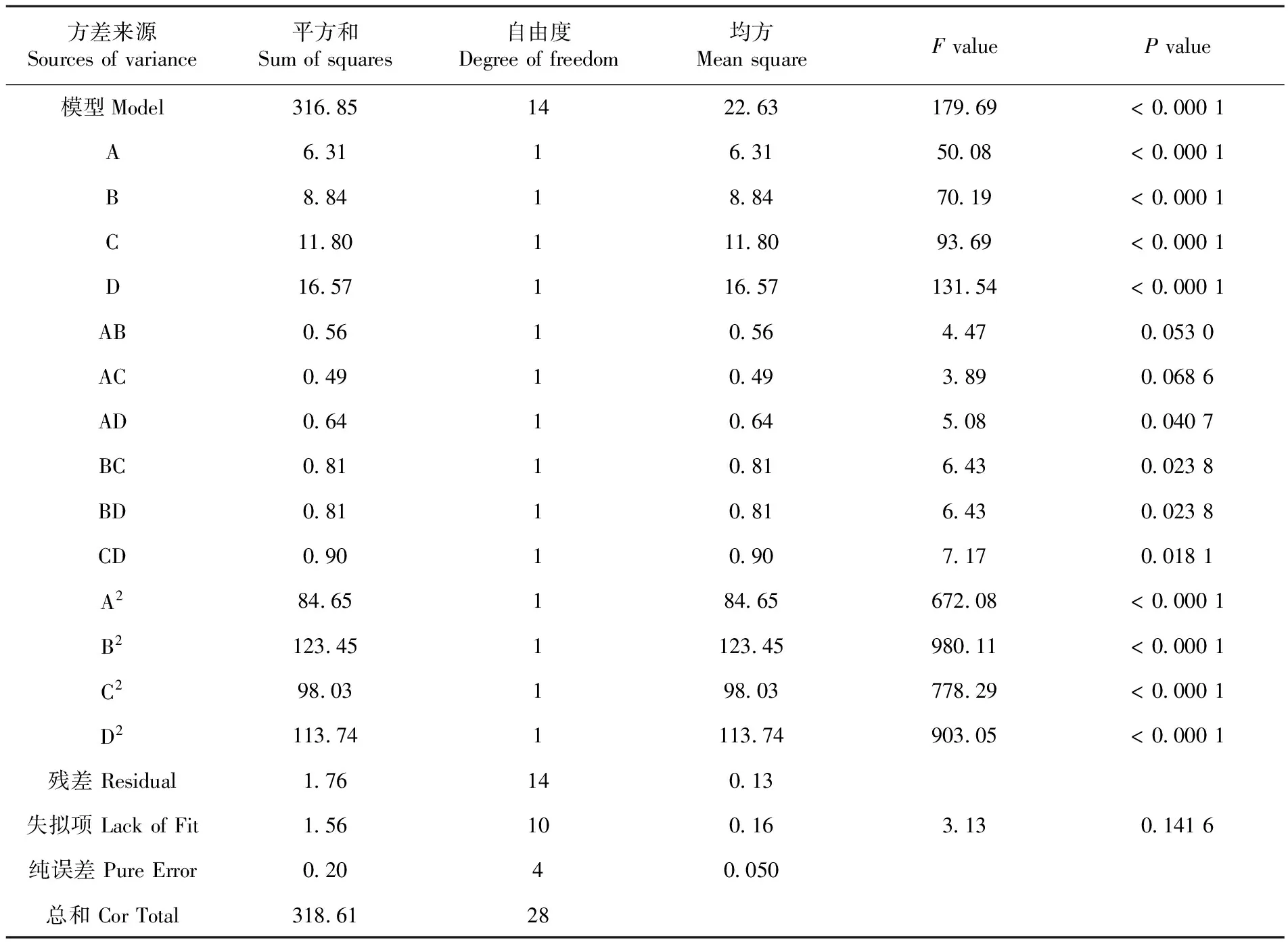
方差來源Sourcesofvariance平方和Sumofsquares自由度Degreeoffreedom均方MeansquareFvaluePvalue模型Model3168514226317969<00001A63116315008<00001B88418847019<00001C1180111809369<00001D16571165713154<00001AB056105644700530AC049104938900686AD064106450800407BC081108164300238BD081108164300238CD090109071700181A284651846567208<00001B21234511234598011<00001C298031980377829<00001D21137411137490305<00001殘差Residual17614013失擬項LackofFit1561001631301416純誤差PureError02040050總和CorTotal3186128
2.5.4 響應面及等高線
研究表明,回歸模型方差分析中P值可知,交互項BD、CD、BC都是極顯著。在圖3中,交互項BD、CD、BC交互關系用等高線圖和響應面曲面圖表示,等高線圖呈橢圓形,響應曲面圖均為開口向下的凸形曲面,說明響應值(纖維素降解率)存在極高值,若曲線越陡峭,則表明該兩因素交互作用對纖維降解率的影響越大,相應表現為響應值變化的大小。表7
對回歸方程就行回歸分析,預測纖維素降解的最佳條件:當纖維素添加量為2.0 g時,菌種WH2、WH4、WH7和WH9接種量分別為0.31、0.21、0.32和0.22 g,在此條件下纖維素降解率的理論值為61.17%,試驗值為60.90%,試驗值與理論值相差0.27%,證明了響應面優化法的有效性和可行性。圖3
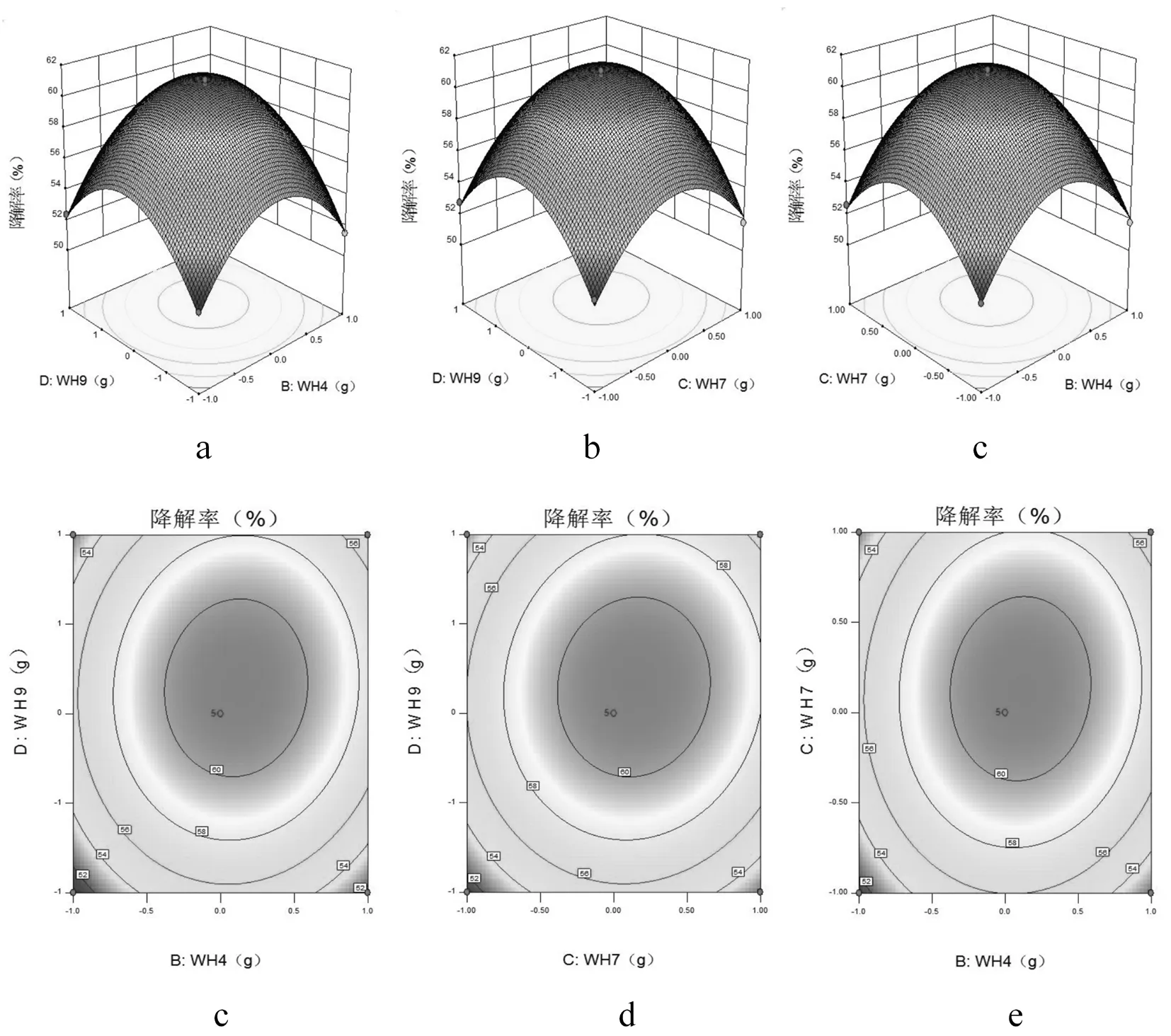
圖3 四因素交互影響的響應面
Fig.3 Response surface and contour plots showing the interactive effects of four factors
3 討 論
自然狀態下的纖維素降解過程十分緩慢,一般通過篩選高效降解菌來提高纖維素的降解效率。劉曉梅等[23]從堆肥的土壤中篩選出一株高效的纖維素降解菌,通過該菌株的添加明顯提高堆肥溫度和纖維素降解速度。由于新疆三分之一土地為鹽堿地,耐鹽菌是該地區具有重要開發價值的微生物資源,耐鹽纖維素降解菌在污染治理、廢水處理、農業生產及再生能源利用等方面應用前景十分廣闊。試驗從鹽堿環境下篩選分離出4株高效耐鹽纖維素降解菌株,對其耐鹽能力和纖維素降解率進行了測定,2株革蘭氏陰性菌耐鹽能力和降解效果普遍高于2株革蘭氏陽性菌。
在秸稈纖維素的降解過程中,混合菌的降解效果往往優于單菌株。馮忻等[24]從土壤中篩選出5株高效的纖維素降解菌,5株高效菌種混合的CMC酶活為3.18 U/mL,顯著高于單菌的酶活。試驗在單因素試驗的基礎上,首次采用響應面法對高效耐鹽纖維素降解菌種的配比進行優化,優化后的復合菌對纖維素的降解效率提升十分明顯。響應面方法具有實驗周期短、實驗次數少和精度高等優點,可快速準確地確定多因素系統的最優條件。
4 結 論
采用連續富集篩選的方法,從玉米秸稈堆肥的鹽堿土壤中得到4株耐鹽高效纖維素降解菌株。經鑒定4株菌分別為蠟樣芽孢桿菌(Bacilluscereus)、熒光假單胞菌(Pseudomonasformosensis)、枯草芽孢桿菌(Bacillussubtilis)和松嫩假單胞菌(Pseudomonassongnenensis)。
實驗獲得最佳工藝條件為:當纖維素添加量為2.0 g,菌種WH2、WH4、WH7和WH9接種量分別為0.31、0.21、0.32和0.22 g時,秸稈纖維素降解率達到最大值,在該條件下纖維素降解率預測值為61.17%,驗證值為60.90%。
)
[1] Rodrigues, A. C., Boroski, M., Shimada, N. S., Garcia, J. C., Nozaki, J., & Hioka, N. (2008). Treatment of paper pulp and paper mill wastewater by coagulation-flocculation followed by heterogeneous photocatalysis.JournalofPhotochemistry&PhotobiologyAChemistry, 194(1):1-10.
[2] Georgakakis, D., & Krintas, T. (2000). Optimal use of the hosoya system in composting poultry manure.BioresourceTechnology, 72(3): 227-233.
[3] 陳子愛,鄧小晨. 微生物處理利用秸桿的研究進展 [J].中國沼氣,2006,24(3):31-35.
CHEN Zi-ai,DENG Xiao-chen. (2006). Progress in microbiologic utilization of crop straw [J].Chinabiogas,24(3):31-35. (in Chinese)
[4] 李平,王焰新,劉琨,等. 高效纖維素降解菌系的構建 [J].地球科學(中國地質大學學報),2009,(3):533-538.
LI Ping,WANG Yan-xin,LIU Kun,et al. (2009). Construction of A Microbial System or Efficient Degradation of Cellulose [J].Chinabiogas,(3):533-538. (in Chinese)
[5] Petersson, L., Kvien, I., & Oksman, K. (2007). Structure and thermal properties of poly(lactic acid)/cellulose whiskers nanocomposite materials.CompositesScience&Technology, 67(11-12): 2,535-2,544.
[6] 李燕紅,趙輔昆. 纖維素的研究進展 [J].生命科學,2005,17(5):392-397.
LI Yan-hong,ZHAO Fu-kun. (2005). Research progress of cellulose [J].ChineseBulletinofLifeScience,17(5):392-397. (in Chinese)
[7] 李爭明,張娟,鄧中洋,等. 纖維素酶產生菌的篩選、鑒定及發酵產酶條件優化 [J].生物技術通報,2015,31(5):146-152.
LI Zheng-ming,ZHANG Juan,DENG Zhong-yang,et al. (2015). Screening,Identification and Optimization of Cellulase-producing Strains [J].BiotechnologyBulletin,31(5):146-152. (in Chinese)
[8] 陳興,王文元,汪顯國,等. 煙葉纖維素降解菌的篩選、鑒定及其產酶條件優化 [J].云南大學學報,2015,37(2):323-328.
CHEN Xing,WANG Wen-yuan,WANG Xian-guo,et al. (2015). Screening,identification of cellulose-decomposing strain from aging flue-cured tobacco leaves and optimization of its fermentation condition [J].JournalofYunnanUniversity,37(2):323-328. (in Chinese)
[9] 張麗萍,李亞冰,程輝彩,等. 一株兼性厭氧纖維素酶產生菌的篩選、鑒定及其酶學性質研究 [J].華北農學報,2010,25(6):139-143.
ZHANG Li-ping,LI Ya-bing,CHENG Hui-cai,et al. (2010). Screening and Identification of a Facultative Anaerobic Cellulase-producing Strain and Characterization of Cellulase [J].ActaAgriculturaeBoreali-Sinica,25(6):139-143. (in Chinese)
[10] 盧月霞,陳凱,李海江.一株纖維素降解細菌的篩選及產酶條件研究 [J].安徽農業科學,2007,35(12):3 631-3 644.
LU Yue-xia,CHEN Kai,LI Hai-jiang. (2007). Screening of Cellulose-degrading Bacteria and Study on its Cellulose producing Condition [J].JournalofAnhuiAgriculturalSciences,35(12):3,631-3,644. (in Chinese)
[11] Haruta, S., Cui, Z., Huang, Z., Li, M., Ishii, M., & Igarashi, Y. (2002). Construction of a s
Table microbial community with high cellulose-degradation ability.AppliedMicrobiology&Biotechnology, 59(4-5): 529-534.
[12] 吳俊妹,馬安周,崔萌萌,等.降解纖維素產甲烷的四菌復合系 [J].環境科學,2014,35(1):327-333.
WU Jun-mei,MA An-zhou,CUI Meng-meng,et al. (2014). Screening of Cellulose-degrading Bacteria and Study on its Cellulose producing Condition [J].EnvironmentalScience,35(1):327-333. (in Chinese)
[13] 王旭輝,晁群芳,徐鑫,等. 高效石油降解菌的篩選、鑒定及其配比優化的研究 [J].工業安全與環保,2013,2(10):42-46.
WANG Xu-hui,CHAO Qun-fang,XU Xin,et al. (2013). Bioconversion of Cellulose to Methane by a Consortium Consisting of Four Microbial Strains [J].IndustrialSafetyandEnvironmentalProtection,2(10):42-46.(in Chinese)
[14] 孔雅麗,賈輝,王生榮,等.一株東祁連山耐低溫纖維素降解菌株的分離、鑒定及產酶特性[J].工業微生物,2014,44 (1) :60-66.
KONG Ya-li,JIA Hui,WANG Sheng-rong,et al. (2014). Isolation,identification and characterization of a cold-adapted cellulose degrading strain from eastern Qilian mountains industrial microbiology [J].IndustrialMicrobiology,44 (1): 60-66(in Chinese)
[15] 王平宇,張樹華.硅酸鹽細菌的分離及生理生化特性的鑒定 [J].南昌航空工業學院學報,2001,15(2):78-81.
WANG Ping-yu,ZHANG Shu-hua.(2001). Study on the Isolation Sillicate Bacteria and Its Identification of Biochemical Characteristics [J].JournalofNanchangInstituteofAeronauticalTechnology,15 (2):78-81.(in Chinese)
[16] 東秀珠,蔡妙英.常見細菌鑒定手冊 [K].北京:科學出版社,2001.
DONG Xiu-zhu,CAI Miao-ying. (2001).Commonbacterialidentificationmanual[K]. Beijing: Science Press.(in Chinese)
[17] 王玉萬,徐文玉. 木質纖維素固體基質發酵物中半纖維素、纖維素和木素的定量分析程序 [J].微生物學通報,1987,14 (2):35-38.
WANG Yu-wan,XU Wen-yu. (1987). Quantitative Analysis of Hemicellulose,Cellulose and Lignin in Lignocellulose Solid Substrate Fermentation [J].MicrobiologyChina,14 (2):35-38. (in Chinese)
[18] 李華,孔新剛,王俊. 秸稈飼料中纖維素、半纖維素和木質素的定量分析研究 [J]. 新疆農業大學學報,2007,30 (3):65-68.
LI Hua,KONG Xin-gang,WANG Jun. (2007). Study on Quantitative Analysis of Hemicellulose and Cellulose and Lignin in Roughage of Cereal Straw [J].JournalofXinjiangAgriculturalUniversity,30(3): 65-68. (in Chinese)
[19] 薛惠琴,杭怡瓊,陳誼.稻草秸稈中木質素、纖維素測定方法的研討[J]. 上海畜牧獸醫通訊,2001,(2):15.
XUE Hui-qin,HANG Yi-qiong,CHEN Yi. (2001). Study on Determination Method of Lignin and Cellulose in Straw [J].ShanghaiJournalofAnimalHusbandryandVeterinaryMedicine,(2):15. (in Chinese)
[20] Box, G. E. P., & Behnken, D. W. (1960). Some new three level designs for the study of quantitative variables.Technometrics, 2(4): 455-475.
[21] Annadurai, G., & Sheeja, R. Y. (1998). Use of box-behnken design of experiments for the adsorption of verofix red using biopolymer.BioprocessEngineering, 18(6): 463-466.
[22] 林標聲,張彭湃,楊生玉,等. 響應面分析法優化丙酮酸發酵中維生素水平 [J].食品科技,2007,(4):36-39.
LIN Biao-sheng,ZHANG Peng-pai,YANG Sheng-yu,et al. (2007). Application of Response Surface method to optimization of vitamin in levels on the fermentation of pyruvic acid [J].FoodScienceandTechnology,(4):36-39.(in Chinese)
[23] 劉曉梅,鄒亞杰,胡清秀,等. 菌渣纖維素降解菌的篩選與鑒定 [J].農業環境科學學報,2015,34(7):1 384-1 391.
LIU Xiao-mei,ZOU Ya-jie,HU Qing-xiu,et al. (2015). Screening and Identification of Cellulose-Degrading Bacteria from Spent Substrate of Edible Mushroom [J].JournalofAgro-EnvironmentSciencey,34(7): 1,384-1,391.(in Chinese)
[24] 馮忻,裴宇航,周曉飛,等. 纖維素降解菌的篩選與高效混合菌群的構建 [J].西北農林科技大學學報,2012,25 (4) :30-32.
FENG Xin,PEI Yu-hang,ZHOU Xiao-fei,et al. (2012). Screening of stalk cellulose-degrading microorganism and construction of microbial community with high capacity [J].JournalofNorthwestA&FUniversity(NaturalScienceEdition) ,25(4):30-32. (in Chinese)

