中藥復(fù)方多糖對(duì)不同MHC B-LβII基因型雞淋巴細(xì)胞IL-2、IL-4、IL-12 mRNA表達(dá)量的影響
馬 昭,連科訊,劉 鋼,劉曉婷,喬嚴(yán)杰,朱曉慶,谷新利
(石河子大學(xué)動(dòng)物科技學(xué)院,新疆石河子 832003)
0 引 言
【研究意義】中藥是我國(guó)的傳統(tǒng)藥物,它資源豐富、歷史悠久,與西藥相比具有毒副作用小,低殘留,不易產(chǎn)生耐藥等優(yōu)點(diǎn),是醫(yī)藥學(xué)研究的熱點(diǎn)。隨著中藥藥理學(xué)、遺傳學(xué)、免疫學(xué)的相互滲透,人們對(duì)中藥與機(jī)體免疫調(diào)節(jié)作用的研究愈加深入,發(fā)現(xiàn)中草藥中的多種提取物可以參與機(jī)體免疫調(diào)節(jié)。中藥多糖是一種從中草藥中提取出的具有提高機(jī)體免疫力,抗病毒,抗氧化等多種作用的生物活性物質(zhì)之一,它能夠通過(guò)激活T、B 淋巴細(xì)胞和巨噬細(xì)胞等免疫細(xì)胞,促進(jìn)細(xì)胞因子的生成,激活補(bǔ)體系統(tǒng)等方式調(diào)節(jié)機(jī)體免疫系統(tǒng),進(jìn)而發(fā)揮免疫調(diào)節(jié)作用。并且中藥多糖的免疫調(diào)節(jié)作用受劑量的影響,即中藥多糖的免疫增強(qiáng)作用有其最適劑量[1-3]。【前人研究進(jìn)展】細(xì)胞表面存在著與免疫排斥有關(guān)的組織抗原,稱為組織相容性抗原(histocompatibility antigen),而編碼組織相容性抗原的是具有高度多態(tài)性的基因群,稱為主要組織相容性復(fù)合體(major histocompatibility complex,MHC)。MHC編碼的蛋白與免疫識(shí)別、免疫應(yīng)答有關(guān),因此MHC在某種程度上決定動(dòng)物個(gè)體對(duì)疾病的易感性,在適應(yīng)性免疫應(yīng)答中起著非常重要的作用。Shanaz等[4]應(yīng)用PCR-SSCP方法對(duì)Bantam、BWLH和WLH 3個(gè)雞種的MHCB-LβII多態(tài)性與免疫應(yīng)答相關(guān)性進(jìn)行研究,發(fā)現(xiàn)B-Lβ II基因的等位基因B15和B19單倍體雞ND和SRBC抗體滴度均顯著高于其他單倍體,是優(yōu)勢(shì)基因型。朱曉慶等[5]研究發(fā)現(xiàn),一定純度中藥復(fù)方多糖的免疫調(diào)節(jié)劑量的篩選會(huì)受MHCB-LβII基因Hin1I位點(diǎn)多態(tài)性的影響,且一定純度中藥復(fù)方多糖對(duì)不同MHCB-LβII基因型雞的最適免疫調(diào)節(jié)劑量不同。【本研究切入點(diǎn)】MHC II類分子不僅被CD4 T細(xì)胞識(shí)別,是CD4 T識(shí)別的靶分子,而且參與外源性抗原呈遞、免疫應(yīng)答和免疫調(diào)節(jié)。不同個(gè)體間由于MHC II基因多態(tài)性使得MHC II 類分子接納與提呈抗原具有一定的選擇性,導(dǎo)致不同個(gè)體對(duì)同一抗原表現(xiàn)出免疫應(yīng)答強(qiáng)弱的差異。【擬解決的關(guān)鍵問(wèn)題】試驗(yàn)從細(xì)胞分子水平擬排除MHCB-LβII多態(tài)性而導(dǎo)致的不同基因型機(jī)體免疫應(yīng)答能力不同的影響,篩選出能顯著增強(qiáng)與雞免疫功能相關(guān)的各MHCB-LβII基因型雞免疫的中藥復(fù)方多糖的最佳劑量。
1 材料與方法
1.1 材 料
1.1.1 藥物
中藥復(fù)方多糖由黨參、山楂、熟地、何首烏、當(dāng)歸、茯苓、補(bǔ)骨脂等11味中藥組成,各單味藥均購(gòu)自石河子市醫(yī)藥公司;中藥復(fù)方多糖粗提取物是從中藥復(fù)方中采用水提-醇沉法提取,再經(jīng)AB-8大孔吸附樹(shù)脂吸附解吸附后獲得精制的中藥復(fù)方多糖,即cCHMPS,其純度為77.10%;用不含血清的RPMI-1640培養(yǎng)液將其配置成200、150、100 μg/mL的cCHMPS,經(jīng)0.22 μm微孔濾膜濾過(guò)后4℃儲(chǔ)存?zhèn)溆谩?/p>
1.1.2 試劑與儀器
雞外周血淋巴細(xì)胞分離液(天津市灝洋生物制品科技有限責(zé)任公司產(chǎn)品);RPMI 1640培養(yǎng)基,PBS磷酸緩沖液,胎牛血清,SYBR Green熒光染料,RT-PCR試劑(北京全式金生物技術(shù)有限公司產(chǎn)品);DEPC(上海生物工程公司產(chǎn)品);雞新城疫疫苗(La Sota株,普萊柯生物工程股份有限公司產(chǎn)品);TaqDNA聚合酶,RNA、DNA提取試劑盒,膠回收試劑盒,RNAprep Pure Cell/Bacteria k-it(北京田根生物工程有限公司產(chǎn)品);高速冷凍離心機(jī),垂直離心機(jī)。
1.2 方 法
1.2.1 DNA的提取
500羽1日齡京紅1號(hào)蛋雞,購(gòu)自新疆昌吉某一孵化場(chǎng)。翅下靜脈采血0.2 mL/羽,置于肝素鈉抗凝采血管中搖勻,-20℃冷凍保存。按DNA提取試劑盒的操作說(shuō)明書(shū)提取雞全血DNA,4℃冰箱保存?zhèn)溆谩?/p>
1.2.2 引物設(shè)計(jì)
根據(jù)GenBank中收錄的雞MHC B-LβⅡ基因序列(NO.M29763.1),應(yīng)用Oligo軟件設(shè)計(jì)引物,引物序列為:上游引物:5’-AAACCGACCGTCTGGCGTGCTA-3’,下游引物:5’-TTACCCCACGCCTGGCTGAT-3’,擴(kuò)增片段238 bp,引物由華大基因科技股份有限公司合成。
1.2.3 PCR擴(kuò)增
PCR擴(kuò)增體系為20 μL:10 μL 的2×RCRMix,2 μL模板DNA,上下游引物各0.5 μL,7μL ddH2O,總體積為20 μL。PCR反應(yīng)條件:95℃預(yù)變性5 min;94℃變性40 s,60.5℃退火45 s,72℃延伸35 s,共35個(gè)循環(huán);72℃延伸10 min;4℃保存。取5 μL PCR 擴(kuò)增產(chǎn)物在2 %瓊脂糖凝膠電泳檢測(cè),凝膠成像系統(tǒng)觀察并拍照。
1.2.4 淋巴細(xì)胞的分離與成活率檢測(cè)
根據(jù)PCR-SSCP基因型分型結(jié)果將雞進(jìn)行分組,然后靜脈采集血液參照文獻(xiàn)謝昆等[6]提取淋巴細(xì)胞,用胎盤藍(lán)染色,在顯微鏡下數(shù)出死細(xì)胞和活細(xì)胞個(gè)數(shù),計(jì)算活細(xì)胞的成活率。
1.2.5 試驗(yàn)分組與細(xì)胞培養(yǎng)
用含20%的胎牛血清的培養(yǎng)液將分離得到的淋巴細(xì)胞調(diào)整為5×106個(gè)/mL。試驗(yàn)按不同基因型分組,每組設(shè)3個(gè)劑量組,每個(gè)培養(yǎng)皿加入1 mL細(xì)胞培養(yǎng)液,然后加入不同濃度的cCHMPS,使終濃度分別達(dá)到100、75、50、0 μg/mL。將培養(yǎng)皿置于37℃、5%的CO2的恒溫培養(yǎng)箱中共培養(yǎng)24 h后收集細(xì)胞。
1.2.6 雞淋巴細(xì)胞總RNA提取
收集淋巴細(xì)胞,按照RNA提取試劑盒說(shuō)明書(shū)提取淋巴細(xì)胞的總RNA。RNA純度檢測(cè):檢測(cè)其D260 nm/D280 nm比值,其比值在1.8~2.0。
1.2.7 RNA反轉(zhuǎn)錄
將2 μL 5×gDNA Graser Buffer、1 μL gDNA Eraser、5 μL RNase Free Water、2 μL RNA模板混勻,42℃反應(yīng)2 min,迅速冰浴,即反應(yīng)液Ⅰ,最后將1 μL Prime Scriptrt MIXⅠ、1 μL RT Primer MIX、4 μL 5×Primscript buffer、4 μL RNase Free Water加入反應(yīng)液Ⅰ中,37℃反應(yīng)15 min,85℃加熱5 s使反轉(zhuǎn)錄酶失活,取出EP管,-20℃貯存?zhèn)溆谩?/p>
1.2.8 cDNA的PCR反應(yīng)體系與程序
IL-2、IL-4、IL-12及β-Actin基因的引物設(shè)計(jì)與合成:根據(jù)GenBank報(bào)道的IL-2、IL-4、IL-12及β-Actin基因mRNA的全長(zhǎng)序列設(shè)計(jì)RCR特異性引物,由上海捷瑞生物工程有限公司合成,引物序列見(jiàn)表1。
表1 目的基因引物序列及PCR條件
Table 1 Conditions of PCR and parameters of oligonucleotide primer pair

目的基因Targetgene登錄號(hào)GenBankNo產(chǎn)物Products引物序列(5′→3)Sequenceofprimer(5′→3)退火溫度AnnealingtemperatureIL-2GU_119890.1188bpF:CACACCAACTGAGACCTGR:TCTTGCATTCACTTCCGGTGT58℃IL-4GU_119892.1382bpF:AACATGCGTCAGCTCCTGAAR:CCATTGAAGTAGTGTTGCCTGCT60℃IL-12NM_213571.1133bpF:GAGTGGAACGATGAGACACCAGR:CCTTCACTTCGGTGGTCAGAG58℃β-ActinNM_205518.1100bpF:ACCGCAAATGCTTCTAAACCR:ATAAAGCCATGCCAATCTCG59℃
cDNA的PCR反應(yīng)體系:1 μL cDNA模板,上游引物和下游引物各0.5 μL,8 μL ddH2O,10 μL 的2×RCRMix,總體積為20 μL。PCR反應(yīng)條件:94℃預(yù)變性5 min;94℃變性30 s,退火30 s,72℃延伸30 s,共35個(gè)循環(huán);72℃延伸10 min;4℃保存。
1.2.9 實(shí)時(shí)熒光定量PCR
熒光定量PCR反應(yīng)體系:2×TransStart?Tip Green qPCR SuperMIX 10 μL,上下游引物各0.5 μL,1 μL cDNA,8 uL ddH2O,20 μL體系。反應(yīng)程序?yàn)椋?4℃預(yù)變性30 s;94℃變性5 s;退火15 s,72℃延伸10 s,共42個(gè)循環(huán)。
1.3 數(shù)據(jù)處理
用 2 -△△ Ct法計(jì)算目的基因IL-2、IL-4、IL-12 mRNA的相對(duì)表達(dá)量。所有數(shù)據(jù)結(jié)果以均數(shù)±標(biāo)準(zhǔn)差( x±SD)表示。用 SPSS 17.0 軟件分析,計(jì)量資料采用t檢驗(yàn),所有統(tǒng)計(jì)分析結(jié)果以P<0.05 作為差異顯著性的判斷標(biāo)準(zhǔn),并且將對(duì)照組的mRNA的相對(duì)表達(dá)量設(shè)置為1。
2 結(jié)果與分析
2.1 MHC B-LβII基因PCR擴(kuò)增結(jié)果
用所設(shè)計(jì)的引物對(duì)基因組DNA進(jìn)行擴(kuò)增,取所得PCR產(chǎn)物5 μL于的瓊脂糖凝膠上進(jìn)行電泳,擴(kuò)增產(chǎn)物檢測(cè)結(jié)果為,所設(shè)計(jì)引物的擴(kuò)增結(jié)果較好,片段長(zhǎng)度與預(yù)期大小一致,條帶清晰,無(wú)非特異性條帶,可直接進(jìn)行SSCP分析。圖1
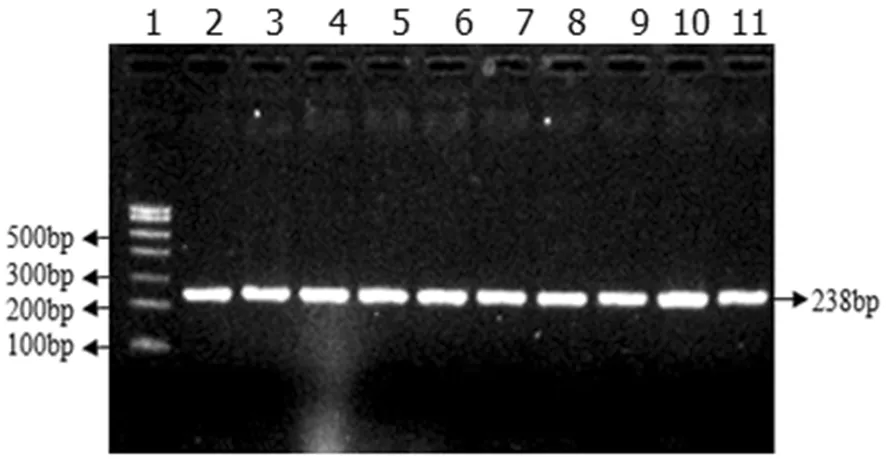
1:DNA Maker I, 2-11:MHC B-LβII基因(MHC B-LβII Gene)
圖1 MHC B-LβII基因PCR擴(kuò)增結(jié)果
Fig.1 The PCR amplification results of MHC B-L II gene
2.2 PCR-SSCP
對(duì)所有DNA樣本的PCR產(chǎn)物進(jìn)行SSCP多態(tài)性檢測(cè),發(fā)現(xiàn)所擴(kuò)增片段有3種基因型,分別定義為AA (103羽)、BB(266羽)和BC(131羽)。圖2
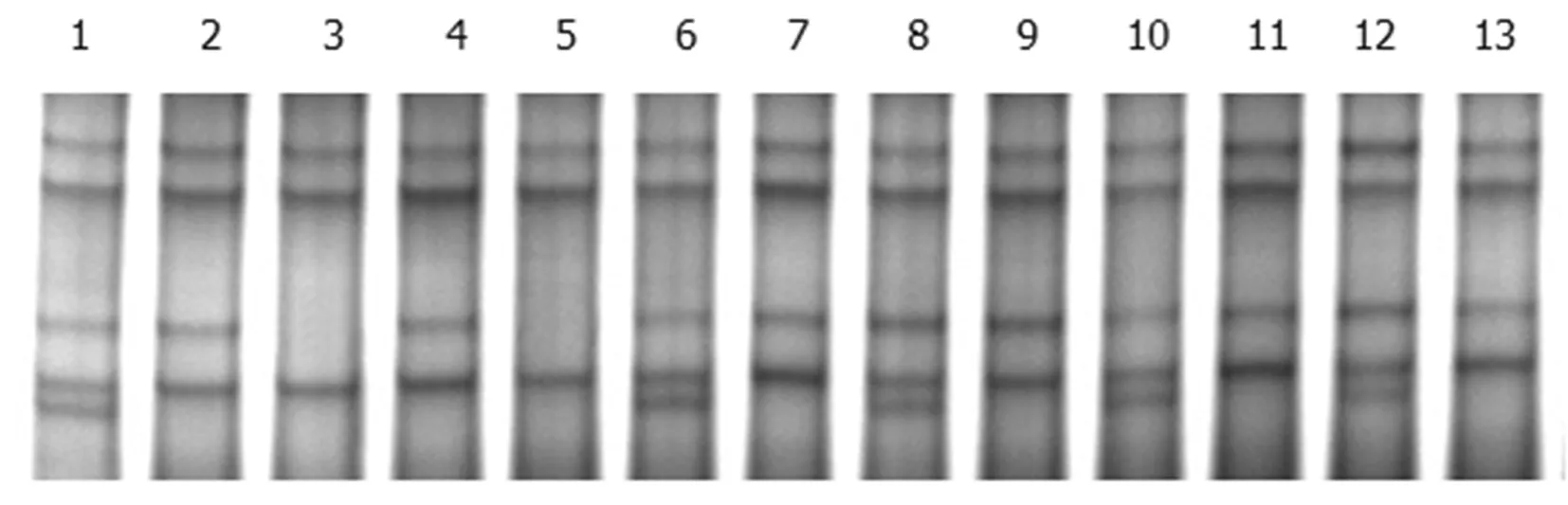
注:1、6、8、10、12:BC基因型;3、5:AA基因型;2、4、7、9、11、13:BB基因型
Note: 1、6、8、10、12:BC genotype; 3、5:AA genotype; 2、4、7、9、11、13:BB genotype
圖2 部分雞MHC B-LβII基因PCR-SSCP電泳圖譜
Fig.2 Electrophoretic patterns of the PCR-SSCP product of MHC B-LβII gene
2.3 IL-2、IL-4、IL-12及β-Actin擴(kuò)增結(jié)果
用所設(shè)計(jì)的雞IL-2、IL-4、IL-12及β-Actin 基因的引物,以 cDNA 為模板進(jìn)行 PCR擴(kuò)增,經(jīng)2%瓊脂糖凝膠電泳檢測(cè),分別獲得了188、382和133 bp的目的條帶。圖3
2.4 中藥復(fù)方多糖對(duì)不同MHC B-LβII基因型雞外周血淋巴細(xì)胞中IL-2 mRNA表達(dá)量
研究表明,與對(duì)照組相比,cCHMPS能顯著促進(jìn)雞淋巴細(xì)胞IL-2 mRNA的表達(dá),且在不同基因型雞中,最有效提高IL-2 mRNA表達(dá)量所需的cCHMPS劑量不同。AA基因型雞中,cCHMPS劑量為75、50 μg/mL時(shí),雞淋巴細(xì)胞IL-2 mRNA表達(dá)量顯著高于其他劑量組(P<0.05);BB基因型雞中,cCHMPS劑量為100 μg/mL時(shí)雞淋巴細(xì)胞 IL-2 mRNA表達(dá)量均顯著高于其他劑量組(P<0.05);BC基因型雞中,cCHMPS劑量為50 μg/mL時(shí),IL-2 mRNA表達(dá)量均顯著高于其他劑量組(P<0.05)。表2
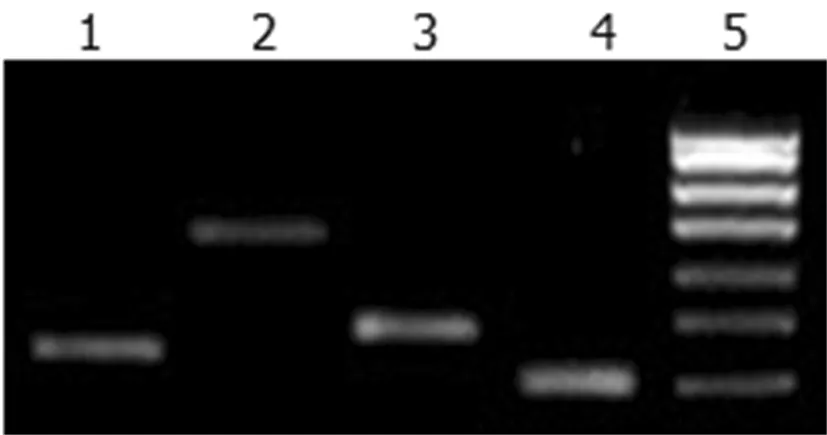
1: IL-12基因(IL-12 gene);2:IL-4基因(IL-4 gene);3:IL-2基因(IL-2 gene);4:內(nèi)參(β-Actin gene);5:Maker
圖3 IL-2、IL-4、IL-12及β-Actin凝膠電泳圖
Fig.3 Electrophoretic patterns of the PCR product of IL-2、IL-4、IL-12 and β-Actingene表2 中藥復(fù)方多糖對(duì)各基因型雞淋巴細(xì)胞IL-2 mRNA表達(dá)
Table 2 Effect of traditional Chinese medicine compound polysaccharide of each genotype chicken IL-2 mRNA expression level
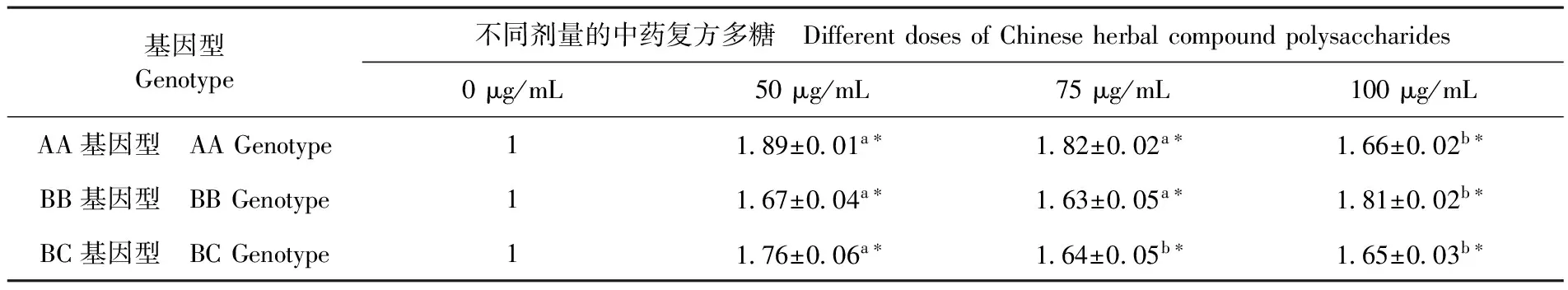
基因型Genotype不同劑量的中藥復(fù)方多糖 DifferentdosesofChineseherbalcompoundpolysaccharides0μg/mL50μg/mL75μg/mL100μg/mLAA基因型 AAGenotype1189±001a?182±002a?166±002b?BB基因型 BBGenotype1167±004a?163±005a?181±002b?BC基因型 BCGenotype1176±006a?164±005b?165±003b?
注:同行肩注小寫的字母表示同一基因型組不同cCHMPS劑量間的比較,肩注相同小寫字母差異不顯著(P>0.05),肩注不同小寫字母表示差異顯著(P<0.05),cCHMPS與對(duì)照組比較用*表示顯著性差異(P<0.05),下同
Notes : Comparison of cCHMPS doses between the same genotype groups, Shoulder note same, lowercase letters are not significant difference(P>0.05), and different weight letters indicate significant difference(P<0.05). The difference between cCHMPS and control group was marked by*.The same as below
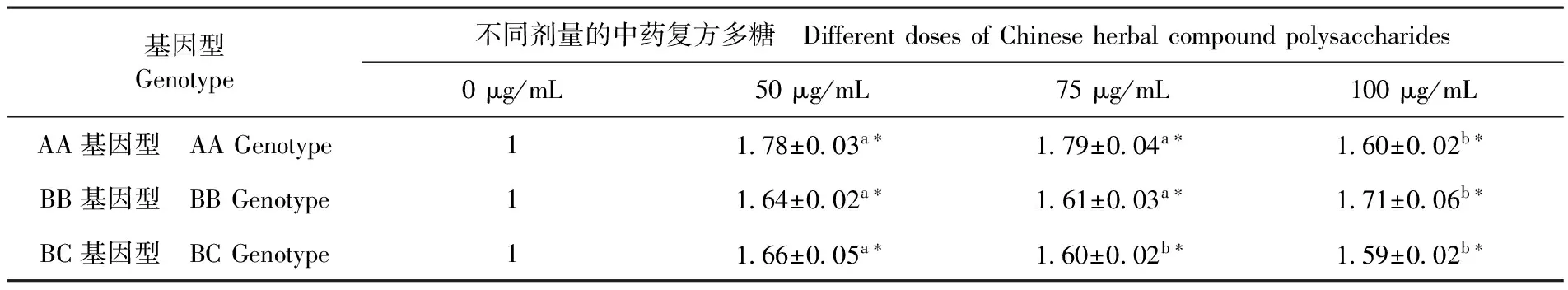
2.5 中藥復(fù)方多糖對(duì)不同MHC B-LβII基因型雞外周血淋巴細(xì)胞中IL-4 mRNA表達(dá)量
研究表明,與對(duì)照組相比,cCHMPS能顯著促進(jìn)雞淋巴細(xì)胞IL-4 mRNA的表達(dá),且在不同基因型雞中,最有效的提高IL-4 mRNA表達(dá)量所需的cCHMPS劑量不同。AA基因型雞中,cCHMPS劑量為75、50 μg/mL時(shí),雞淋巴細(xì)胞IL-4 mRNA表達(dá)量顯著高于其他劑量組(P<0.05);BB基因型雞中,cCHMPS劑量為100 μg/mL時(shí)雞淋巴細(xì)胞 IL-4 mRNA表達(dá)量均顯著高于其他劑量組(P<0.05);BC基因型雞中,cCHMPS劑量為50 μg/mL時(shí),IL-4 mRNA表達(dá)量均顯著高于其他劑量組(P<0.05)。表3
表3 中藥復(fù)方多糖對(duì)各基因型雞淋巴細(xì)胞IL-4 mRNA表達(dá)
Table 3 Effect of traditional Chinese medicine compound polysaccharide of each genotype chicken IL-4 mRNA expression level
基因型Genotype不同劑量的中藥復(fù)方多糖 DifferentdosesofChineseherbalcompoundpolysaccharides0μg/mL50μg/mL75μg/mL100μg/mLAA基因型 AAGenotype1178±003a?179±004a?160±002b?BB基因型 BBGenotype1164±002a?161±003a?171±006b?BC基因型 BCGenotype1166±005a?160±002b?159±002b?
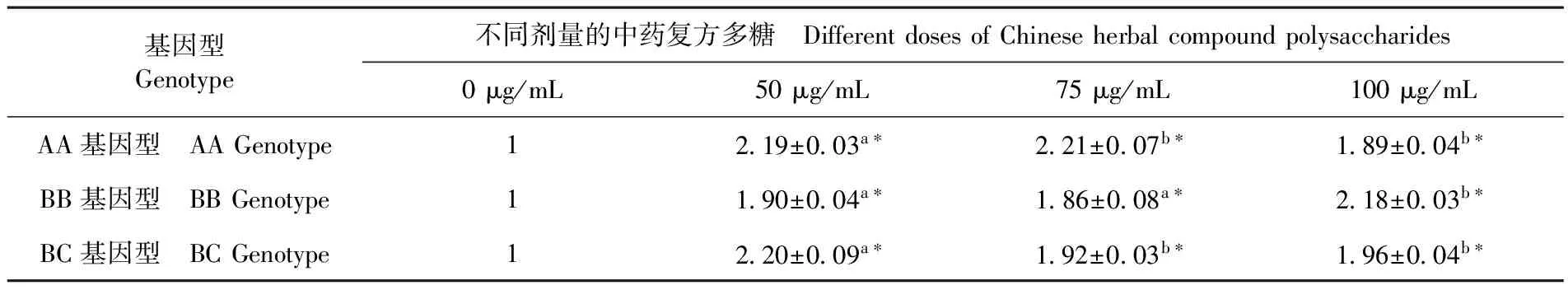
2.6 中藥復(fù)方多糖對(duì)不同MHC B-LβII基因型雞外周血淋巴細(xì)胞中IL-12 mRNA表達(dá)量
研究表明,與對(duì)照組相比,cCHMPS能顯著促進(jìn)雞淋巴細(xì)胞IL-12 mRNA的表達(dá),且在不同基因型雞中,最有效的提高IL-12 mRNA表達(dá)量所需的cCHMPS劑量不同。AA基因型雞中,cCHMPS劑量為75、50 μg/mL時(shí),雞淋巴細(xì)胞IL-12 mRNA表達(dá)量顯著高于其他劑量組(P<0.05);BB基因型雞中,cCHMPS劑量為100 μg/mL時(shí)雞淋巴細(xì)胞 IL-12 mRNA表達(dá)量均顯著高于其他劑量組(P<0.05);BC基因型雞中,cCHMPS劑量為50 μg/mL時(shí),IL-12 mRNA表達(dá)量均顯著高于其他劑量組(P<0.05)。表4
表4 中藥復(fù)方多糖對(duì)各基因型雞淋巴細(xì)胞IL-12 mRNA表達(dá)
Table 4 Effect of traditional Chinese medicine compound polysaccharide of each genotype chicken IL-12 mRNA expression level
基因型Genotype不同劑量的中藥復(fù)方多糖 DifferentdosesofChineseherbalcompoundpolysaccharides0μg/mL50μg/mL75μg/mL100μg/mLAA基因型 AAGenotype1219±003a?221±007b?189±004b?BB基因型 BBGenotype1190±004a?186±008a?218±003b?BC基因型 BCGenotype1220±009a?192±003b?196±004b?
3 討 論
3.1 中藥復(fù)方多糖對(duì)雞淋巴細(xì)胞IL-2、IL-4、IL-12 mRNA表達(dá)量的影響
機(jī)體淋巴細(xì)胞在免疫應(yīng)答中起著關(guān)鍵的作用[7]。淋巴細(xì)胞分泌的細(xì)胞因子是天然的免疫調(diào)節(jié)劑,是介導(dǎo)和調(diào)節(jié)免疫、炎癥反應(yīng)的一類細(xì)胞小分子糖蛋白,可以使靶細(xì)胞進(jìn)行分化和增殖,進(jìn)一步增強(qiáng)抗疾病的能力,參與調(diào)節(jié)機(jī)體的炎癥反應(yīng)以及免疫應(yīng)答[8]。研究細(xì)胞因子有助于了解機(jī)體的免疫調(diào)節(jié)機(jī)制,近年研究發(fā)現(xiàn)中藥多糖可以促進(jìn)細(xì)胞因子分泌,其中IL-2、IL-4、IL-12等細(xì)胞因子在免疫應(yīng)答中也充當(dāng)著十分重要的角色。IL-2、IL-4、IL-12主要由淋巴細(xì)胞產(chǎn)生,在細(xì)胞生長(zhǎng)分化和機(jī)體免疫調(diào)節(jié)作用中發(fā)揮著各自特有的作用。IL-2、IL-12是Th1細(xì)胞分泌的,激活巨噬細(xì)胞,通過(guò)調(diào)節(jié)巨噬細(xì)胞MHC II分子的表達(dá),進(jìn)而促進(jìn)Th細(xì)胞分化為Th1細(xì)胞,最終增強(qiáng)機(jī)體的特異性免疫。IL-2不僅促進(jìn)T、B淋巴細(xì)胞增生與分化產(chǎn)生抗體,而且在獲得性免疫和機(jī)體天然免疫的發(fā)生與維持中發(fā)揮著重要作用[9-10]。此外,研究表明雞IL-2蛋白可以作為免疫增強(qiáng)佐劑[11]。IL-4由Th2細(xì)胞分泌,可以抑制Th1細(xì)胞活化的能力,同時(shí)是IgE的誘導(dǎo)劑。IL-12具備多種免疫調(diào)節(jié)功能,不僅可以調(diào)節(jié)Th1細(xì)胞的活性,促進(jìn)Th1細(xì)胞分泌細(xì)胞因子,增強(qiáng)Th1細(xì)胞的免疫應(yīng)答,而且可以促進(jìn)T細(xì)胞和NK細(xì)胞的增殖及殺傷作用,同時(shí)可以抑制Th2細(xì)胞分泌免疫因子的產(chǎn)生,即Th1細(xì)胞分泌的細(xì)胞因子可以抑制Th2細(xì)胞的增殖,反過(guò)來(lái)Th2細(xì)胞分泌的細(xì)胞因子可以調(diào)節(jié)Th1細(xì)胞的分化。
有研究表明,中藥多糖能影響白介素,如IL-2、IL-4、IL-12的生成和表達(dá),進(jìn)而對(duì)機(jī)體進(jìn)行免疫調(diào)節(jié)[12]。商云霞等[13]研究了中草藥復(fù)方多糖對(duì)雞INF-γ、IL-4和IL-12質(zhì)量濃度的影響,發(fā)現(xiàn)不同劑量中藥復(fù)方多糖均能提高INF-γ、IL-4和IL-12質(zhì)量濃度,且中劑量中藥復(fù)方多糖最好。李婉雁等[14]研究了白術(shù)多糖(PAM)對(duì)嶺南黃雞免疫功能的影響,結(jié)果發(fā)現(xiàn)PAM能促進(jìn)雛雞免疫器官中TNF-α、IL-2、IL-4及INF-γ mRNA的表達(dá),且PAM有一定的劑量限制。徐占云等[15]研究了枸杞多糖(LPB)對(duì)雛雞淋巴細(xì)胞體外增殖及分泌IL-2的影響,研究結(jié)果顯示LPB能促進(jìn)雛雞淋巴細(xì)胞增殖和IL-2的分泌。Huang等[16]報(bào)道,地黃多糖能上調(diào)T淋巴細(xì)胞IL-2的分泌水平。另外,還有研究顯示補(bǔ)益類中藥有效成分可以促進(jìn)IL-12、IL-2等細(xì)胞因子分泌,加強(qiáng)細(xì)胞因子的作用,激活B、T細(xì)胞,增強(qiáng)機(jī)體的細(xì)胞免疫和體液免疫,調(diào)節(jié)機(jī)體免疫,而中藥多糖是其中藥成分之一[17]。試驗(yàn)研究表明,不同劑量cCHMPS均能提高各基因型雞IL-2、IL-4、IL-12 mRNA表達(dá)量,提示中藥多糖增強(qiáng)機(jī)體抗病能力的分子機(jī)制之一可能是促進(jìn)細(xì)胞因子分泌。當(dāng)然,中藥多糖雖然能促進(jìn)機(jī)體IL-2、IL-4、IL-12 mRNA表達(dá),但是并非越高越好,三者之間必須處于一定的平衡狀態(tài),才能維持機(jī)體正常的的體液免疫和細(xì)胞免疫。
3.2 雞MHC B-LβII基因多態(tài)性對(duì)cCHMPS促進(jìn)淋巴細(xì)胞IL-2、IL-4、IL-12 mRNA表達(dá)的劑量影響
雞MHC基因家族在機(jī)體內(nèi)發(fā)揮著很重要的生物學(xué)功能,同時(shí)雞MHC抗原在體液免疫和細(xì)胞免疫中都發(fā)揮著重要的作用。T細(xì)胞表面有抗原結(jié)合的受體,簡(jiǎn)稱TCR(T cell receptor)。TCR具有特異性,只與特定的抗原結(jié)合, TCR只識(shí)別結(jié)合在自身MHC分子上的抗原。大多數(shù)T細(xì)胞含有CD4和CD8膜分子,表達(dá)的CD4 T細(xì)胞只識(shí)別MHC II類分子遞呈的抗原。CD4 T細(xì)胞作為輔助性T細(xì)胞(Th),通過(guò)識(shí)別抗原遞呈細(xì)胞(antigen-presenting cell,APC)MHC II類分子遞呈的抗原而被活化,活化后的Th細(xì)胞分裂增殖,同時(shí)分泌各種細(xì)胞因子,參與調(diào)節(jié)免疫應(yīng)答。此外,T細(xì)胞在識(shí)別外來(lái)抗原同時(shí),還要識(shí)別MHC分子,說(shuō)明T細(xì)胞受體在識(shí)別抗原需要依賴與抗原遞呈的MHC分子[18]。
許多研究表明雞多種傳染病的抗性高度與MHC基因多態(tài)性相關(guān),所以在研究家禽抗病育種試驗(yàn)中MHC基因成為了優(yōu)選的標(biāo)記基因[19]。李福偉等[20]研究表明個(gè)體以及品種之間存在不同免疫能力的遺傳差異,并且不同的免疫性狀存在顯著的優(yōu)勢(shì)基因型。李尚民等[21]的研究發(fā)現(xiàn)雞MHCB-LβII基因外顯子2的遺傳變異對(duì)京海黃雞抗病能力影響顯著,可作為球蟲(chóng)抗病能力選育候選基因。劉立波等[22]研究了雞MHC B-L基因SNPs單倍體型與血清中IgG含量、LPS含量、禽流感(AI)抗體滴度等免疫性狀關(guān)系,結(jié)果表明,不同免疫性狀存在顯著相關(guān)的優(yōu)勢(shì)SNPs單倍型。楊紅洋等[23]研究了中藥復(fù)方多糖對(duì)不同MHCB-LβII基因型雞血清細(xì)胞因子質(zhì)量濃度的影響,發(fā)現(xiàn)MHCB-LβII基因多態(tài)性使雞血清細(xì)胞因子IL-2、IL-4、IL-6、TNF-α質(zhì)量濃度產(chǎn)生差異。試驗(yàn)研究結(jié)果顯示,同一劑量cCHMPS對(duì)不同基因型雞淋巴細(xì)胞的IL-2、IL-4、IL-12 mRNA表達(dá)量不同,此研究結(jié)果與李福偉、李尚民、劉立波、楊紅洋等[20-23]的究結(jié)果相一致,說(shuō)明不同免疫能力存在個(gè)體水平上的差異。試驗(yàn)出現(xiàn)此結(jié)果的原因有可能是MHC II類分子對(duì)中藥多糖的感知有一定濃度范圍,BC基因型雞對(duì)高劑量中藥多糖產(chǎn)生免疫耐受,導(dǎo)致機(jī)體免疫效果低于低劑量的中藥復(fù)方多糖。
但此次試驗(yàn)中,僅僅研究了京紅 1 號(hào)蛋雞,且雞的數(shù)量及免疫相關(guān)指標(biāo)均較少,要確定中藥復(fù)方多糖最適免疫劑量的篩選是否受雞基因多態(tài)性的影響,還需增加雞的品種,擴(kuò)大試驗(yàn)雞的數(shù)量,增加體內(nèi)、體外免疫指標(biāo),進(jìn)行深入研究。
4 結(jié) 論
中藥復(fù)方多糖能顯著提高機(jī)體免疫力,且50 μg/mL中藥復(fù)方多糖對(duì)AA、BC基因型雞,100 μg/mL中藥復(fù)方多糖對(duì)BB基因型雞淋巴細(xì)胞的免疫效果顯著,提示中藥復(fù)方多糖的免疫增強(qiáng)作用有最適濃度且MHCB-LβII基因多態(tài)性可能影響中藥復(fù)方多糖免疫增強(qiáng)作用的最佳劑量,從經(jīng)濟(jì)角度考慮,確定添加50 μg/mL的中藥復(fù)方多糖組對(duì)雞淋巴細(xì)胞的免疫效果最優(yōu)。
)
[1] 李浩烜.香菇多糖對(duì)小鼠T細(xì)胞的功能[D]. 廣州: 廣州中醫(yī)藥大學(xué)碩士學(xué)位論文, 2011.
LI Hao-huan. (2011).StudiesontheeffectofTcellfunctioninmicebyLentinan[D]. Master Thesis. Guangzhou University of Chinese Medicine, Guangzzhou. (in Chinese)
[2] 李磊強(qiáng).紅芪多糖對(duì)小鼠脾淋巴細(xì)胞免疫調(diào)節(jié)作用的實(shí)驗(yàn)研究[D].蘭州:蘭州大學(xué)碩士學(xué)位論文,2015.
LI Lei-qiang. (2015).ExperimentalStudyontheregulatingeffectsofHedysariRadixPolysaccharideonimmunefunctionoflymphocytesinmice[D]. Master Thesis. Lanzhou University, Lanzhou. (in Chinese)
[3] 呂小成,張樂(lè)帥,王富軍.中藥多糖的免疫調(diào)節(jié)作用及研究進(jìn)展[J].上海中醫(yī)藥大學(xué)報(bào),2016,30(3):97-101.
Lü Xiao-cheng, ZHANG Yue-shuai, WANG Fu-jun. (2016). The research progress in immune regulation of polysaccharides of traditional Chinese medicine [J].ShanghaiUniversityofTraditionalChineseMedicineNewspaper, 30(3):97-101. (in Chinese)
[4] Issazadeh, S., Kjellén, P., Olsson, T., Mustafa, M., & Holmdahl, R. (1997). Major histocompatibility complex‐controlled protective influences on experimental autoimmune encephalomyelitis are peptide specific.EuropeanJournalofImmunology, 27(6): 1,584-1,587.
[5] 朱曉慶.中藥復(fù)方多糖對(duì)不同基因型雞免疫調(diào)節(jié)作用及其作用機(jī)制研究[D].石河子:石河子大學(xué)碩士學(xué)位論文, 2013.
ZHU Xiao-Qing. (2013).EffectsandmechanismofcompoundChineseherbalmedicinalpolysaccharideonimmunomodulatoryindifferentgenotypechickens[D]. Master Thesis. Shihezi University, Shihezi. (in Chinese)
[6] 謝昆, 蔣成硯, 全舒舟,等. 雞外周血淋巴細(xì)胞的分離和體外培養(yǎng)[J]. 中國(guó)家禽, 2011, 33(11): 57-58.
XIE Kun, JIANG Cheng-yan, QUAN Shu-zhou,et al. (2011). Isolation and culture of chicken peripheral blood lymphocytes [J].ChinaPoultry, 33(11): 57-58. (in Chinese)
[7] 安靜, 田河. 黃芪多糖的免疫藥理作用概述[J]. 中國(guó)畜牧獸醫(yī), 2012, 39(5): 202-204.
AN Jing, TIAN He. (2012). Research progress of outer membrane protein A ofE.coli[J].ChineseJournalofAnimalHusbandryandVeterinaryMedicine, 39(5): 202-204. (in Chinese)
[8] 孫德君, 張立恒, 姜宇,等. 中藥多糖免疫增強(qiáng)作用及機(jī)理的研究進(jìn)展[J]. 中國(guó)畜牧獸醫(yī), 2011, 38(8): 240-242.
SUN De-jun, ZHANG Li-heng, JIANG Yu, et al. (2011). Progress of research on the effect and mechanism of polysaccharide immunity of Chinese herbal medicine [J].ChineseJournalofAnimalHusbandryandVeterinaryMedicine, 38(8): 240-242. (in Chinese)
[9] Rubin, J. T. (1995). Interleukin-2: its rationale and role in the treatment of patients with cancer.CancerTreatRes, 80(80): 83-105.
[10] Amini, H., Hoseini, S. D., Nowroozi, J., & Shahbazzadeh, D. (2012). Cloning and sequencing of iranian chicken interleukine-2 gene.JundishapurJournalofMicrobiology, 5(3): 502-506.
[11] Shah, M. A. A., Yan, R. F., Xu, L. X., Song, X. K., & Li, X. R. (2010). A recombinant dna vaccine encoding eimeria acervulina csz-2 induces immunity against experimental e. tenella infection.VeterinaryParasitology, 169(1-2): 185-189.
[12] 薛愛(ài)珍.中藥多糖促誘生細(xì)胞因子的研究進(jìn)展[J].浙江中西醫(yī)結(jié)合雜志, 2007,17(1):64-66.
XUE Ai-zhen. (2007). Research progress of Chinese herbal medicine polysaccharides in promoting the production of cytokines [J].ZhejiangJournalofIntegratedTraditionalChineseandWesternMedicine, 17(1):64-66. (in Chinese)
[13] 商云霞,朱曉慶,谷新利,等.中草藥復(fù)方多糖對(duì)雞INF-γ、IL-4和IL-12質(zhì)量濃度的影響[J].西北農(nóng)業(yè)學(xué)報(bào),2015,24(5):24-28.
SHANG Yun-xia, ZHU Xiao-qing, GU Xin-li, et al. (2015). Effects of Compound Chinese Herbal Medicinal Polysaccharide on INF-γ, IL-4 and IL-12 Mass Concentration in Chicken [J].ActaAgriculturaeBoreali-occidentalisSinica, 24(5):24-28. (in Chinese)
[14] 李婉雁.白術(shù)多糖對(duì)嶺南黃雞免疫功能影響的研究[D]. 廣州:仲愷農(nóng)業(yè)工程學(xué)院,2014.
LI Wan-yan. (2014).EffectsofPolysaccharideofAtractylismacroceohalakoidzonImmuneFunctionofLingnanYellowChickens[D]. Master Thesis. Zhongkai university of agriculture and engineering, Guanzhou. (in Chinese)
[15] 徐占云,秦睿玲,李國(guó)輝,等.枸杞多糖對(duì)雛雞淋巴細(xì)胞體外增殖及分泌IL-2的影響[J].畜牧獸醫(yī)學(xué)報(bào), 2013,44(2):322-328.
XU Zhan-yun, QIN Rui-ling, LI Guo-hui, et al. (2013). and so on. Effects of Lycium barum Polysaccharide on cell Proliferation of Chicken Lymphocytes and IL-2 Excretion in vitro [J].ActaVeterinariaetZootechnicaSinica, 44(2):322-328. (in Chinese)
[16] Huang, Y., Jiang, C., Hu, Y., Zhao, X., Shi, C., & Yu, Y., et al. (2013). Immunoenhancement effect of rehmannia glutinosa polysaccharide on lymphocyte proliferation and dendritic cell.CarbohydratePolymers, 96(2): 516-521.
[17] 祝崢.補(bǔ)益類中藥有效成分作為新型人用疫苗佐劑的應(yīng)用前景[J].生物技術(shù)通訊,2004,15(1):92-94.
ZHU Zheng. (2004). Active components of some tonic Chinese herbs as novel human vaccine adjutants [J].BiotechnologyCommunication, 15(1):92-94. (in Chinese)
[18] Zekarias, B., Ter Huurne, A. A., Landman, W. J., Rebel, J. M., Pol, J. M., & Gruys, E. (2002). Immunological basis of differences in disease resistance in the chicken.VeterinaryResearch, 33(2):109-125.
[19] 楊玲.雞MHC基因多態(tài)性及其抗馬立克氏病的相關(guān)性研究[D].山東:山東農(nóng)業(yè)大學(xué), 2014.
YANG Lin. (2014).StudiesonthePolymorphismofMHCGeneandtheResistancetoMarekDiseaseinDifferentChickenSpecies[D]. Master Thesis. Shandong Agricultural University, Tai'an. (in Chinese)
[20] 李福偉,李淑青,逯巖,等.三個(gè)地方雞種 MHC B-L BII基因遺傳變異與免疫性狀的關(guān)聯(lián)分析[J]. 生物工程學(xué)報(bào),2013, 29(7): 904-913.
LI Fu-wei, LI Shu-qing, LU Yan, et al. (2013. Relations among immune traits and M HC B-L BII ge-ne in three local chicken breeds Chin J Biotech [J].JournalofBiologicalEngineering, 29(7): 904-913. (in Chinese)
[21] 李尚民. 京海黃雞MHC B-F和B-L基因多態(tài)性與抗球蟲(chóng)病關(guān)系的研究[D]. 揚(yáng)州: 揚(yáng)州大學(xué), 2008.
LI Shang-ming. (2008).SingleNucleotidePolymorphismofMHCB-FandB-LGenesAssociatedwithAn-ticoccidiosisTraitsinJinghaiYellowChicken[D].Master Thesis. Yangzhou University, Yangzhou. (in Chinese)
[22] 劉立波, 趙桂蘋, 文杰,等. 雞M HC B-L基因SNPs單倍體與免疫性狀關(guān)系的研究[C]//. 第十五次全國(guó)動(dòng)物遺傳育種學(xué)術(shù)討論論文集,2009,(4):78.
LIU Li-bo, ZHAO Gui-ping, WEN Jie, et al. (2009).StudyontherelationshipbetweenMHCB-LgeneSNPshaploidandimmunetraitsinchickens[C]//. Proceedings of the Fifteenth National Symposium on Animal Genetics and Breeding, (4): 78. (in Chinese)
[23] 楊紅洋,朱曉慶,商云霞,等.中藥復(fù)方多糖對(duì)不同MHCB-LβII基因型雞血清細(xì)胞因子質(zhì)量濃度的影響[J].西北農(nóng)業(yè)學(xué)報(bào),2017,17(1):64-66.
YANG Hong-yang, ZHU Xiao-qing, SHANG Yun-xia, et al. (2017). Effects of Traditional Chinese Medicine Compaund Polysaccharide on Serum Cytokines Mass Fraction in DifferentMHCB-LβIIGenotype Chickens [J].ActaAgriculturaeBoreali-occidentalisSinica, 17(1):64-66. (in Chinese)

