清熱解毒方對腫瘤化療后減毒作用的臨床觀察
陶文華,王嘯揚,錢 華,孫振華
(江蘇大學附屬醫院中醫內科,江蘇 鎮江 212001)
惡性腫瘤的化療已成為腫瘤綜合治療的重要組成部分,但影響化療藥物療效的限制性因素是其不良反應,成為腫瘤臨床治療面臨的現實難題[1]。隨著化療的實施往往引起不同的副作用,如惡心、嘔吐、厭食、脫發、乏力、骨髓抑制等[2],影響化療的順利進行,如何使患者順利地完成化療已成為臨床工作中亟待解決的問題。合理使用中西醫結合療法,能達到取長樸短、增效減毒的目的[3]。本研究觀察清熱解毒方對腫瘤化療減毒作用的臨床療效。
1 資料與方法
1.1 一般資料
收集2016年5月至2017年5月江蘇大學附屬醫院中醫內科就診的惡性腫瘤化療病人90例。其中男39例,女51例,年齡31~76歲,肺癌36例、結直腸癌22例、胃癌17例、子宮內膜癌6例、卵巢癌3例,食管癌3例、乳腺癌2例、鼻咽癌1例。入組患者隨機分為對照組及觀察組各45例。兩組患者在年齡、性別、腫瘤轉移、既往化療情況、化療前血象及卡氏評分等均無顯著性差異(P>0.05)。
1.2 骨髓抑制分級及嘔吐分級
采用世界衛生組織抗癌藥物急性及亞急性毒性反應分度標準[4]。
1.3 納入標準
符合下列條件為納入病例:①年齡18~75歲;②病理診斷明確并且應用含鉑方案化療的住院病人;③卡氏評分≥70;④心肝腎功能基本正常;⑤無明顯消化道癥狀及骨髓抑制情況,且簽署知情同意書。
1.4 治療方法
對照組在化療前15 min予昂丹思瓊8 mg加入生理鹽水100 mL中靜脈滴注,連續兩天;觀察組在化療前15 min予昂丹思瓊8 mg加入生理鹽水100 mL中靜脈滴注,連續兩天,同時在化療結束腹清熱解毒方,水煎兩次共400 mL,早晚飯后溫服,連續服用五天。清熱解毒方具體藥物如下:太子參20 g、莪術12 g、生苡仁20 g、土茯苓12 g、車前草12 g、石韋12 g、金錢草12 g、川牛膝12 g、三七粉3 g、焦山楂12 g、甘草5 g。化療期間若白細胞(WBC)計數低于3.0×109/L,開始予粒細胞集落刺激因子(G-CSF)75 μg,皮下注射,連續3~5天。兩組化療后合并治療情況,無統計學差異(P>0.05)。觀察組與對照組均應連續觀察血象變化及嘔吐情況至化療后第5天。
1.5 觀察指標
化療前后兩組卡氏評分比較;化療結束后兩組骨髓抑制發生率及分度;化療后兩組惡心嘔吐情況:以無惡心嘔吐,或輕度惡心,嘔吐1~2次/天為有效。觀察患者化療后急性期(0~24小時)、延遲期(2~5天)和全程(1~5天)的止嘔有效率。
1.6 統計學方法
采用SPSS 17.0統計軟件分析數據。計量資料以均數加減標準差表示,采用t檢驗,計數資料以百分率(%)表示,采用卡方檢驗。P<0.05為差異具有統計學意義。
2 結 果
2.1 化療前后兩組卡氏評分比較
觀察組和對照組化療后評分均有所下降,觀察組化療后第3天與化療前有統計學差異(P<0.05),化療后第5天與化療前無統計學差異(P>0.05);對照組化療后第3天、化療后第5天與化療前比較均有統計學差異(P<0.05)。觀察組化療后第3天、化療后第5天與對照組比均有統計學差異(P<0.05)。見表1。
表1 兩組卡氏評分比較(±s,分)
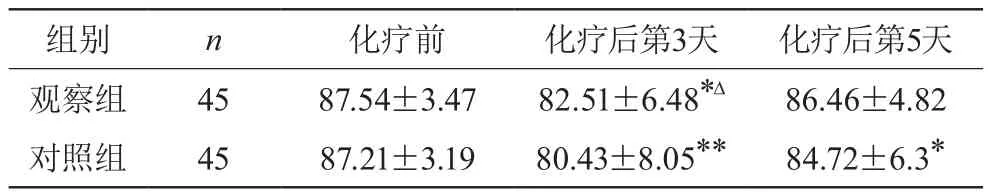
表1 兩組卡氏評分比較(±s,分)
注:與化療前比較,*P<0.05,** P<0.01;與對照組相比ΔP<0.05
組別 n 化療前 化療后第3天 化療后第5天觀察組 45 87.54±3.47 82.51±6.48*Δ 86.46±4.82對照組 45 87.21±3.19 80.43±8.05** 84.72±6.3*
2.2 化療后兩組骨髓抑制發生率及分度比較
化療后第3天觀察組骨髓抑制發生率為68.89%,與對照組骨髓抑制發生率88.89%相比,有統計學差異(P<0.05)。見表2。化療后第5天兩組骨髓抑制無明顯差異(P>0.05)。

表2 兩組骨髓抑制分級及發生率比較(n,%)
2.3 兩組臨床干預惡心嘔吐效果比較
觀察組全程有效及延遲有效為80%、88.89%,均明顯高于對照組的57.78%、62.22%,兩組相比有統計學差異(P<0.05),兩組急性期有效無明顯差異(P>0.05)。見表3。
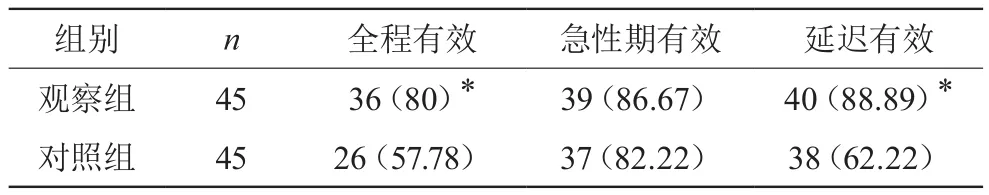
表3 兩組各期止嘔效果比較 [n(%)]
3 討 論
化療是晚期腫瘤患者主要治療方法之一,而鉑類藥物是目前臨床應用最廣泛的抗腫瘤藥物[5],據統計,我國含鉑類藥物的化療方案數占所有化療方案的70%~80%[6]。而實施化療的腫瘤患者都有著不同程度副作用出現,最為常見的包括:胃腸道反應,表現惡心,嘔吐,食欲不振等[7];骨髓造血功能受到不同程度抑制,表現全身乏力,貧血貌等[8]。
某些化療藥物使胃腸功能紊亂,脾胃運化失司。胃氣上逆,則惡心嘔吐;氣機郁滯,則腹脹;腑氣不通,郁熱內生,灼傷津液,則燥屎內結。惡性腫瘤無論新舊發病,大多患者舌質紅或暗紅,苔白或白膩,脈細弦或弦緊,均為郁滯之象,病機多虛多淤,化療藥物可損傷脾胃,使其生化無源,不能營養于先天,先天無養于骨髓,則骨髓無以生血,以致血虛,故見全身乏力,面色爪甲無華,舌淡脈細等。中醫認為化療藥物為濁氣,因此,利用清熱解毒方利水祛濁,可以有效的減輕化療藥物的毒副作用,提高晚期患者的生存質量。腫瘤患者多屬本虛標實,錯綜復雜[9],因此急則治其標,化療患者當以祛濁為主,輔以扶正,本方中太子參扶助正氣,生薏苡仁健脾利水;車前草、石韋、金錢草利尿滲濕,清熱解毒;土茯苓解毒除濕;莪術破血除痰、散結止嘔;三七化瘀止血,活血定痛;川牛膝利水通淋,活血祛瘀;焦山楂消食化積;甘草調和諸藥。有研究表明太子參對淋巴細胞有明顯的刺激作用,提高機體免疫[10];化療患者服用薏苡仁油后免疫力明顯增強,化療不良反應大大降低,為化療順利進行創造了良好的內環境[11];大車錢苷可抑制MMP-9活性減少血管生成,發揮抗腫瘤作用[12];覃軍等[13]研究表明硫酸化修飾能提高土茯苓多糖的抗腫瘤活性;莪術的主要成分包括姜黃素、揮發油等,這些成分可調節相關信號通路,抑制腫瘤細胞增殖、促進腫瘤細胞凋亡;研究表明三七抗腫瘤可能與抗腫瘤血管生成,抑制腫瘤細胞的侵襲、運動能力有關。本方通過利水滲濕,達到祛除邪氣,調和臟腑,以糾正化療過程中的氣血耗傷,使受損脾胃得以修復,同時大部分藥物活血化瘀起抗腫瘤作用。
本研究結果顯示,觀察組化療后卡氏評分明顯高于對照組(P<0.05),表明清熱解毒方用于腫瘤化療后可有效提高患者生活質量;同時觀察組骨髓抑制率明顯低于對照組(P<0.05),惡心嘔吐全程有效及延遲有效均明顯高于對照組(P<0.05),表明清熱解毒方在化療后起減毒作用,可提高患者依從性。總之,清熱解毒方可以減輕惡性腫瘤化療后不良反應。
[1] 楊宗純,錢 夢,謝 鳴.中藥與多柔比星化療聯合運用的增效減毒作用[J].中國藥師,2017,20(08):1382-1386.
[2] 抗癌藥急性及亞急性毒性反應分度標準(WHO標準)[J].癌癥,2012,(03):254.
[3] Cimino G,Pan C,Henderson P.Personalized medicine for targeted and Platinum-based chemotheraPy of lung and bladder cancer,Bioanalysis 5,2013:369-391.
[4] 王理偉,蔡 訊.鉑類藥物的不良反應及其防治[J].上海醫藥,2013,34(23):6-10.
[5] Shi M,Fortin D,Sanche L,et al.Convection-enhancement delivery of Platinum-radiotheraPy in F98 glioma rat model.Invest New Drugs,2015:555-563.
[6] Fisusi F,Siew A,Chooi K,et al.Lomustine NanoParticles Enable Both Bone Marrow SParing and High Brain Drug Levels - A Strategy for Brain Cancer Treatments,Pharm Res,2016:1289-1303.
[7] 岳 斌,李占林,何曉華.從扶正化瘀探討小細胞肺癌的臨床治療[J].環球中醫藥,2017,10(08):901-903.
[8] 高學敏.中醫學[M].北京:中國中醫藥出版社,2002:501.
[9] 莊新英.薏苡仁油聯合PT化療方案治療卵巢癌的臨床觀察及實驗研究[D].湖北中醫藥大學,2015.
[10] 裴世敏.大車前苷抑制MMP-9活性影響乳腺腫瘤生長和轉移的研究[D].中國農業大學,2017.
[11] 覃 軍,鄧廣海,羅明超,等.正交實驗優選土茯苓多糖的硫酸化工藝研究及修飾產物抗腫瘤活性測定[J].廣州中醫藥大學學報,2017,34(02):254-260.
[12] 趙志梅,張立杰,夏 天,等.莪術主要單體成分抗炎、抗腫瘤作用研究進展[J].藥物評價研究,2017,40(01):119-124.
[13]張利竣.中藥三七抗腫瘤研究進展[J].江西中醫藥,2016,47(06):79-80.

