雙聯抗血小板治療小兒川崎病的近遠期療效及作用機制研究
馮智 黃清波
川崎病為累及冠狀動脈的全身中小血管炎癥,多發于兒童時期[1]。多項研究顯示,川崎病易引起冠狀動脈損傷,造成冠狀動脈擴張及血栓形成,治療不及時可能并發冠狀動脈瘤,危及患者生命[2-3]。川崎病的臨床治療以阿司匹林聯合丙種球蛋白為主。但有資料顯示,單用阿司匹林抗血小板聚集的效果欠佳,仍有部分川崎病患者出現冠狀動脈血栓導致急性冠狀動脈狹窄與心肌梗死[4]。氯吡格雷是口服抗血小板聚集藥物,其效果已在心血管疾病中得到肯定。近年來,氯吡格雷逐漸在未成年患者中應用,成為預防小兒動脈血栓形成的新選擇。有國外學者提出,雙聯抗血小板治療小兒川崎病可進一步強化抗血小板聚集療效,預防冠狀動脈血栓[5]。目前,國內有關雙聯抗小板治療小兒川崎病的研究較少。為此,本研究選擇78例川崎病患兒分為單抗組與雙抗組,探討2種治療方案對小兒川崎病的近、遠期療效及作用機制,現報告如下。
對象與方法
一、研究對象
2012年1月~2013年10月在我院診治的川崎病患兒中,按以下標準選擇研究對象:①年齡2~12歲;②符合文獻[6]的川崎病診斷標準;③血小板升高(>400×109/L);④同意定期隨訪。排除伴冠狀動脈病變或合并心肌缺血者。研究共納入78例川崎病患兒,根據患兒就診順序進行編號,奇數號納入A組、偶數號納入B組,每組各39例患兒。A組中,男25例、女14例,年齡2~10歲、中位年齡4歲,發熱時間6~16 d、中位發熱時間11 d,病程6~18 d、中位病程11 d。B組中,男28例、女11例,年齡2~9歲、中位年齡4歲,發熱時間7~16 d、中位發熱時間11 d,病程7~18 d、中位病程11 d。2組患兒的基線資料比較差異均無統計學意義(P均>0.05)。本研究已獲得醫院醫學倫理委員會批準,患兒家屬均對研究知情并簽署知情同意書。
二、方 法
2組患兒均在確診川崎病后的急性期予口服阿司匹林30~50 mg/(kg·d)及靜脈注射丙種球蛋白2 g/kg控制炎癥,同時給予對癥支持治療。退熱48~72 h后,2組均予以規范抗凝治療。其中A組采用阿司匹林聯合氯吡格雷,B組單用阿司匹林。其中阿司匹林劑量為3~5 mg/(kg·d),口服,每日1次;氯吡格雷劑量為1 mg/kg,口服,每日1次。2組出院后均連續用藥3個月至1年。如患兒川崎病癥狀消失且ESR恢復至正常范圍后繼續用藥8周可予停藥。治療期間觀察2組患兒的藥物相關不良反應發生情況,并予對癥處理。
三、觀察內容
1.近期療效及作用機制
分別于治療前及抗血小板治療2周后的清晨采集患兒外周靜脈血8 ml,取其中3 ml分離血清,采用ELISA檢測。余5 ml外周靜脈血以密度梯度離心法分離外周血單個核細胞(PBMC),實時定量PCR檢測核因子-κB(NF-κB)p65 mRNA,操作步驟嚴格參照試劑盒說明書;蛋白免疫印跡法檢測NF-κB p65蛋白表達;用移液槍吸取培養細胞上清液,ELISA雙抗體夾心法檢測上清液的MMP-9水平,步驟參照試劑盒說明書。本研究所用試劑盒均購自上海恒遠生物科技有限公司。另于治療前、抗血小板治療1、2、4周及3個月后,清晨采集患兒末梢血1 ml,應用美國貝克曼Z2全自動血細胞分析計數儀測定血小板、平均血小板體積(MPV)、血小板體積分布寬度(PDW)。
2.遠期療效
對2組患兒進行為期3年的隨訪,隨訪起點為抗凝治療,每3個月行1次UCG觀察冠狀動脈病變,病變分為:①冠狀動脈血栓,即UCG示冠狀動脈內膜回聲增強;②冠狀動脈擴張,即0~3歲患兒冠狀動脈內徑≥2.5 mm、4~9歲患兒冠狀動脈內徑≥3.0 mm、10~14歲患兒冠狀動脈內徑≥3.5 mm;③冠狀動脈瘤,即冠狀動脈內徑擴張至4~7 mm,當冠狀動脈擴張≥8 mm時為巨大冠狀動脈瘤[7]。同時通過血栓大小、數量的改變評估抗血小板聚集療效:①有效,指血栓縮小或數量減少或血栓消失后未再次出現;②無效,指無血栓縮小與數量減少或血栓增大、數量增加或出現新的冠狀動脈血栓、狹窄、心肌梗死等不良轉歸[8]。比較2組患兒的抗血小板聚集有效率和冠狀動脈病變發生率。
四、統計學處理
結 果
一、2組川崎病患兒在治療前及治療2周后的TPO、IL-3、IL-6水平比較
治療2周后,2組患兒TPO、IL-3、IL-6水平均低于治療前(P均<0.05);治療前或治療2周后的上述指標組間比較差異均無統計學意義(P均>0.05),見表1。
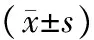
表1 治療前后2組川崎病患兒的TPO、IL-3、IL-6水平變化 ng/L
注:與本組治療前比較,aP<0.05
二、2組川崎病患兒在治療3個月期間的血小板參數變化
治療前,2組患兒的血小板、MPV、PDW比較差異均無統計學意義(P>0.05);治療3個月期間,2組患兒的血小板、MPV、PDW均逐漸降低(圖1),其中2組的血小板、MPV變化組間比較差異有統計學意義(F分別為18.354、13.187,P均<0.01),2組間PDW變化接近(P>0.05),A組治療3個月時的血小板、MPV均低于B組(t分別為3.705、9.243,P均<0.05)。

圖1 治療期間2組川崎病患兒的血小板參數變化
三、2組川崎病患兒在治療前及治療2周后PBMC的NF-κB和MMP-9水平比較
治療2周后,2組川崎病患兒PBMC的NF-κB p65 mRNA及蛋白和MMP-9水平均低于治療前(P均<0.05),治療前或治療2周后2組患兒PBMC的NF-κB p65 mRNA及蛋白、MMP-9水平組間比較差異均無統計學意義(P均>0.05),見表2。
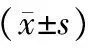
表2 治療前后2組川崎病患兒PBMC的NF-κB和MMP-9水平比較
注:與本組治療前比較,aP<0.05
四、2組川崎病患兒的抗血小板聚集療效比較
A組患兒中,治療6個月18例、治療12個月21例,B組中分別為15例、24例。治療6、12個月時,A組患兒的抗血小板聚集有效率均高于B組(P均<0.05),見表3。
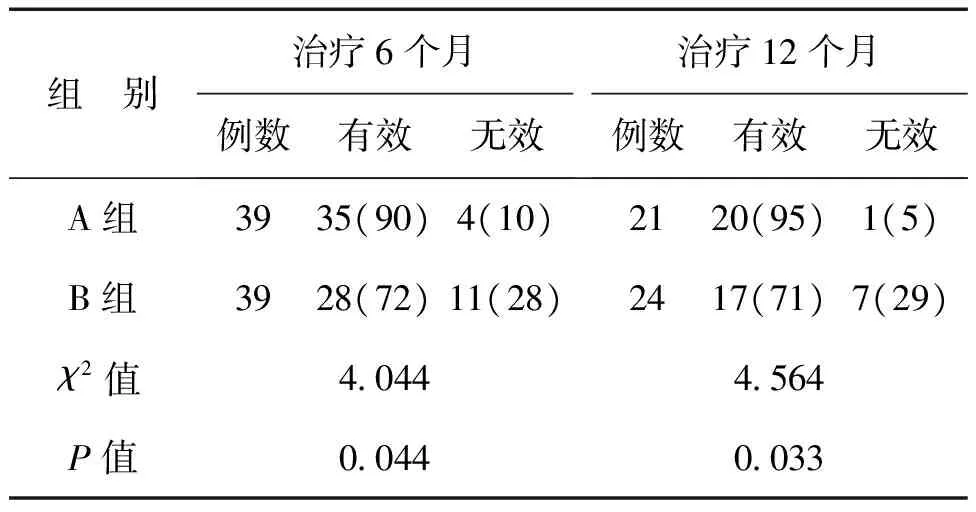
表3 2組川崎病患兒的抗血小板聚集療效比較 例(%)
五、2組川崎病患兒的冠狀動脈病變發生情況比較
2組患兒均完成3年的隨訪。A組患兒出現冠狀動脈病變3例,其中2例發生在隨訪3個月,1例為冠狀動脈血栓、另1例為冠狀動脈擴張;隨訪1年時新出現1例冠狀動脈血栓,未見冠狀動脈瘤與死亡病例,冠狀動脈病變總發生率為8%。B組出現冠狀動脈病變10例,其中隨訪半年內出現4例冠狀動脈病變,2例為冠狀動脈血栓、2例為冠狀動脈擴張;隨訪1年時新發現3例冠狀動脈擴張,隨訪2年時新發現2例冠狀動脈擴張與1例冠狀動脈瘤,隨訪結束時無死亡病例,冠狀動脈病變總發生率為26%。A組冠狀動脈病變發生率低于B 組(χ2=4.523,P=0.033)。
六、抗凝治療與冠狀動脈病變的相關性分析
川崎病患兒的血小板與MPV均與冠狀動脈病變呈正相關(P均<0.05),即血小板與MPV值越高,冠狀動脈病變風險越大。PDW與冠狀動脈病變無關(P>0.05),見表4。

表4 川崎病患兒血小板參數與冠狀動脈病變的相關性分析
七、不良反應發生情況
A組治療期間出現鼻衄2例,雙下肢淤斑淤點2例,減少阿司匹林劑量后緩解,不良反應總發生率為10%。B組出現鼻衄2例、皮膚淤斑淤點1例,調整飲食、注意休息后緩解;血便1例,停藥后緩解;嘔吐1例,予以臥床休息后緩解;1例皮疹患者未予處理自行緩解,B組不良反應總發生率為15%。2組患兒的不良反應發生率比較差異無統計學意義(χ2=0.456,P=0.498)。
討 論
川崎病的病因尚未明確。有動物實驗顯示,川崎病急性期血管炎快速進展,血管內皮細胞受損引起血小板激活,導致血小板聚集、黏附,進而損傷冠狀動脈甚至引發冠狀動脈病變[9]。恢復期的川崎病患兒仍面臨冠狀動脈進一步損害所引發的冠狀動脈血栓、冠狀動脈擴張等風險。
靜脈注射丙種球蛋白并大劑量應用阿司匹林控制炎癥是川崎病早期的主要治療方案。近年來,后續持續抗凝治療對預后的影響也逐漸引起重視。本研究中,A組川崎病患兒采取阿司匹林聯合氯吡格雷的雙抗治療,結果顯示治療6、12個月時的抗血小板聚集有效率均高于使用阿司匹林單抗治療的B組(90%vs. 72%,95%vs. 71%)。在血小板參數方面,2組患兒在抗血小板治療2周后的血小板、MPV、PDW等血小板參數基本穩定,其中A組患兒的血小板、MPV均低于B組,維持在更低水平,抗凝效果更佳。史宏等[10]研究發現,血小板增多與患兒急性期TPO變化有關,可通過拮抗該因子達到抑制血小板增加、減輕冠狀動脈損傷,提示急性期炎癥控制是治療的首要問題。早期應用丙種球蛋白可使急性癥狀得到有效控制。已有研究顯示,發病10 d內予以丙種球蛋白的效果最佳[11]。氯吡格雷為口服抗血小板藥,通過抑制二磷酸腺苷受體及激活相關糖蛋白復合物等途徑抑制血小板凝集,在動脈血栓形成的二級預防中應用廣泛,與阿司匹林聯合可有效預防冠狀動脈支架患者血栓形成,兩者聯合可強化抗血小板聚集作用,有效防止血小板聚集、黏附,避免冠狀動脈損傷。
談誠等[12]的研究顯示,川崎病患兒PBMC的NF-κB和MMP-9水平急性期均偏高,至恢復期逐漸降低。本研究顯示,2組治療后2周的NF-κB mRNA及蛋白和MMP-9水平均較治療前下降。有研究表明,NF-κB可能通過調節炎性因子等途徑參與川崎病的發病[13]。另有報道顯示,川崎病患兒的冠狀動脈組織結構遭到破壞后出現大量炎癥細胞增殖浸潤,血清中MMP-9水平上調[14]。Shiotani等(2011年)指出,可將抑制NF-κB作為強化川崎病療效的新思路,通過抑制NF-κB阻斷下游炎癥反應。本研究還顯示,血小板和MPV與冠狀動脈病變風險呈正相關,血小板聚集越嚴重,血小板與MPV值越大,冠狀動脈病變風險越高,再次證實規范、有效的抗凝治療是改善患兒后期冠狀動脈血流、降低冠狀動脈病變風險的關鍵。遠期隨訪結果顯示,A組隨訪期間的冠狀動脈病變發生率僅為8%,低于B組的26%,表明雙抗治療的抗凝效果優于阿司匹林單抗,在小兒川崎病治療中的應用更具優勢。抗凝過度所引起的出血問題是川崎病治療安全性的主要觀察指標,本研究中,2組不良反應總發生率分別為10%、15%,患兒出血癥狀輕,安全性高。
綜上所述,阿司匹林聯合氯吡格雷治療小兒川崎病可有效抑制血小板聚集,使血小板與MPV等持續維持在較低水平,降低冠狀動脈病變發生風險。
[1] Rowley AH, Shulman ST. Pathogenesis and management of Kawasaki disease.Expert Rev Anti Infect Ther,2010,8(2):197-203.
[2] Suda K.Thromboprophylaxis in patients with coronary aneurysms caused by Kawasaki disease.Nihon Rinsho,2014,72(9):1659-1663.
[3] Saguil A, Fargo M, Grogan S.Diagnosis and management of kawasaki disease.Am Fam Physician, 2015,91(6):365-371.
[4] Michihata N, Matsui H, Fushimi K, Yasunaga H. Guideline-concordant treatment of kawasaki disease with immunoglobulin and aspirin and the incidence of coronary artery aneurysm. Clin Pediatr(Phila), 2015,54(11):1076-1080.
[5] Jang GY, Kang IS, Choi JY, Bae EJ, Kim YH, Kim SH, Ma JS.Nationwide survey of coronary aneurysms with diameter >6 mm in Kawasaki disease in Korea.Pediatr Int,2015,57(3):367-372.
[6] 杜軍保.川崎病的診斷與鑒別診斷.中國實用兒科雜志,2006,21(10):727-728.
[7] Taniguchi K, Ono H, Sato A, Kinomoto S, Tagawa N, Umehara N, Kato H, Sago H.Strict management of a pregnant patient with giant coronary artery aneurysm due to Kawasaki disease. Pediatr Int,2015,57(5):990-992.
[8] 張清友,簡佩君,杜軍保.風濕熱、心內膜炎及川崎病委員會,美國心臟病學會及美國兒科學會.川崎病的診斷、治療及長期隨訪指南介紹.實用兒科臨床雜志,2012,27(13):1049-1056.
[9] Portman MA, Wiener HW, Silva M, Shendre A, Shrestha S.DC-SIGN gene promoter variants and IVIG treatment response in Kawasaki disease.Pediatr Rheumatol Online J,2013,11(1):32.
[10] 史宏,李曉輝,周敏,李曉靜,徐鳴,李丹,冉叢蘭.川崎病血小板升高與血清血小板生成素、白介素3、白介素6的關系研究.臨床兒科雜志,2009,27(7):649-652.
[11] Yoshimura K, Kimata T, Mine K, Uchiyama T, Tsuji S, Kaneko K.N-terminal pro-brain natriuretic peptide and risk of coronary artery lesions and resistance to intravenous immunoglobulin in Kawasaki disease.J Pediatr,2013,162(6):1205-1209.
[12] 談誠,韓勍,朱純亮,李喆倩,劉麗莎.急性期川崎病患兒外周血單個核細胞NF-κB、MMP-9表達變化及意義.山東醫藥,2015,55(6):11-13.
[13] Kobayashi T, Saji T, Otani T, Takeuchi K, Nakamura T, Arakawa H, Kato T, Hara T, Hamaoka K, Ogawa S, Miura M, Nomura Y, Fuse S, Ichida F, Seki M, Fukazawa R, Ogawa C, Furuno K, Tokunaga H, Takatsuki S, Hara S, Morikawa A; RAISE study group investigators.Efficacy of immunoglobulin plus prednisolone for prevention of coronary artery abnormalities in severe Kawasaki disease (RAISE study): a randomised, open-label, blinded-endpoints trial.Lancet,2012,379(9826):1613-1620.
[14] 湯昔康,陳澤楷,李汝霞,麥友剛,覃麗君.川崎病合并感染時臨床特征及淋巴細胞亞群、免疫球蛋白水平變化.新醫學,2015,46(9):608-611.

