CT引導下經皮穿刺微波消融治療肺癌的臨床應用*
馬幸生 張永恒 劉勇恩 郭孟剛 鐘釧
(遂寧市中心醫院胸外科,四川 遂寧 629000)
隨著人口老齡化、吸煙、環境污染等綜合因素的日趨嚴重,肺癌成為世界發病率和死亡率最高的惡性腫瘤之一。雖然外科手術是治療肺癌的首選方法,但臨床上僅有15%的患者滿足手術條件[1]。由于患者多為老年人,心肺功能差,耐受手術能力差,臨床化學治療、放射治療等傳統方法,效果仍然不理想。近年來以經皮穿刺微波消融(Percutaneous microwave ablation therapy,PMAT)為代表的非手術性局部熱消融治療成為重要的治療手段。本文旨在CT引導下對肺癌患者行微波消融治療的臨床應用進行探討,現將結果報告如下。
1 資料與方法
1.1 一般資料 回顧性分析2013年3月~2016年3月期間我院胸外科住院的在CT引導下行PMAT治療的肺癌患者的臨床資料。本組患者均為不愿或不能進行手術的肺癌患者38例,其中男24例,女14例,年齡(66.9±11.8)歲;所有患者均經病理確診。原發性肺癌33例,病理類型(鱗癌18例,腺癌13例,小細胞肺癌1例,神經內分泌癌1例),病理分期(I期3例、Ⅱ期5例、Ⅲ期15例、Ⅳ期10例;轉移性肺癌5例(肝癌肺轉移1例,鼻咽癌肺轉移1例,結腸癌肺轉移1例,宮頸癌肺轉移1例,乳腺癌肺轉移1例)。所有患者治療前行胸部CT增強掃描確定病灶數目45個,腫瘤大小1.0~6.8cm,其中≤3.0cm 27個,>3.0cm 18個。對>3.0cm的病灶采用2~3點消融,對≤3.0cm的病灶采用單點消融;患者無凝血功能障礙;隨訪時間3~36月,中位隨訪時間26月,見表1。

表1 38例患者45個病灶臨床資料Table 1 General information
1.2 方法
1.2.1 儀器 采用西門子16或64排螺旋CT機,億高醫療EC0-100C微波治療儀,輸出功率(2450±20)MHz,輸出功率0~150W內連續可調/50Ω。
1.2.2 術前準備 術前胸部增強CT檢查,了解患者肺部病灶部位、形態、大小、血供及與周圍組織關系,常規檢查患者凝血功能、心電圖;術前常規禁食,術前30min肌肉注射嗎啡5mg,術中靜滴嗎啡5mg。
1.2.3 手術方法 根據術前CT影像,選擇合適體位(平臥位或俯臥位),進行心電及血氧飽和度監測,將CT定位柵粘附于病灶區域的體表。CT掃描確定病灶與毗鄰的關系,確定最佳的穿刺點及穿刺路徑,預設消融時間及功率。取2%利多卡因5ml于穿刺點局部浸潤麻醉至壁胸膜,將微波穿刺針逐層穿刺進入體內,經CT掃描確定穿刺針到達預定的病灶位置,連接水循環冷卻儀及微波消融治療儀;輸出消融功率選擇50~70w,時間4~10min,消融完成后并行針道消融,穿刺點消毒包扎,見圖1。
1.2.4 療效及并發癥評價 根據改良的實體瘤療效評價標準(New response valuation criteria in solid tumors,RECIST)評價療效[2-3]。該標準分為4級:完全緩解(Complete response,CR)、部分緩解(Partial response,PR)、穩定 (Stable disease,SD)和進展(Progressive disease,PD);術后1、3、6月連續復查CT評價病灶變化,見表2。

圖1 術前及術中病灶的肺窗及縱隔窗Figure 1 The lung window and mediastinal window of the preoperative and intraoperative lesions
Table2Improvedstandardforevaluatingthecurativeeffectofsolidtumor

臨床效果CT所見腫瘤大小CT所見腫瘤密度CR病變消失或疤痕最大徑小于原來25%囊性化或空腔形成PR最大徑縮小>30%病變低密度改變、中心壞死或液性改變SD最大徑縮小<30%實性改變、無中心壞死或空腔PD最大徑增加20%以上實性改變、侵及鄰近結構
治療后30天內出現的相關癥狀被視為治療相關并發癥,根據腫瘤消融國際工作組制定的標準(Common Terminology Criteria for Adverse Events version 4.0 ,CTCAE )[4]對并發癥進行評估。
2 結果
2.1 治療后即刻影像學表現 微波消融治療后即刻復查CT平掃見腫瘤病灶呈現低密度改變,周邊呈現超過病灶的磨玻璃樣影,部分病例中心出現氣體密度空洞,CT值較治療前均有所下降,提示腫瘤病灶得到不同程度毀損,見圖2。
2.2 治療后影像學改變及療效評價 微波消融治療后1月行胸部增強CT掃描評價消融病灶情況提示:45個病灶中31個病灶體積出現不同程度縮小,中央密度進一步減低,外周密度有所升高,增強提示腫瘤病灶無明顯強化;治療后3月胸部增強CT提示:25個病灶基本消失或少許瘢痕、纖維條索組織存留,6個病灶部分縮小,10個病灶與治療前變化不明顯,有4個術前腫瘤直徑>3.0cm的病灶增強提示存在部分強化,進行再次消融治療;治療后6月胸部增強CT提示:26個病灶基本消失或少許瘢痕、纖維條索組織存留,增強掃描未見強化,達到CR(26/45,57.8%),9個病灶腫瘤直徑縮小超過1/2,達到PR(9/45,20.0%);7個病灶腫瘤直徑縮小約1/4,達到SD(7/45,15.6%);3個病灶無明顯變化(3/45,6.67%);總體有效率(CR+PR)為77.8%,見表3、圖3。

圖2 治療后即刻CT影像表現Figure 2 Immediate CT imaging after treatment
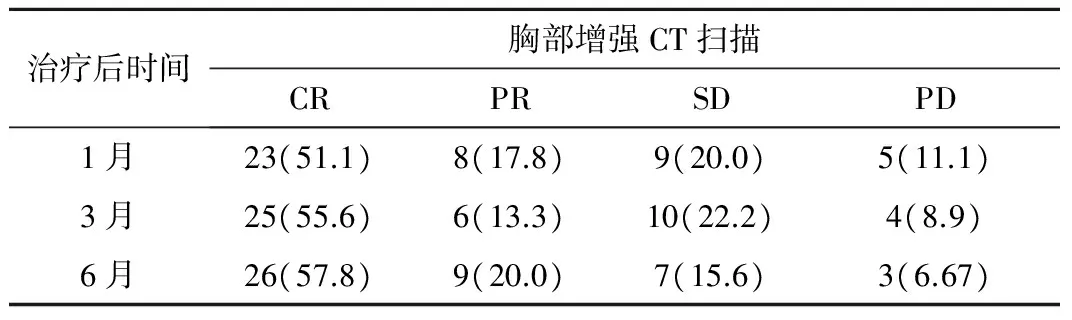
治療后時間胸部增強CT掃描CRPRSDPD1月23(51.1)8(17.8)9(20.0)5(11.1)3月25(55.6)6(13.3)10(22.2)4(8.9)6月26(57.8)9(20.0)7(15.6)3(6.67)
38例患者術后30天內無死亡,隨訪3~36月,24例患者健在,中位無病生存期18.2個月。1、2、3年生存率分別為89.5%(34/38)、73.7%(28/38)、63.2%(24/38),見表4。
2.3 38例患者中并發癥及不良反應,出現氣胸8例(8/38,21.1%),其中2例合并少許胸腔積液,6例肺壓縮<30%,未予以特殊處理,自行吸收;2例行胸腔穿刺置管引流。12例出現中低熱,考慮腫瘤細胞壞死、吸收引起,3~5天自行消失;1例出現高熱,經對癥及觀察后好轉;5例出現咯血,以痰中帶血為主,無大咯血病例發生;1例高齡患者術后出現心房纖顫,經藥物性復律后轉為竇性心律。

表4 38例患者治療后生存率[n,(×10-2)] Table 4 Survival rate of posttreatment

圖3 不同時間微波消融術后CT檢查結果Figure 3 Microwave ablation after 1 month,3 months,6 months 注:a.1月后檢查;b.3月后檢查;c.6月后檢查
3 討論
肺癌是世界上死亡率、發病率最高的惡性腫瘤,每年約有250萬的肺癌患者死亡及超過160萬的新增肺癌患者[5],而我國情況更加惡劣。根據2012年中國腫瘤年度報告顯示,肺癌每年的發病率為57.63/10萬,死亡率為48.87/10萬[6]。手術目前仍然是肺癌患者的首選治療方法,但超過80%的肺癌患者發病時已錯過手術機會,傳統的化療、放療等效果仍然不理想,加之高齡、心肺功能差、耐受手術能力差,或拒絕手術等情況在臨床中占據很大部分。局部熱消融治療作為創傷小的介入方式在治療肺癌及肺轉移癌中得到應用,并取得的不錯的療效[7-9]。微波消融治療是熱消融中具備消融范圍大、溫度高、效果直接、可控性強等優點得到更廣泛的臨床應用[10]。同時經皮肺穿刺微波消融治療對患者心肺功能等全身情況要求較低,只要患者凝血功能無明顯異常,能夠平穩呼吸達到平臥位的操作要求均能夠實施,是肺癌治療手段的重要補充。
微波消融治療腫瘤時,通過微波電場使分子內摩擦生熱,最高局部溫度可達到1000C以上,導致腫瘤細胞發生凝固性壞死,并凝固腫瘤周圍血管,達到治療腫瘤的目的。有研究顯示,要達到完全性固化,需要超過腫瘤邊緣0.5-1.0cm[11],而單點消融,其有效凝固效應可達到4.8cm[12];本組研究提示,CT引導下經皮肺穿刺微波消融治療后即刻復查CT見腫瘤病灶呈現低密度改變,周邊呈現超過病灶的磨玻璃樣影,CT值較治療前均有所下降;本組病例中針對≤3.0cm的腫瘤病灶采用單點消融方式取得的良好的局部效果;對于腫瘤病灶>3cm采用2-3點的消融,以期達到腫瘤局部消融的目的。其中4例>3.0cm的腫瘤病灶在術后增強CT掃描中存在部分血供表現,進行了2次消融處理。
針對于I期肺癌的治療方式首選是手術治療,但不幸的是,僅1/3的患者具備手術指征[13];本組中有3例I期肺癌通過微波消融治療得到了很好的控制,但病例數太少,需要更多的證據支持。
仲樓等[14]報道,微波消融治療周圍型肺癌的總體有效率為70.4%;Wolf等[15]報道,CT引導下經皮穿刺微波消融治療50例患者82個轉移性肺癌,74%微波消融部位消融完全,78%的患者腫瘤沒有復發,1年局部控制率為67%,微波消融后1年、2年、3年生成率分別為65%、55%和45%。Yashiro等[16]在CT引導下經皮微波消融治療71例患者210個肺部腫瘤,1年、2年和3年腫瘤局部無進展率分別為80.4%、69.0%和67.7%,技術效率分別為91.4%,83.0%和83.0%。Vogl等[17]對57例患者91個病灶采用CT引導下經皮微波消融治療,33.0%(30/91)個病灶局部腫瘤進展,21(36.8%)例患者腫瘤局部進展,腫瘤局部進展平均時間為(8.3±5.5)個月(2.1~25.2個月),局部腫瘤進展估計中位時間為(22.6±12.4)個月。本研究顯示,治療后6月復查胸部增強CT提示:26個病灶基本消失或少許瘢痕、纖維條索組織存留,增強掃描未見強化,達到CR(26/45,57.8%),9個腫瘤病灶直徑縮小超過1/2,達到PR(9/45,20.0%);總體有效率(CR+PR)為77.8%,微波消融后1年、2年、3年生存率分別為89.5%(34/38)、73.7%(28/38)、63.2%(24/38)。通過以上研究說明,經皮肺穿刺微波消融治療肺癌能夠達到局部控制腫瘤進展及減瘤的目的。
經皮肺穿刺微波消融治療肺癌是一種比較安全的方法,并發癥發生較少,重大及致死性并發癥罕見。有研究表明,其最常見的并發癥為氣胸[18],尤其合并肺氣腫的高齡患者,術后胸腔積液往往與腫瘤及周圍肺組織消融后出現局部炎性滲出有關[19]。本組中出現氣胸8例(8/38,21.1%),其中2例合并少許胸腔積液,6例肺壓縮<30%,未予以特殊處理,自行吸收;對于氣胸肺壓縮超過30%或中-大量胸腔胸腔積液行胸腔穿刺置管引流后好轉;發熱、痰中帶血等并發癥一般無需特殊處理,危害一般較小[20],一般不會明顯延長住院時間及增加患者的經濟負擔,對患者的生活質量影響較小。
4 結論
經皮肺穿刺微波消融治療肺癌是一種療效確切,能夠有效控制腫瘤的局部進展及減瘤目的,具有可重復性,并可配合放化療、靶向治療等方式達到延長患者的生存期,提高生活質量。具有并發癥少、創傷小、耐受性好、安全性高等優勢,具有良好的臨床應用價值。
[1]舒曉莉,單光蓮,葉欣.肺癌局部熱消融治療[J].國際腫瘤學雜志, 2011, 38(4):382~385.
[2]Fernarido HC, De Hoyos A, Landrenean RJ,etal. Radiofrequency ablation for the treatment of non-small cell lung cancer in marginal surgical candidates [J]. J Thorac Cardiovasc Surg, 2005,129(3):639-644.
[3]劉寶東,支修益,劉磊,等.CT引導下射頻消融治療中晚期非小細胞肺癌的近期療效觀察[J].中國肺癌雜志,2009,12(7):775-779.
[4]NIO Cancer.The National Cancer Institute: Common Terminology Criteria for Adverse Events (CTCAE) Version 4.0[J].NIH,2010,6(14):1-71.
[5]Jemal A, Bray F, Center MM,etal.Global cancer statistics(2012)[J]. Ca A Cancer Journal for Clinicians,2011,61(2):69-90.
[6]Chen W,Zheng R,Zhang S,etal.Report of incidence and mortality in China cancer registries 2009[J].Chinese Journal of Cancer Research,2012,25(3):10-21.
[7]Vogl TJ,Naguib NN, Lehnert T,etal. Radiofrequency,microwave and laser ablation of pulmonary neoplasms:clinical studies and technical considerations-Review article[J].Eur J Radiol,2011,77(2):346-57.
[8]Crocetti L, Lencioni R.Radiofrequency ablation of pulmonary tumors[J].Eur J Radiol,2010,75(1):23-7.
[9]Smith SL,Jennings PE.Lung radiofrequency and microwave ablation:a review of indications,techniques and post-procedural imaging appearances[J].Br J Radiol,2015,88 (1046):20140598.
[10] Rose SC, Dupuy DE, Gervais DA,etal.Technology Assessment Committee of the Society of Interventional Radiology. Research reporting standards for percutaneous thermal ablation of lung neoplasms[J].J Vasc Interv Radiol,2009,20(7): 474-485.
[11] Gazelle GS,Goldberg SN,Solbiati L,etal.Tumor ablation with radiofrequency energy[J]. Radiology,2000,217(3):633-646.
[12] Nakahara Y, Mochiduki Y, Miyamoto Y,etal. Prognostic significance of the lymphocyte-to-neutrophil ratio in percutaneous fine-needle aspiration biopsy specimens of advanced nonsmall cell lung carcinoma[J].Cancer,2005,104(6): 1271-1280.
[13] Bargellini I, Bozzi E, Cioni R,etal.Radio-frequency ablation of lung tumours. Insights[J].Imaging,2011,2(5):567-576.
[14] 仲樓,丁懷銀,曹飛,等. CT引導經皮穿刺微波消融治療周圍型肺癌27例臨床分析[J].海南醫學,2015,26(7):988-991.
[15] Wolf FJ,Grand DJ,Machan JT,etal.Microwave ablation of lung malignancies:effectiveness,CT findings,and safety in 50 patients[J].Radiology,2008,247(3):871-879.
[16] Yashiro H,Nakatsuka S,Inoue M,etal.Factors affecting local progression after percutaneous cryoablation of lung tumors[J].J Vasc Interv Radiol,2013,24(6):813-821.
[17] Vogl TJ,Worst TS,Naguib NN,etal.Factors influencing local tumor control in patients with neoplastic pulmonary nodules treated with microwave ablation:a risk-factor analysis[J].AJR Am J Roentgenol,2013,200(3):665-672.
[18] AkboruMH,Dincer ST, Yoney A,etal.Concomitant chemo radio therapy with orally used agents in locally advanced gastric carcinoma:two years results[J].J Clin Oncol,2006,24(18):14127.
[19] 朱良明,李前生,藺玉霞,等.經皮微波熱凝固療法治療周圍型肺癌的近期療效評價[J].中國微創外科雜志, 2006,6(2):115-116.
[20] Cackler S,Abbas G. RFA is an effective alternative to lobectomy for lung cancer[J].JAAPA,2009,22(1):25-28.

