TNF-α對腫瘤微環境中BMSCs生物學特性的影響
向中平,崔向榮,譚彬,田杰,朱靜
骨髓間充質干細胞(bone marrow mesenchymal stem cells,BMSCs)具有易于體外擴增、低免疫源性、腫瘤趨化性等優勢,已成為腫瘤治療的研究熱點[1-3],然而間充質干細胞在腫瘤治療中的安全問題目前尚未解決[4]。研究報道,腫瘤壞死因子α(tumor necrosis factor-α,TNF-α)是由巨噬細胞、NK細胞、腫瘤細胞等產生的促炎因子[5],其作用具有劑量依賴性,低濃度的TNF-α能夠導致細胞DNA損壞、活化核轉錄因子κB(nuclear factor-κB,NF-κB)信號通路,進而促進腫瘤的發生發展[6-7]。本研究通過BMSCs與C6腦膠質瘤細胞間接共培養以模擬體外BMSCs腫瘤生長的微環境,進一步探討共培養后BMSCs TNF-α表達的變化情況,以明確TNF-α與BMSCs生物學特性改變之間的關系,進而為BMSCs臨床安全應用奠定理論及實驗基礎。
1 材料與方法
1.1 實驗動物及材料 30只清潔級SD雄性大鼠,3~4周齡,體重30~50g,購自重慶醫科大學實驗動物中心。大鼠C6腦膠質瘤細胞系由重慶醫科大學附屬兒童醫院腫瘤實驗室惠贈。DMEM/F12培養基、胎牛血清、TrypLE Express細胞消化液購自美國Gibco公司,0.4μm Transwell小室購自美國Millipore公司,大鼠TNF-α ELISA試劑盒購自中國四正柏公司,快速RNA提取試劑盒購自中國百泰克公司,反轉錄以及熒光定量PCR試劑盒購自日本TaKaRa公司,CCK8細胞活力檢測試劑盒購自中國ATGene公司,PI染液、CD90購自美國BD公司,CD29購自美國Biolegend公司,CD34、CD45購自美國Origene公司,c-Myc、NF-κB/P65、CyclinD1抗體購自英國Abcam公司。引物由上海生工生物工程股份有限公司合成。
1.2 方法
1.2.1 原代細胞獲取、鑒定 分離大鼠的股骨和脛骨,用無血清培養基沖洗骨髓腔,1000r/min離心5min,10%胎牛血清的DMEM/F12培養基重懸以獲取大鼠BMSCs。48h后換液,當細胞融合至80%~90%時傳代,當細胞傳至第3代時備用。取第3代BMSCs,向其中加入CD90、CD29、CD34、CD45抗體(1:100),室溫避光孵育30min,同時設立同型陰性對照。PBS洗2次去除殘余抗體后,采用流式細胞儀檢測。
1.2.2 細胞培養 BMSCs、C6腦膠質瘤細胞均采用含10%胎牛血清的DMEM/F12培養基,于37℃、5%CO2的孵育箱中培養。BMSCs間接共培養模型的建立采用0.4μm懸掛式小室結合6孔板的方式,培養至第3代的BMSCs以1×105/ml的密度鋪入6孔板,過夜后插入Transwell小室,小室上鋪入C6腦膠質瘤細胞,兩種細胞的比例調整為1:1,每天換液,共培養7d。
1.2.3 ELISA檢測BMSCs及共培養細胞上清中游離TNF-α的表達 當細胞融合度為70%~80%時,更換新鮮培養基,24h后收取細胞上清,1000r/min離心10min,保存至–80℃備用。向包被孔中加入100μl上清,37℃孵育90min;洗板4次后,加入100μl生物素化抗體,37℃孵育60min;同樣洗板4次后,加入100μl酶標結合物,37℃孵育30min;再次洗板后加入100μl顯色劑,37℃孵育15min,加入100μl終止液,于酶標儀上讀取450nm吸光度(OD)值,然后將OD值進一步換算成相應上清中TNF-α的表達濃度。每組設4個復孔。
1.2.4 細胞分組及形態觀察 在共培養體系中加入不同濃度的TNF-α。實驗分為4組:BMSCs組、共培養組、共培養+0.5ng/ml TNF-α組、共培養+5ng/ml TNF-α組。采用倒置顯微鏡觀察各組細胞形態變化,拍照,觀察并記錄細胞形態。
1.2.5 CCK8法檢測細胞活力 取各組對數期生長的細胞,消化離心重懸,調整細胞密度為2.5×104/ml,種入96孔板,共設置5個時間點,每個時間點設5個復孔。每天給對應孔中更換10% CCK8工作液,換液后放入孵育箱繼續培養2h,然后于酶標儀上讀取450nm處OD值。根據每天OD值的變化繪制相應的活力曲線。
1.2.6 流式細胞術檢測細胞周期 各組細胞消化后離心重懸,PBS洗2次,棄上清,70%的乙醇4℃固定過夜,PBS洗2次去除乙醇,37℃孵育30min,10μl RNase37℃孵育20min,PI染液染色后用流式細胞儀進行檢測。
1.2.7 Transwell檢測細胞遷移能力 Transwell上室加入200μl細胞數為2×104個的無血清培養基細胞懸液,下室加入500μl含10%胎牛血清的培養基,于5%CO2孵育箱中培養24h,擦拭掉上室的細胞,100%濃度甲醇固定,結晶紫染色,倒置顯微鏡下觀察5個視野的細胞遷移數。
1.2.8 Real-time PCR檢測各組細胞c-Myc、CyclinD1 mRNA的表達水平 根據試劑盒說明書的操作步驟提取各組細胞的RNA,然后反轉錄為DNA,以其為模板進行下一步qPCR的擴增。每組設3個復孔,β-actin為內參照,通過2–ΔΔCt計算相對表達量。引物序列如下:c-Myc,正義5'-TGGAACGTCAGAGGAGAAACGA-3',反義5'-CTTGAACGGACAGGAT GTAGGC-3';CyclinD1,正義5'-GCATCTACACTGACAACTCTATC-3',反義5'-TTGTTC TCATCCGCCTCTG-3';β-actin,正義5'-TGTCACCAACTGGGACGATA-3',反義5'-GGGG TGTTGAAGGTCTCAAA-3'。
1.2.9 Western blotting檢測NF-κB/P65、CyclinD1、c-Myc蛋白表達水平 將各組細胞消化離心,PBS清洗2次后加入適量的蛋白裂解液(裂解液:蛋白酶抑制劑:磷酸酶抑制劑:PMSF=1000:1:10:5),冰上裂解10min左右,然后160W功率的低檔超聲5min,14 000r/min離心15min,收集上清。BCA法測定蛋白濃度,以蛋白﹕SDS=4:1比例加入SDS上樣緩沖液,煮沸3~5min使其變性,–80℃保存備用。蛋白上樣量為40μg,經電泳后濕轉入PVDF膜,5% BSA室溫封閉2h,一抗[NF-κB/P65(1:2000)、CyclinD1(1:1000)、c-Myc(1:8000)、GAPDH(1:5000)]4℃孵育過夜,TBST洗膜,二抗(辣根過氧化物酶標記的山羊抗兔IgG 1:3000)室溫孵育1h,TBST再次洗膜,采用凝膠成像發光系統顯影。
1.3 統計學處理 采用SPSS 17.0進行統計分析。計量資料以表示,BMSCs與共培養細胞上清中TNF-α表達比較采用獨立樣本t檢驗;其余多組間的比較采用單因素方差分析,進一步兩兩比較采用LSD-t檢驗。P<0.05為差異有統計學意義。
2 結 果
2.1 BMSCs表面標志物的鑒定 流式細胞儀檢測結果顯示,CD90表達率為99.6%,CD29表達率為100.0%,CD45表達率為0.1%,CD34表達率為1.7%(圖1)。本實驗提取細胞的CD29、CD90呈陽性表達,CD34、CD45呈陰性表達,表明該細胞為間充質干細胞,可用于后續研究。
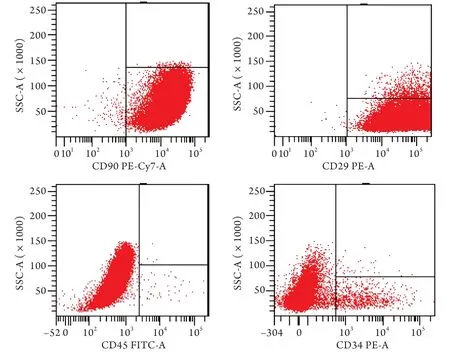
圖1 BMSCs表面標志物表達Fig.1 Expressions of the surface marker of BMSCs
2.2 細胞上清中游離TNF-α的表達 BMSCs細胞上清中游離TNF-α的表達量為(467.90±150.98)pg/ml,共培養細胞上清中游離TNF-α表達量為(162.45±31.82)pg/ml,共培養細胞上清中TNF-α表達量明顯低于BMSCs細胞上清(P<0.05)。
2.3 各組細胞的形態特征 倒置顯微鏡下觀察結果顯示,細胞培養至第3代時,BMSCs組細胞排列整齊、成纖維狀樣生長、胞質豐富;共培養組的BMSCs細胞體積變小、形態細長、核質比增大;共培養+0.5ng/ml TNF-α組細胞排列紊亂,集落樣生長;共培養+5ng/ml TNF-α組細胞形態與BMSCs組基本一致,但凋亡細胞增多(圖2)。
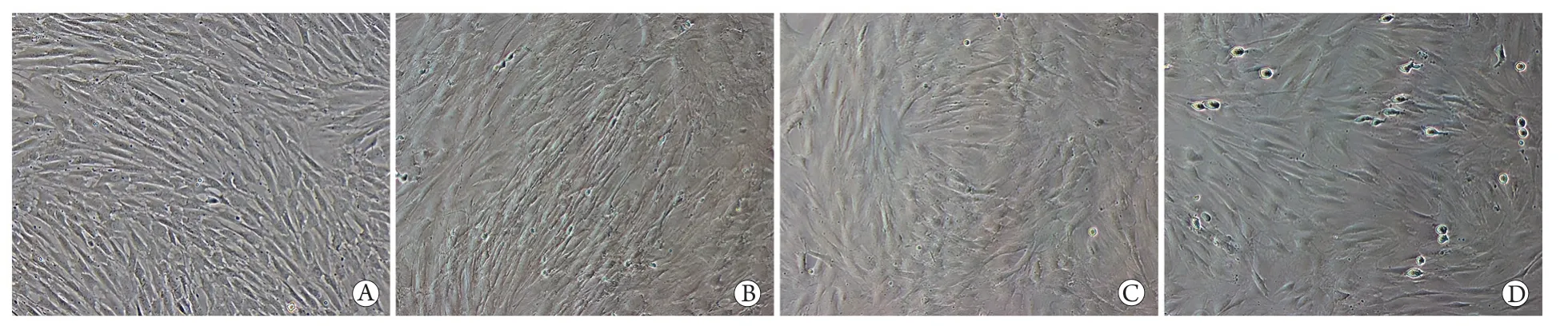
圖2 倒置顯微鏡下觀察各組細胞形態(×100)Fig.2 Morphology of each group of cells (Inverted microscopy,×100)
2.4 各組細胞增殖能力的變化 CCK8檢測結果顯示,自第2天開始,共培養組增殖能力即明顯高于BMSCs組(P<0.05),而共培養+5ng/ml TNF-α組的增殖能力與共培養+0.5ng/ml TNF-α組及共培養組比較明顯降低(P<0.05,圖3)。

圖3 CCK8法檢測各組生長速率的變化Fig.3 Cell proliferation of each group detected by CCK8
2.5 各組細胞周期的改變 流式細胞儀檢測結果顯示,共培養組中G2+S期比例明顯高于BMSCs組(P<0.05),共培養+5ng/ml TNF-α組G2+S期比例與共培養+0.5ng/ml TNF-α組及共培養組比較明顯降低(P<0.05,表1)。
表1 流式細胞術檢測各組細胞周期時相的變化(±s,n=3)Tab.1 Distribution of cell cycle phase of each group detected by flow cytometry (±s, n=3)
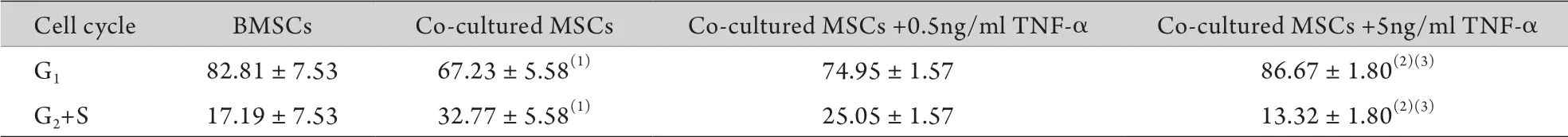
表1 流式細胞術檢測各組細胞周期時相的變化(±s,n=3)Tab.1 Distribution of cell cycle phase of each group detected by flow cytometry (±s, n=3)
(1)P<0.05 compared with BMSCs; (2)P<0.05 compared with co-cultured MSCs; (3)P<0.05 compared with co-cultured MSCs+0.5ng/ml TNF-α
Cell cycle BMSCs Co-cultured MSCs Co-cultured MSCs +0.5ng/ml TNF-α Co-cultured MSCs +5ng/ml TNF-α G1 82.81±7.53 67.23±5.58(1) 74.95±1.57 86.67±1.80(2)(3)G2+S 17.19±7.53 32.77±5.58(1) 25.05±1.57 13.32±1.80(2)(3)
2.6 各組細胞遷移能力的變化 Transwell檢測結果顯示,BMSCs組細胞遷移數為21.67±3.79,共培養組細胞遷移數為66.33±6.03,共培養+0.5ng/ml TNF-α組細胞遷移數為59.00±3.61,共培養+5ng/ml TNF-α組細胞遷移數為20.67±5.13,共培養組細胞遷移能力高于BMSCs組(P<0.05),而共培養+5ng/ml TNF-α組細胞遷移能力與共培養+0.5ng/ml TNF-α組及共培養組比較明顯降低(P<0.05,圖4)。

圖4 Transwell檢測細胞遷移能力改變(×100)Fig.4 Migration ability of each group detected by Transwell
2.7 各組CyclinD1、c-Myc mRNA的表達 Realtime PCR檢測結果顯示,共培養組中CyclinD1、c-Myc mRNA的表達高于BMSCs組(P<0.05)。而共培養+5ng/ml TNF-α組CyclinD1、c-Myc mRNA表達水平與共培養+0.5ng/ml TNF-α組及共培養組比較均明顯降低(P<0.05,圖5)。
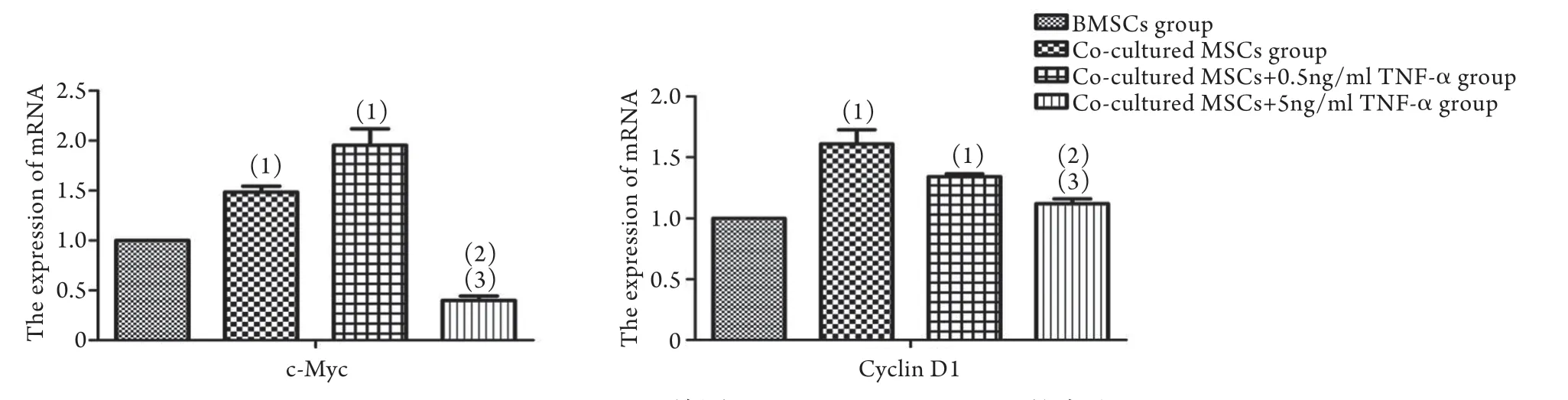
圖5 Real-time PCR檢測c-Myc、CyclinD1 mRNA的表達Fig.5 The mRNA expressions of c-Myc and CyclinD1 (Real-time PCR)
2.8 各組NF-κB/P65、CyclinD1、c-Myc蛋白的表達 Western blotting檢測結果顯示,共培養組中NFκB/P65、CyclinD1、c-Myc蛋白的表達高于BMSCs組(P<0.05)。而共培養+5ng/ml TNF-α組NF-κB/P65、CyclinD1、c-Myc蛋白表達與共培養+0.5ng/ml TNF-α組及共培養組比較均明顯降低(P<0.05,圖6)。

圖6 Western blotting檢測各組c-Myc、NF-κB/P65、CyclinD1蛋白的表達Fig.6 Protein expressions of c-Myc, NF-κB/P65 and CyclinD1 (Western blotting)
3 討 論
腦膠質瘤惡性程度高、復發率高、平均生存率低,而傳統治療手段如手術、放療、化療未能達到滿意治療效果,尋找更為有效的治療方法迫在眉睫[8]。間充質干細胞具有低免疫源性、易于體外擴增,并能作為載體攜帶化療藥物、細胞因子、溶瘤病毒等生物活性成分對腫瘤進行靶向治療而成為當前腫瘤治療的研究熱點[1]。然而,間充質干細胞在腫瘤治療中存在風險,長期體外培養、基因編輯、進入體內受微環境復雜因素的影響等均可使間充質干細胞發生惡性轉變[9]。課題組前期研究結果表明,BMSCs在C6腦膠質瘤微環境中可發生惡性轉化[10],可能的機制涉及白介素-6/信號轉導與轉錄活化因子3(interleukin-6/signal transducer and activator of transcription 3,IL-6/STAT3)、NF-κB、S100B/晚期糖基化終產物受體(S100B/the receptor of advanced glycation end products,S100B/RAGE)等的表達升高[11-13],那么此過程是否還有其他相關因素參與,目前尚未見文獻報道。
TNF-α是由巨噬細胞、NK細胞、中性粒細胞等產生的促炎因子,其對腫瘤的作用具備雙向性,既擁有抗瘤能力也具備促瘤特性,濃度至關重要,高濃度TNF-α可選擇性破壞腫瘤血管系統、產生特異性T細胞而發揮抗瘤效應,而低濃度TNF-α與受體結合,可活化NF-κB信號通路[6-7]。NF-κB信號通路的高表達及活化能促進細胞增殖,抑制細胞凋亡,從而促進腫瘤的發展[14],同時,活化的NF-κB能進一步誘導IL-6的表達上調,進而引發STAT3磷酸化,STAT3的表達升高與腫瘤的發生發展密切相關[15-17]。在課題組前期研究基礎上,本研究從TNF-α的角度出發,探討不同濃度狀態下的TNF-α對腫瘤微環境中BMSCs生物學特性的影響。
Ganapathi等[18]報道,腫瘤細胞中TNF-α DNA甲基化水平的升高導致TNF-α分泌降低,低表達的TNF-α使得腫瘤細胞惡性程度增強。本研究發現,共培養后BMSCs TNF-α表達明顯降低,因此我們推測低表達的TNF-α可能是引發BMSCs惡性轉化的重要因素。故筆者在間接共培養基礎上分別加入高低濃度的TNF-α,結果發現,與共培養組、共培養+0.5ng/ml TNF-α組相比,共培養+5ng/ml TNF-α組細胞生長速度減慢、G2+S期比例降低、遷移能力降低,NF-κB、CyclinD1、c-Myc等的表達均明顯降低。生長速度快、G2+S期比例低、遷移能力強等均為腫瘤細胞較為重要的生物學特性[19],而CyclinD1是由CCND1基因編碼的蛋白,是細胞周期中的一個重要啟動子,在腫瘤中多高表達[20]。c-Myc原癌基因的激活與大多數腫瘤發生密切相關,參與腫瘤細胞增殖、凋亡、衰老、分化等過程[21]。共培養組中加入較高濃度的TNF-α對維持BMSCs生物學特性的穩定有重要作用。因此筆者認為,共培養后BMSCs TNF-α的表達降低可能會誘導NF-κB表達增加,進而引發下游增殖、周期等相關蛋白表達,從而導致BMSCs產生腫瘤相關生物學行為。
綜上所述,C6腦膠質瘤微環境能使BMSCs產生部分腫瘤相關生物學特性改變,共培養后BMSCs中TNF-α表達降低可能是導致上述改變的重要因素,而維持適宜濃度的TNF-α對間充質干細胞起保護作用。本研究為間充質干細胞的臨床安全應用提供了理論依據,但其具體機制尚需進一步探討。

