乳腺癌改良根治術后放療患者上肢淋巴水腫與腋淋巴結手術結果的相關性分析
張順康,孫麗云,陳 剛
上海市黃浦區中心醫院放療科,上海 200002
隨著近年來乳腺癌綜合治療技術的不斷進步,乳腺癌患者的長期生存率明顯提高,5年總體生存率已達85%以上[1]。越來越多的乳腺癌患者在取得長期生存獲益的同時,也面臨著治療相關不良反應的威脅。乳腺癌相關淋巴水腫(breast cancer-realated lymphedema,BCRL)是一種乳腺癌治療后常見的不良反應[2]。由于其發生、發展過程可貫穿于乳腺癌患者的整個生存過程中[3],因此,BCRL對乳腺癌患者來說是一種終生性的威脅。
BCRL常表現為患側上肢進行性加重的水腫,造成患肢不適從而影響患者的日常行為[4];嚴重者可出現水腫部位反復感染,并導致肢體疼痛、功能障礙,甚至發生惡性腫瘤,明顯降低了患者的生存質量[5-7]。淋巴水腫在病理生理學上分為早期可逆和后期不可逆兩個階段[8]。而美國國家淋巴水腫網絡在2012年即指出淋巴水腫在可逆階段的早期診斷治療對于改善患者癥狀和提高生存質量的重要性[9]。
已知的可增加BCRL發生風險的乳腺癌治療相關因素包括腋淋巴結清掃術(axillary lymphnode dissection,ALND)、區域淋巴結放療及化療等[10-15]。ALND作為乳腺癌改良根治術的組成部分,由于其破壞腋窩淋巴引流系統的解剖結構,對BCRL發生、發展的影響更為直接。在已發表的相關研究結果中,關于ALND的具體結果對BCRL的影響卻鮮有報道。本研究擬通過對乳腺癌改良根治術后放療患者BCRL發生情況的觀察,重點分析患者ALND結果(包括陽性淋巴結個數、切除淋巴結總數及兩者的比值,即淋巴結陽性率)與發生BCRL之間的相關性,并同時分析患者年齡、體質量指數(body mass index,BMI)和其他治療相關因素(化療、靶向治療、內分泌治療及放療范圍等)對BCRL發生的影響,為篩選BCRL高危患者、開展BCRL的早期診斷治療工作提供一定的臨床依據。
1 資料和方法
1.1 患者的收集與篩選
前瞻性收集2015年1月1日—12月31日在上海市黃浦區中心醫院放療科行乳腺癌改良根治術后放療的患者。在放療開始前,每例患者均需進行入組篩選。
入組條件:① 符合2014版NCCN乳腺癌治療指南[16]中規定的術后放療指征的18~80歲女性乳腺癌改良根治術后患者;② 采用NSABP B-04研究[17]中BCRL的上肢周徑測量診斷法與診斷標準,明確放療開始前無BCRL;③ 患者放療前已完成輔助化療或由于某些因素無法繼續完成化療;④ 無近期患側上肢外傷史。
排除條件:① 男性乳腺癌患者;② 放療開始前已有BCRL或伴有由于靜脈原因(深靜脈血栓)、腫瘤復發、低蛋白血癥、心因性、腎性及內分泌功能異常等因素引起的水腫;③ 有新輔助化療情況或未行化療的乳腺癌患者;④ 放療開始前已有局部復發及遠處轉移情況。
按照上述條件進行收集和篩選,期間共有202例患者符合入組條件。放療開始前對所有入組患者均測量身高和體質量以獲得BMI。定義BMI<24為正常體質量范圍,BMI≥24為超重[18]。所有入組患者放療前進行血常規與生化指標檢查、胸部攝片、全身B超檢查、心電圖及心臟彩超等常規檢查以初步排除放療禁忌證、腫瘤復發及遠處轉移等情況。在放療定位前由主治醫師向患者詳細告知放療的治療內容及須知的細節(包括患側上肢功能鍛煉方法及上肢淋巴水腫風險與預防內容的告知),并簽署《放射治療知情同意書》。
1.2 術后放療
術后放療采用CT模擬定位。CT圖像經重建后傳輸至Eclipse 11治療計劃系統,完成靶區與正常器官的勾畫。放療靶區包含患側胸壁;對于pN1-3期的患者增加鎖骨上野的照射,鎖骨上野的范圍包括同側Ⅳ區頸淋巴結及腋窩第Ⅲ組淋巴結;對于原發腫瘤位于乳房內側象限或中央區并且伴有腋窩淋巴結轉移的患者增加內乳淋巴結區的照射;放療靶區按照RTOG乳腺癌放療靶區勾畫圖譜介紹的范圍進行勾畫[19]。胸壁及區域淋巴結的放療處方劑量為5周內50 Gy/25次。放療計劃采用6~8野的逆向調強放療計劃。
1.3 上肢周徑測量與淋巴水腫的診斷
入組患者分別在放療開始前、放療結束時及結束后3、6、9、12個月隨訪中進行上肢周徑的測量。患者上肢周徑的測量由放療科醫師進行操作,測量工具采用統一規格的軟皮尺,測量精度為1 mm。上肢周徑的測量部位與淋巴水腫的診斷標準均采用NSABP B-04研究[17]中的方案。具體測量方法為:患者取直立位并自肩關節以下裸露雙側手臂,手臂先自然下垂,然后手心朝前手臂輕微外展固定;醫師明確標注測量部位,具體測量部位為雙側手臂的肩峰下15 cm處及尺骨鷹嘴下15 cm處;醫師將軟皮尺沿測量部位手臂繞一周,讀取周徑數值并記錄。如有患側上肢任一測量部位周徑超過健側上肢相同測量部位2 cm者即診斷為BCRL[17]。
1.4 統計學處理
記錄患者從放療開始至放療結束后12個月的BCRL發生情況,對于觀察期內未完成放療或出現局部復發及遠處轉移的患者予停止觀察并且不進入最后的統計。將患者年齡、陽性淋巴結個數、切除淋巴結總數及淋巴結陽性率4個連續變量做單因素方差分析;將BMI、化療、內分泌治療、靶向治療及放療范圍5個分組變量做單因素χ2檢驗;對單因素分析有意義的變量進行Cox回歸多因素分析。統計軟件采用IBM SPSS Statistics version 19.0,作圖采用Graph Pad Prism 6.0軟件。P<0.05為差異有統計學意義。
2 結 果
2.1 患者臨床特征
入組的202例乳腺癌術后患者均順利完成放療。其中,197例患者完成了放療結束后12個月的隨訪觀察;1例患者放療結束4個月后出現胸壁轉移而停止觀察;4例患者在放療完成后的12個月內失訪,且失訪前未發生BCRL。197例患者的臨床特征分布見表1。
2.2 上肢周徑測量結果與BCRL的發生情況
所有入組患者均完成了上肢周徑測量數據的收集。觀察期內共有38例患者診斷為BCRL,發生率為19.3%(38/197)。
入組患者因缺乏乳腺癌改良根治術前的上肢周徑測量數據,故將放療前測量的上肢周徑作為初始參考值。除38例診斷為BCRL的患者外,其余患者在觀察期內的上肢周徑測量結果與初始參考值比較的變化均在1 cm以內。
不同時間段BCRL的發生情況見圖1。
2.3 BCRL影響因素的單因素分析
將患者的年齡、切除淋巴結總數、陽性淋巴結個數及淋巴結陽性率做均值的單因素方差分析,將BMI、輔助化療、靶向治療、內分泌治療及放療范圍等做單因素χ2檢驗,具體數據見表2。
單因素分析結果顯示,切除淋巴結總數、陽性淋巴結個數及淋巴結陽性率與BCRL的發生具有相關性。
2.4 BCRL影響因素的多因素分析
根據單因素分析結果,在Cox回歸多因素分析中將陽性淋巴結個數、切除淋巴結總數與淋巴結陽性率作為協變量進行分析,結果見表3。多因素分析結果顯示,腋淋巴結切除總數是影響BCRL發生的獨立危險因素,而陽性淋巴結個數與淋巴結陽性率并非影響BCRL發生的獨立危險因素。
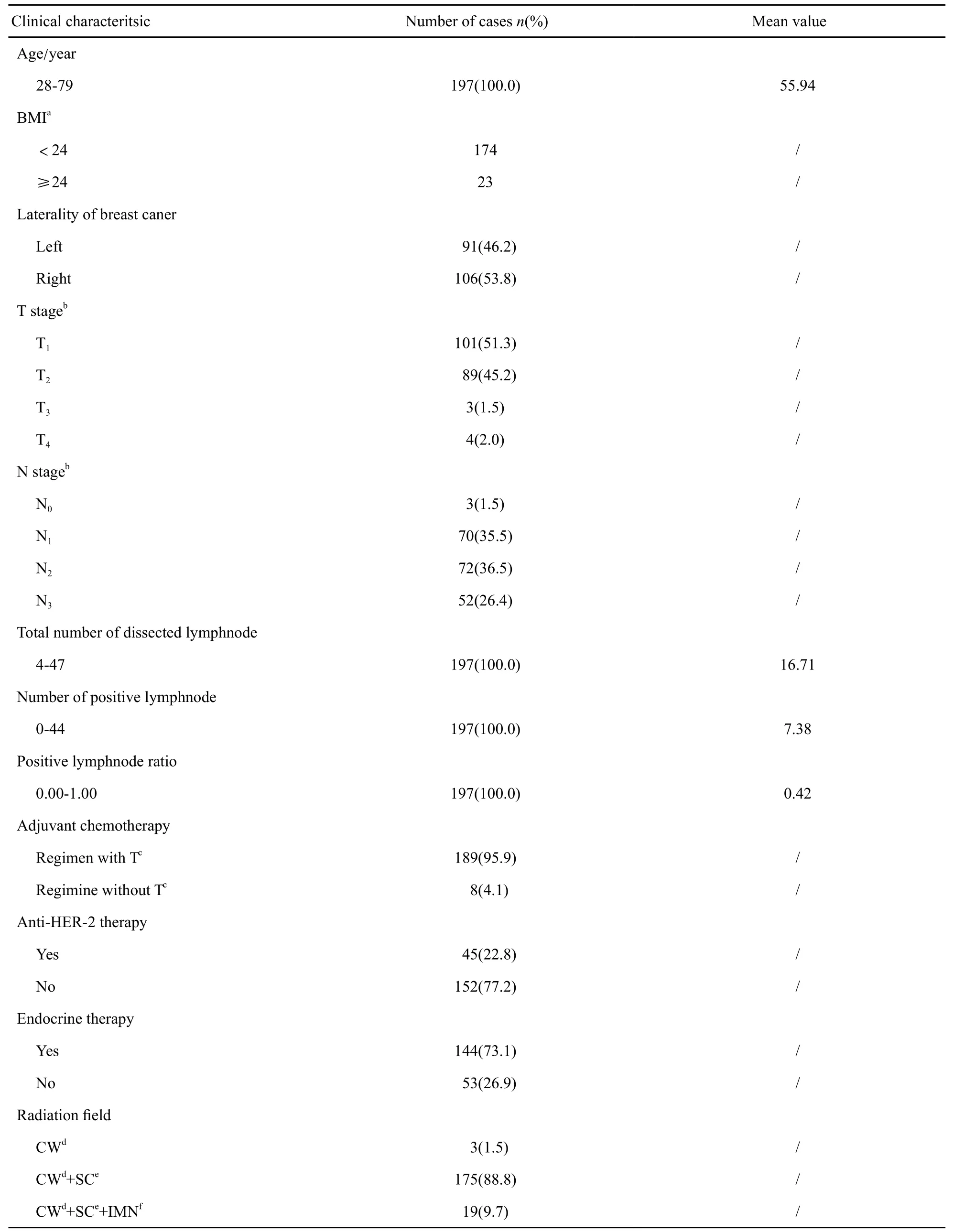
表 1 197例患者的臨床特征分布Tab. 1 Clinical characteristics distribution of 197 patients
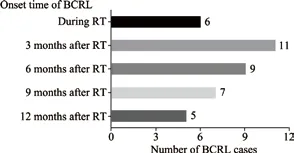
圖 1 不同時間段BCRL的發生情況Fig. 1 The onset of BCRL in different time peroid
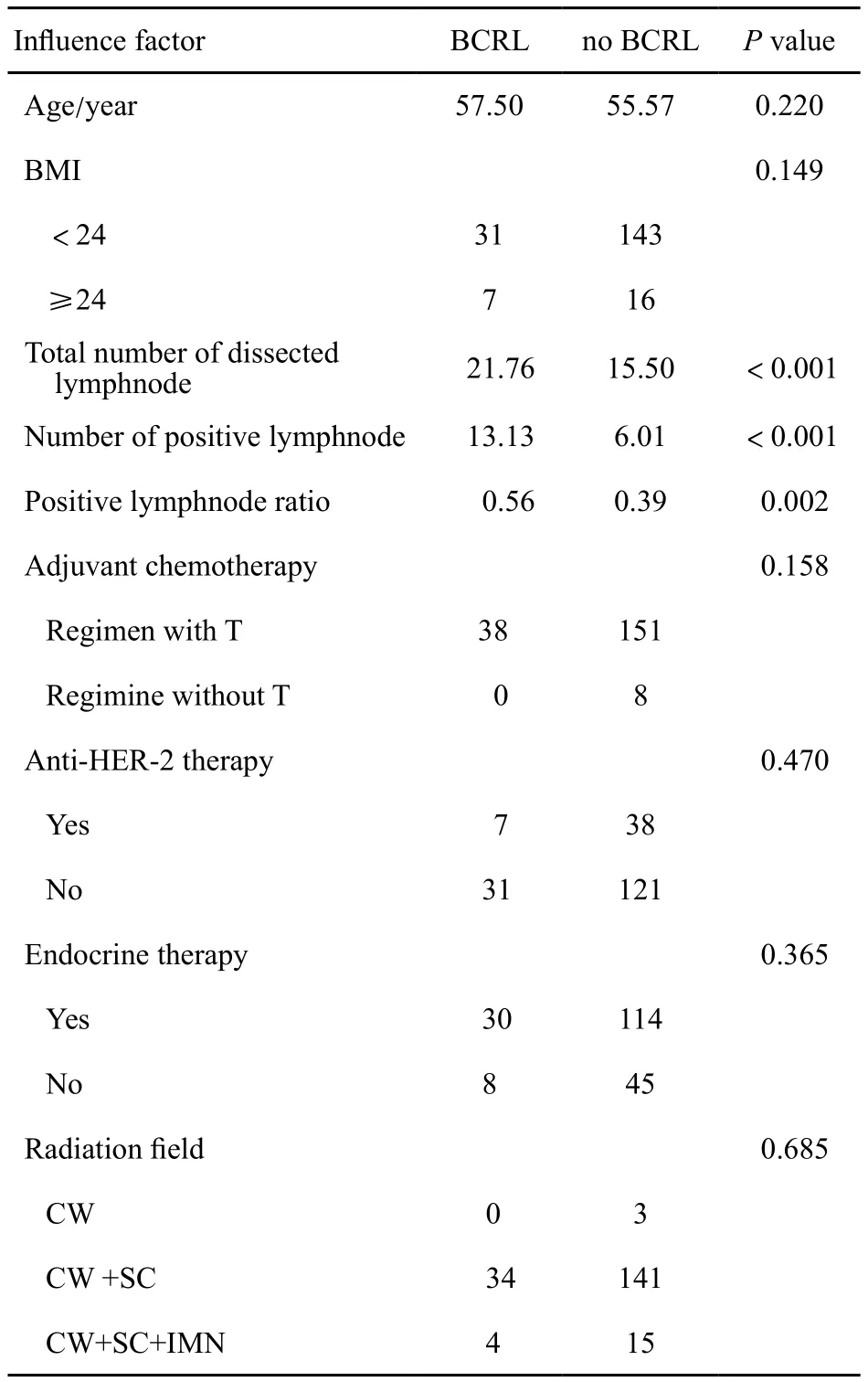
表 2 BCRL影響因素的單因素分析Tab. 2 Univariate analysis of inf l uence factors on BCRL
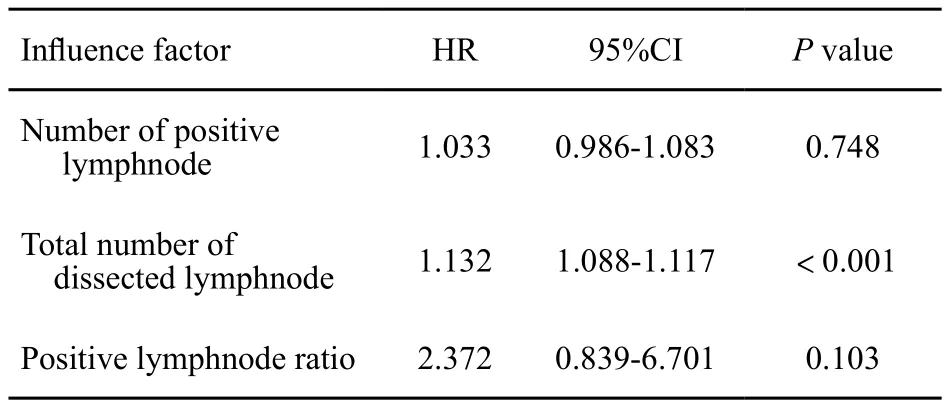
表 3 BCRL影響因素的多因素分析Tab. 3 Multivariate analysis of inf l uence factors on BCRL
3 討 論
本研究以BCRL這一乳腺癌常見的治療相關不良反應作為研究對象,在通過采用上肢周徑測量法隨訪觀察197例乳腺癌改良根治術后放療患者的BCRL發生情況后,發現這些患者的腋淋巴結手術結果與BCRL的發生有一定的相關性。其中切除淋巴結總數在單、多因素分析中均顯示與BCRL的發生密切相關,差異有統計學意義,提示切除淋巴結總數的增加是BCRL的獨立危險因素。盡管多因素分析排除陽性淋巴結個數和淋巴結陽性率的獨立危險因素地位,但單因素分析結果顯示,兩者的增加的確提高了患者BCRL的發生風險。而在本研究的患者中,年齡、BMI及其他治療相關因素(化療方案是否含紫杉醇、靶向治療、內分泌治療及放療范圍)均對BCRL的發生無顯著影響。
關于切除淋巴結總數對BCRL發生風險的影響已有一些相關的研究報道[10-13,20-22]。Paskett等[11]觀察622例年齡不超過45歲的乳腺癌患者術后3年的淋巴水腫發生情況后同樣分析得出,手術切除淋巴結個數的增加導致了淋巴水腫發生風險的提升(HR=1.02,P<0.01)。Hayes等[12]的單中心大樣本隊列研究發現,乳腺癌保乳手術患者的淋巴水腫發生率隨著腋淋巴結切取個數的增加而增加,且水腫的嚴重程度也隨之加重(P<0.001)。
在過去的20年中,乳腺癌的手術治療越來越提倡減少切除范圍以降低手術相關損傷發生率,但在總體療效方面并未作出妥協。例如,在腋窩淋巴結的術式方面,相關研究結果顯示,前哨淋巴結活檢(sentinel lymphnode biopsy,SLNB)陰性的乳腺癌患者10年隨訪區域淋巴結復發率不到1%,遠低于ALND陰性患者的區域淋巴結復發率[23]。一項隨訪時間長達15年的針對老年早期(T1N0)乳腺癌患者的臨床研究同樣顯示,與SLNB比較,ALND的臨床獲益非常有限:兩者的腫瘤遠處轉移率、總體生存率及乳腺癌專項死亡率均較為接近,而SLNB組患者的腋窩復發率僅為6%[24]。而在SLNB顯示有陽性淋巴結而行ALND的乳腺癌患者中,有50%的患者術后病理證實為僅存在前哨淋巴結轉移[25]。另有兩項隨機研究結果顯示,在前哨淋巴結轉移的患者中,接受ALND治療后無病生存率及總體生存率并無明顯的改善[26-27]。因此,對于早期乳腺癌患者來說,SLNB已經可以作為替代傳統的ALND成為區域淋巴結評價的有效手段,并在減少手術相關損傷的同時而不影響整體療效。因此,在有效評估區域淋巴結分期的前提下,盡量減小腋窩手術范圍、減少淋巴結切取總數對于預防和減少BCRL的發生有更加顯著的意義。
陽性淋巴結個數與淋巴結陽性率提示區域淋巴結的腫瘤進展程度。在已報道的BCRL相關風險的研究中,幾乎沒有將這兩者直接作為研究目標的,而腫瘤分期與BCRL發生的相關性研究卻有一些。Clough-Gorr等[28]對660例Ⅰ~Ⅲ期乳腺癌患者7年隨訪觀察發現,Ⅱ~Ⅲ期患者較Ⅰ期患者的淋巴水腫發生風險明顯增加(OR=1.77)。Shah等[10]的研究同樣顯示,Ⅱ~Ⅲ期患者較Ⅰ期患者的淋巴水腫發生率明顯升高(10.8% vs 2.9%,P<0.001)。吳佳等[29]對92例乳腺癌患者回顧性分析后發現,腋窩淋巴結陽性和陰性患者的BCRL發生率分別為41.5%和11.1%(P=0.005),而Ⅲ期患者對比0~Ⅱ期患者,BCRL發生率則分別為52.5%和17.3%(P=0.000)。上述研究結果均顯示,腫瘤的進展程度與BCRL發生風險存在正相關,這與本研究的結果是基本一致的。結合BCRL發生的病理生理學機制進行分析,淋巴水腫的發生與局部淋巴循環結構破壞、淋巴液運輸能力不足有關,當乳腺癌患者腫瘤累及腋淋巴結,腫瘤細胞破壞淋巴結的正常結構而使得腋窩局部淋巴循環受到影響,在受影響程度未達到一定閾值時不會表現出局部水腫,卻增加了腋淋巴結清掃及放療后發生BCRL的潛在風險;亦或在受累淋巴結超過一定數量后則可能直接造成水腫,這也是為何部分患者在初診時已經有患側上肢水腫的原因。
本研究結果顯示,切除淋巴結總數增加是乳腺癌改良根治術后放療患者發生BCRL的唯一獨立危險因素,然而并不代表腋窩手術是本研究入組患者發生BCRL的唯一原因。Nguyen等[30]在對超過1 700例乳腺癌患者的大樣本隊列研究中發現,接受ALND與放化療的患者的5年BCRL累積發生率最高,達到25%以上;在單純手術治療的患者中,行SLNB或ALND的兩組患者間5年BCRL的累積發生率差異無統計學意義(4.1% vs 3.5%,P=0.36);而在接受ALND的患者中,放療和未放療患者的5年BCRL累積發生率的差異則有統計學意義(9.5% vs 3.5%,P=0.01)。提示BCRL的發生與多種治療模式共同作用有關,而非手術單獨作用的結果。本研究入組患者恰符合Nguyen等的研究隊列中BCRL風險最高的一組患者的特征,雖因觀察時間稍短而未達到25%以上的BCRL累積發生率,但本研究中38例患者BCRL的發生同樣也是手術、放療等多種治療因素共同作用結果。
綜上所述,乳腺癌改良根治術后放療患者的BCRL發生情況與腋淋巴結手術結果之間存在相關性,其中切除淋巴結總數增加是BCLR的獨立危險因素。對于切除淋巴結總數較多的患者,我們在制定術后相關治療方案時要充分重視其較高的BCRL發生風險,并對這部分患者進行更加密切的隨訪觀察,以便對其淋巴水腫做出早期診斷和早期治療。
[1] ALLEMANI C, WEIR H K, CARREIRA H, et al. Global surveillance of cancer survival 1995—2009:analysis of individual data for 25,676,887 patients from 279 populationbased registries in 67 countries (CONCORD-2) [J]. Lancet,2015, 385(9972): 977-1010.
[2] ERICKSON V S, PEARSON M L, GANZ P A, et al. Arm edema in breast cancer patients[J]. J Natl Cancer Inst,2001, 93(2): 96-111.
[3] PETREK J A, SENIE R T, PETERS M, ROSEN P P, et al.Lymphedema in a cohort of breast carcinoma survivors 20 years after diagnosis [J]. Cancer, 2001, 92(6): 1368-1377.
[4] KARADIBAK D, YAVUZSEN T. Evaluation of kinesthetic sense and hand function in women with breast cancer-related lymphedema [J]. J Phys Ther Sci, 2015, 27(6): 1671-1675.
[5] CLARK B, SITZIA J, HARLOW W. Incidence and risk of arm oedema following treatment for breast cancer:a three-year follow-up study [J]. QJM, 2005, 98(5): 343-348.
[6] GELLER B M, VACEK P M, O’BRIEN P, et al. Factors associated with arm welling after breast cancer surgery [J].J Women’s Health, 2003, 12(9): 921-932.
[7] HUANG H P, ZHOU J R, ZENG Q. Risk Factors Associated with lymphedema among postmenopausal breast cancer survivors after radical mastectomy and axillary dissection in China [J]. Breast Care, 2012, 7(6): 461-464.
[8] BRORSON H, OHLIN K, OLSSON G, et al. Adipose tissue dominates chronic arm lymphedema following breast cancer:ananalysis using volume rendered CT images [J]. Lymphat Res Biol, 2006, 4(4): 199-210.
[9] National Lymphedema Network. National lymphedema network supplement to the national lymphedema network position statement breast cancer screening: Screening and early detectionof breast cancer-related lymphedema: the imperative.http://www.lymphnet.org/ pdfDocs/PP_Lymphedema_BC_Supplement.pdf
[10] SHAH C, WILKINSON J B, BASCHNAGEL A, et al. Factors associated with the development of breast cancer-related lymphedema after whole-breast irradiation [J]. Int J Radiat Oncol Biol Phys, 2012, 83(4): 1095-1100.
[11] PASKETT E D, NAUGHTON M J, MCCOY T P, et al. The epidemiology of arm and hand swelling in premenopausal breast cancer survivors [J]. Cancer Epidemiol Biomarkers Prev, 2007, 16(4): 775-782.
[12] HAYES S B, FREEDMAN G M, LI T, et al. Does axillary boost increase lymphedema compared with supraclavicular radiation alone after breast conservation? [J]. Int J Radiat Oncol Biol Phys, 2008, 72(5): 1449-1455.
[13] KIM M, KIM S W, LEE S U, et al. A model to estimate the risk of breast cancer-related lymphedema: combinations of treatment-related factors of the number of dissected axillary nodes, adjuvant chemotherapy, and radiation therapy[J].Int J Radiat Oncol Biol Phys, 2013, 86(3): 498-503.
[14] MILLER C L, SPECHT M C, SKOLNY M N, et al. Risk of lymphedema after mastectomy: potential benefit of applying ACOSOG Z0011 protocol to mastectomy patients [J].Breast Cancer Res Treat, 2014, 144(1): 71-77.
[15] DONKER M, VAN TIENHOVEN G, STRAVER M E, et al.Radiotherapy or surgery of the axilla after a positive sentinel node in breast cancer (EORTC 10981-22023 AMAROS): a randomised, multicentre, open-label, phase 3 non-inferiority trial [J]. Lancet Oncol, 2014, 15(12): 1303-1310.
[16] National Comprehensive Cancer Network. NCCN Clinical Practice Guidelines in Oncology: Breast Cancer, Version 3.2014. http://www.nccn.org/profe- ssionals/physician_gls/pdf/breast.pdf.
[17] DEUTSCH M, LAND S, BEGOVIC M, et al. The incidence of arm edema in women with breast cancer randomized on the National Surgical Adjuvant Breast and Bowel Project study B-04 to radical mastectomy versus total mastectomy and radiotherapy versus total mastectomy alone[J]. Int J Radiat Oncol Biol Phys, 2008, 70(4): 1020-1024.
[18] 中華人民共和國國家衛生和計劃生育委員會. WS/T 455—2014衛生監測與評價名詞術語 [Z]. 2014-11-15.
[19] LI X A, TAI A, ARTHUR D W, et al. Variability of target and normal structure delineation for breast cancer radiotherapy: an RTOG multi-institutional and multiobserver study[J]. Int J Radiat Oncol Biol Phys, 2009, 73(3): 944-951.
[20] YEN T W, FAN X, SPARAPANI R, et al. A contemporary,population-based study of lymphedema risk factors in older women with breast cancer [J]. Ann Surg Oncol, 2009,16(4): 979-988.
[21] PAIVA D M, LEITE I C, RODRIGUES VDE O, et al.Associated factors of lymphedema in breast cancer patients[J]. Rev Bras Ginecol Obstet, 2011, 33(2): 75-80.
[22] HONARVAR B, SAYAR N, TAHMASEBI S, et al. Correlates of lymphedema in women with breast cancer: a case control study in Shiraz, Southern Iran [J]. Asian Pac J Cancer Prev, 2016, 17(S3): 81-86.
[23] VERONESI U, VIALE G, PAGANELLI G, et al. Sentinel lymph node biopsy in breast cancer:ten-year results of a randomized controlled study [J]. Ann Surg, 2010, 251(4):595-600.
[24] MARTELLI G, BORACCHI P, ARDOINO I, et al. Axillary dissection versus no axillary dissection in older patients with T1N0 breast cancer: 15-year results of a randomized controlled trial [J]. Ann Surg, 2012, 256(6): 920-924.
[25] KIM T, GIULIANO A E, LYMAN G H. Lymphatic mapping and sentinel lymph node biopsy in early-stage breast carcinoma:a metaanalysis [J]. Cancer, 2006, 106(1): 4-16.
[26] GALIMBERTI V, COLE B F, ZURRIDA S, et al. Update of International Breast Cancer Study Group trial 23-01 to compare axillary dissection versus no axillary dissection in patients with clinically node negative breast cancer and micrometastases in the sentinel node [J]. Cancer Res,2011, 71(24 Suppl): S3-1.
[27] GIULIANO A E, HUNT K K, BALLMAN K V, et al. Axillary dissection vs no axillary dissection in women with invasive breast cancer and sentinel node metastasis:a randomized clinical trial [J]. JAMA, 2011, 305(6): 569-575.
[28] CLOUGH-GORR K M, GANZ P A, SILLIMAN R A. Older breast cancer survivors:factors associated with self-reported symptoms of persistent lymphedema over 7 years of follow-up[J]. Breast J, 2010, 16(2): 147-155.
[29] 吳 佳, 朱雅群, 田 野, 等. 乳腺癌放療后上肢淋巴水腫的調查及危險因素分析 [J].臨床腫瘤學雜志, 2013,18(10): 905-909.
[30] NGUYEN T T, HOSKIN T L, HABERMANN E B, et al. Breast cancer-related lymphedema risk is related to multidisciplinary treatment and not surgery alone: results from a large cohort study [J]. Ann Surg Oncol, 2017, 24(10): 2972-2980.

