使用不同胰酶消化PK15細胞對比試驗
張小蘭
福州大北農生物技術有限公司 福州 350014
PK15 細胞(Porcine Kidney Eplithelial cells),也稱PK15或PK(15)。來源于豬腎,中文名為豬腎上皮細胞,父母代源自1955年美國Stice提供的成年豬腎細胞 PK-2a,被 ATCC 收藏(CCL-33)[1]。 PK15細胞對豬圓環病毒、豬細小病毒、豬瘟病毒等多種病毒比較敏感,已廣泛應用于獸用疫苗的研究和生產[2]。PK15細胞是已經癌變了的細胞,具有很強的生長和增殖能力,正常情況下可以無限地傳代[3]。但在實際培養中,細胞常常會出現不穩定的生長情況,反復傳代后,隨著傳代次數的增多,可能出現細胞慢慢表現為生長不良、細胞變老、狀態變差直至不能繼續傳代等情況。在實際生產傳代中發現,細胞消化是影響細胞生長狀態好壞的關健因素之一。胰蛋白酶是細胞原代培養和傳代過程中經常用到的水解酶[4],其通過在特定位置上降解蛋白,使細胞間結合處蛋白降解,這時細胞在自身內部細胞骨架的張力作用下成為球形,從而使細胞分開。不同組織或細胞對胰酶的作用反應不一樣,且胰酶分散細胞的活性與其種類、濃度、溫度和作用時間、消化程度、消化液殘留量等都有關。所以,為了給生產疫苗提供更好細胞狀態的PK15細胞,提高疫苗質量,本試驗通過對比胰酶A與胰酶B的消化效果及對細胞的影響,目的在于尋找一種對細胞更溫和、損傷更小的消化液,為生產疫苗提供優良狀態的細胞。
1 材料與方法
1.1 細胞 PK15細胞株,大北農集團北京動物醫學研究中心提供。
1.2 培養基 MEM購自gibco公司。
1.3 細胞消化液 0.25%胰酶A與0.25%胰酶B均購自某公司。
1.4 試驗方法
1.4.1 細胞制備 取一瓶處于對數生長期、細胞狀態良好的PK15細胞進行消化傳代,按一定的分種比例分出8瓶等量的T75細胞。隨機分為a、b、c、d四組,每組2瓶T75細胞。
1.4.2 細胞消化 各組細胞培養72 h后,使用胰酶A對a、b組細胞進行消化,即棄去細胞培養液,用37℃預熱處理的PBS清洗細胞兩遍,每遍25 mL,再用胰酶A 4 mL消化細胞,待細胞出現圓縮分離時,a組細胞消化完棄去消化液,加6 mL含5%血清的營養液終止消化并進行吹打細胞,分種后進行培養,b組細胞消化后不棄去消化液直接加入營養液終止消化,分種后進行培養。使用胰酶B對c、d組細胞進行消化即棄去細胞培養液,用37℃預熱處理的PBS清洗細胞兩遍,每遍25 mL,再用胰酶B 4 mL消化細胞,待細胞出現圓縮分離時,c組細胞消化完棄去消化液,加6 mL含5%血清的營養液終止消化并進行吹打細胞,分種后進行培養,d組細胞消化后不棄去消化液直接加入營養液終止消化,分種后進行培養。
1.4.3 觀察記錄 記錄各組細胞消化終止時間、細胞分散效果,以及培養24 h、48 h、72 h時細胞的生長狀態等。
2 結 果
2.1 胰酶A與B對細胞消化的影響 胰酶A的消化終止時間為5~6 min,胰酶B的消化終止時間為1~2 min,消化終止時間上相差較大。細胞消化后,胰酶A的分散效果均較好,呈大部分幾個細胞狀態,24 h細胞分裂也明顯,細胞狀態較好。胰酶B消化細胞,消化液棄去的細胞消化后基本處于單個狀態,24 h細胞分裂也明顯;但消化液不棄的團塊較大,24 h生長不均勻,細胞分裂不明顯,細胞生長較慢。見表1。
2.2 胰酶A與B對細胞生長狀態的影響 使用胰酶A消化PK15細胞,無論消化液棄去還是不棄去,細胞生長情況與細胞狀態都較理想。使用胰酶B消化細胞時,消化液棄去,細胞生長狀態好,與胰酶A差異不明顯;而消化液不棄去,細胞狀態變差、生長變緩慢,到72 h時,細胞才長到約80%密度,細胞有圓縮脫落現象。見表2。
3 小結與討論
1)試驗結果表明,使用0.25%胰酶A消化PK15細胞,無論消化液是否棄去,消化終止時間較0.25%胰酶B更長,細胞分散效果均處于幾個細胞狀態,細胞生長狀態好。使用0.25%胰酶B消化PK15細胞,當消化液棄去時,細胞分散情況與細胞生長狀態都較好;而消化液不棄時,細胞消化后團塊大,生長變緩慢、狀態變差,這應該與胰酶B對細胞的毒性有關,當胰酶殘留量大時,對細胞有一定的損傷,導致細胞狀態變差、生長緩慢。而胰酶A比較溫和,即使有殘留,對細胞損傷不大,細胞仍能穩定生長。所以,0.25%胰酶A較0.25%胰酶B溫和,消化液棄去與否,細胞的消化與生長都理想。
2)胰酶B為動物源性的消化酶,而胰酶A是利用微生物生產的一種比較溫和的非動物源性消化酶,其動力學性質和裂解特異性均與胰酶B類似[5]。但胰酶A純度更高,室溫保存穩定性高,對細胞損傷更小。本試驗使用0.25%胰酶A、0.25%胰酶B消化PK15細胞,通過對比了解兩種胰酶對PK15細胞消化和生長的影響,為實際生產提供參考依據。

表1 胰酶A與B對細胞消化的影響
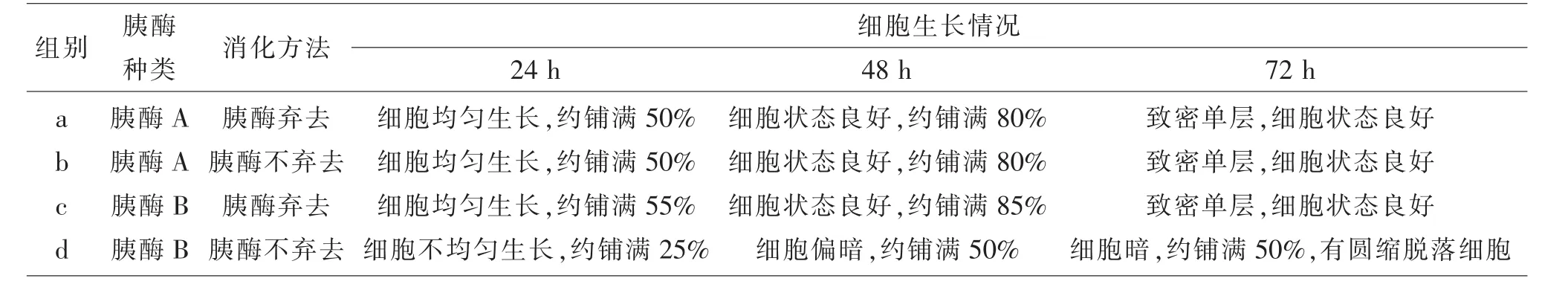
表2 胰酶A與B對細胞生長的影響
[1]周利鋒.V1-2滅活疫苗生產用PK15細胞庫和PCV1-2種毒庫的建立及鑒定[D].揚州:揚州大學,2011.
[2]魏園園,馬忠仁,王家敏,等.PK15細胞的生物學特性和質量評價研究[J].黑龍江農業科學,2015(5):61-65.
[3]陸有飛,高永銳.不同濃度胰蛋白酶對PK15細胞傳代消化的影響[J].廣西畜牧獸醫,2004,20(2):56-57.
[4]靳輝,楊蓬勃,馮改豐,等.胰蛋白酶消化強度優化獲得高純度體外的星形膠質細胞[J].生理學報,2015,67(1):103-109.
[5]周新華,張在軍,于沛.大腦皮層神經元原代培養方法的改良及一種體外缺氧缺糖簡易模型的建立 [J].中南藥學,2014,12(5):439-442.

