非體外循環冠狀動脈旁路移植術患者圍手術期血管麻痹與血漿精氨酸血管加壓素水平的關系分析
(鄭州市第七人民醫院,河南 鄭州 450000)
非體外循環冠狀動脈旁路移植術(coff-pump CABG,coronary-artery bypass grafting,OPCABG)可有效降低體外循環所帶來的炎癥反應,其手術風險及術后并發癥發生風險均低于傳統體外循環冠狀動脈旁路移植術(ONCABG)[1],該特點使OPCABG治療方式在國內逐漸普及。但近年研究發現,OPCABG易引起血流動力學變化,使患者術后早期出現持續低血壓、外周血管低阻力、心臟指數正常或升高等表現,引起血管麻痹綜合征(vasoplegic syndrome,VS)[2]。VS可促進患者心臟做功,增加心臟負荷,導致心臟功能衰竭,當VS患者體循環阻力下降時,可引起組織灌注不足和酸中毒,給手術效果及患者預后帶來嚴重影響[3]。精氨酸血管升壓素(AVP)是下丘腦視上核和室旁核神經元分泌的九肽激素,可促進血管平滑肌收縮,降低血管床容量,增加外周阻力,從而發揮升高血壓的作用[4]。本研究通過觀察OPCABG患者圍手術期血漿AVP水平,分析AVP變化與VS的關系,現報告如下。
1 資料與方法
1.1 一般資料
選取2015年2月~2018年2月在鄭州市第七人民醫院行OPCABG后發生VS的患者41例設為VS組,其中男27例,女14例;平均年齡(60.21±6.37)歲;NYHAⅠ~Ⅱ級者19例,NYHAⅢ級者14例,NYHAⅣ級者8例;既往病史有高血壓者28例,糖尿病者15例,腦卒中者3例,陳舊心梗者8例,吸煙史者12例。選取同期行OPCABG未發生VS且基本資料與VS組匹配的患者69例,設置為非VS組。
1.2 VS診斷標準[5]
術后6~8 h內肺平均動脈壓(MAP)<70 mmHg,心臟指數(CI)≥2.5 L·min-1·m-3,外周血管阻力指數(SVRI)<1 400 dyn·s·cm-5·m-2,排除擴血管藥物或血容量不足引起的持續低血壓,采取補液等相關治療無明顯改善。
1.3 手術方法
患者均行靜脈吸入復合麻醉,監測患者基本生命體征及心電圖,經鎖骨下或頸內靜脈穿刺置入Swan-Ganz導管,通過中心靜脈予以肝素1 mg/kg靜脈推注,暴露目標血管,通過氣霧噴射器及心臟穩定器顯露吻合口,移植血管后吻合,移植結束后予以肝素魚精蛋白(1∶1)拮抗。
1.4 觀察指標
分別采用抗凝管收集患者術前(T1)、術中30 min(T2)、予以魚精蛋白后10 min(T3)、術畢(T4)、術后2 h(T5)、術后24 h(T6)動脈血各5 mL,高速離心后取血漿,置于-80℃冰箱內保存,采用放射免疫法檢測血漿AVP水平,試劑盒購自江蘇科晶生物科技有限公司;記錄兩組患者置入即刻、術畢、術后2 h、6 h、24 h的MAP、中心靜脈壓(CVP)、肺毛細血管楔壓(PCWP)、CI、SVRI變化。
1.5 統計學方法
2 結果
2.1 兩組血漿AVP水平 (見表1)及血流動力學參數(見表2) 對比情況

表1 兩組患者不同時間段血漿AVP水平對比
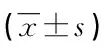
表2 兩組患者不同時間段血流動力學參數對比
注:1)表示VS組與非VS組各參數比較P<0.05
3 討論
目前對VS的致病機制并不十分清楚,主要觀點傾向于全身炎癥反應與縮血管物質分泌減少。OPCABG的非體外循環模式使全身炎癥反應較傳統ONCABG輕,因此縮血管物質的分泌減少成為誘發和形成VS的最可能原因[6]。AVP半衰期較短,釋放入血的AVP僅維持10~35 min,而AVP的合成釋放需要約90 min,當機體長時間處于低血容量狀態時,垂體內AVP可能消耗完全。當出現AVP受體功能降低或AVP分泌量較少時,心臟手術患者血管收縮能力降低,手術過程中高排低組的狀態無法代償,外周血管阻力下降,加重再灌注缺血缺氧狀態,機體無法維持灌注壓,造成VS。
本研究監測OPCABG患者手術前后血漿AVP水平及血流動力學變化,分析VS的發生與血漿AVP水平的關系。結果顯示,VS患者在手術結束時MAP開始降低,在術后2 h VS患者的MAP、SVRI均低于非VS患者,CI高于非VS患者,到術后6 h患者MAP、PCWP、SVRI降低幅度最大,CI明顯升高;而同時VS患者術中血漿AVP水平雖有升高,但與非VS患者比較相對不足,差異顯著。VS患者血流動力學各參數變化與血漿AVP水平變化基本一致,這進一步證實血漿AVP水平的相對降低抑制心臟手術患者血管收縮能力,血管持續擴張以及血管阻力的減小導致患者發生休克,促進VS的產生和進展。因此,當OPCABG患者發生VS,可通過予以大劑量縮血管藥物進行血流動力學支持治療,維持心臟后負荷,改善休克狀態。
總之,圍手術期血漿AVP水平相對降低是導致OPCABG患者發生VS的關鍵因素,為有效預防和治療VS,應持續監測患者手術前后血漿AVP水平及血流動力學變化,及時予以縮血管藥物維持血管壓力,降低手術風險,提高生存質量。

