自體骨膜促進兔肩袖腱骨愈合的療效
趙 楊,戴海峰,劉莎莎,王智慧,李 嘉
(承德醫學院附屬醫院,河北 承德 067000)
手術治療已經成為肩袖撕裂的首選治療方式,然而,無論選擇何種手術方案其術后肩袖再撕裂率在38%~90%之間[1]。如何提高肩袖修復術后的腱-骨界面的愈合能力是目前運動醫學研究焦點,隨著現代組織工程學和生物技術的發展,新的修復技術和材料為解決這一問題提供了思路和方法[2-3],間充質干細胞(mesenchymal stem cells, MSCs),小腸黏膜下層(small intestinal submucosa, SIS),富血小板血漿(platelet-rich plasma, PRP)等得以開發應用以促進腱-骨愈合,但對其效果優劣尚無統一定論。骨膜具有很強的成骨潛能,最新研究表明[4],骨膜移植物可以提供未分化細胞填充腱骨界面間隙,促進腱骨愈合。因此,本研究使用自體骨膜補片加強修復兔急性肩袖撕裂,通過組織學觀察和生物力測試證實自體骨膜補片可以有效地促進肩袖腱骨愈合,提高其生物學特性。報道如下:
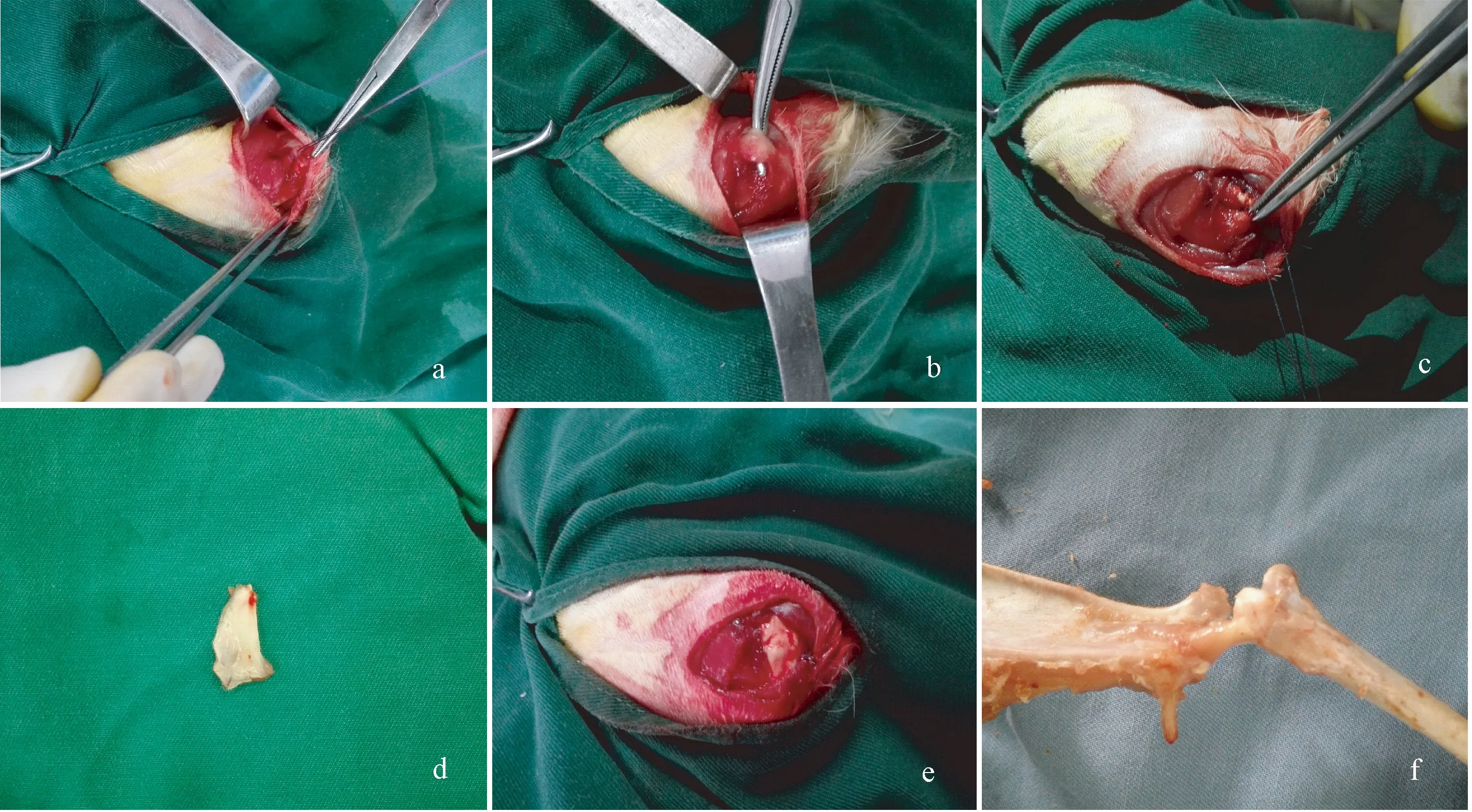
注:a:兔岡上肌肌腱;b:急性岡上肌撕裂模型;c:單純縫合修復岡上肌;d:自體骨膜補片;e:骨膜加強修復岡上肌;f:正常兔骨肌腱連接結構模型。圖1 兔骨肌腱連接結構的制備Note.a: Rabbit supraspinatus tendon. b: Acute rotator cuff tear model. c: Simple suture fixation. d: Autologous periosteum patch. e: Enhanced repair of supraspinatus muscle with the periosteal patch. f: Bone-tendon junction model.Fig.1 Preparation of the rabbit bone-tendon junction
1 材料和方法
1.1 實驗動物
普通級新西蘭兔60只,4~5個月齡,體重2.5~3.0 kg,雌雄各半,由承德醫學院附屬醫院實驗動物中心提供[SCXK(冀)2015-0100],在承德醫學院動物實驗中心分籠飼養[SYXK(冀)20014-0012],常規飲食飲水。并按實驗動物使用的3R原則給予人道的關懷。
1.2 主要試劑和儀器
蘇木精(珠海貝索生物技術有限公司,生產批號717111);伊紅(珠海貝索生物技術有限公司,生產批號717093);Masson三色染色液(珠海貝索生物技術有限公司,生產批號616121);光學顯微鏡(日本Olympus顯微鏡公司);萬能材料試驗機(美國Instron公司);2-0可吸收縫線(美國Depuy公司)等。
1.3 實驗方法
1.3.1 動物分組
新西蘭兔60只建立急性肩袖撕裂模型。每只新西蘭兔隨機選取一側肩關節為實驗組,使用自體骨膜補片加強修復肩袖撕裂,另一側肩關節作為對照組,單純行肩袖縫合術治療,實驗中對動物的處置符合醫學倫理學標準。
1.3.2 手術方法
使用30 g/L的巴比妥鈉按1 mL/kg體重經兔耳緣靜脈麻醉,常規脫毛、備皮、消毒鋪單后,對照組在肩關節做長約2 cm的皮膚縱行切口,鈍性分離三角肌,顯露岡上肌腱性部分,于岡上肌止點處銳性切斷岡上肌肌腱,造成急性肩袖撕裂模型。用直徑1 mm克氏針在大結節上打2平行骨隧道備用,岡上肌止點去皮質新鮮化處理,用2-0可吸收縫線將肩袖殘端原位縫合,尾線穿過骨道固定,縫合后逐層關閉切口;實驗組用相同方法造模后,縱行切開脛骨近端皮膚1 cm,盡量銳性剝去骨膜表面的纖維組織,切取10 mm×5 mm大小的骨膜組織,置于生理鹽水中備用,切取時盡量減少對骨膜生發層的損害,于腱骨止點處骨膜生發層朝向關節側完全覆蓋肩袖斷端,用2-0可吸收縫線將骨膜補片加強修補。見圖1。術后即允許兔自由行走,術后3 d內予肌注慶大霉素(4000 U/d)抗感染,密切觀察新西蘭兔術后活動、進食和傷口愈合情況。
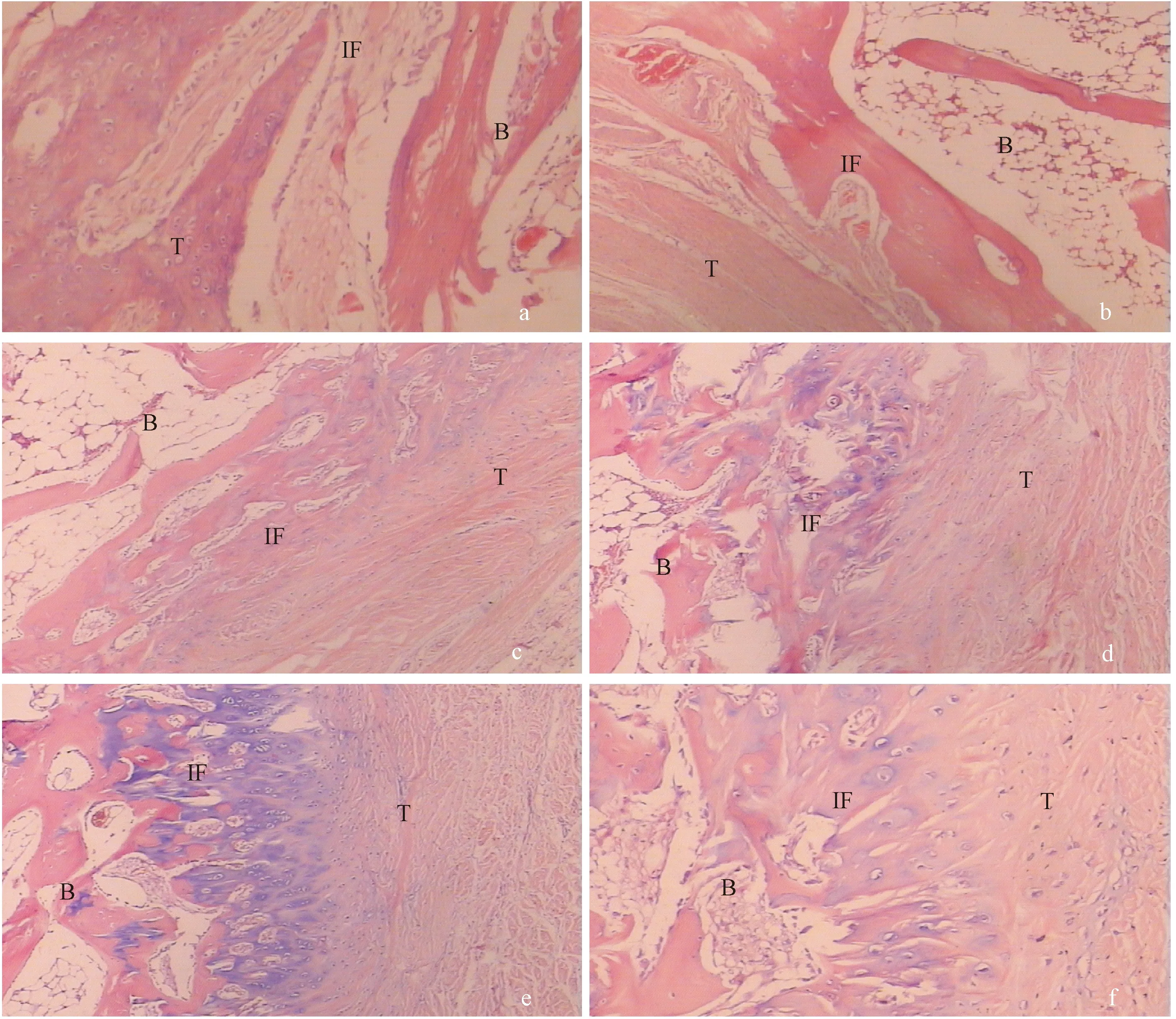
注:a:術后4周實驗組間充質細胞增生明顯,少量軟骨細胞;b:術后4周對照組腱骨間隙明顯,成纖維細胞增生;c:術后8周實驗組大量未成熟軟骨細胞,排列略規整;d:術后8周對照組膠原纖維連接,少量軟骨細胞;e:術后12周實驗組類似正常腱骨界面;f:術后12周對照組腱骨連接不緊密,軟骨細胞排列紊亂。T:肌腱;B:骨;IF:腱骨界面。圖2 兔BTJ組織HE染色(×40)Note.a: At 4 weeks, mesenchymal cells proliferate obviously in the experimental group. b: At 4 weeks, the tendon-bone gap exists and the fibroblast proliferation in the control group. c: At 8 weeks, a large number of immature chondrocytes are arranged in a regular way in the experimental group. d: At 8 weeks, collagen fiber connections are observed in the control group. e: The tendon-bone interface structure is similar to normal in the experimental group at 12 weeks after repair. f: At 12 weeks, disordered arrangement of chondrocytes in the control group. T: tendon. B: bone. IF: tendon-bone interface.Fig.2 Histological changes of the healing process of rabbit bone-tendon tear. HE staining
1.3.3 標本獲取
分別于術后4、8、12周戊巴比妥鈉麻醉后處死新西蘭兔20只,每組10個標本以岡上肌肌腱止點為中心,取肱骨近端包括腱-骨交界面的大結節組織,大小約10 mm×5 mm×5 mm,進行組織學觀察,10個標本保留肱骨和完整的岡上肌組織作為完整的骨-肌腱結合部(bone-tendon junction, BTJ),進行生物力學實驗。
1.3.4 大體觀察
觀察實驗動物的大體情況。
1.3.5 病理學觀察
選取標本以4%甲醛溶液固定3 d,再以100 g/L乙二胺四乙酸(EDTA)脫鈣液充分脫鈣4周,標本再依次脫水、透明、石蠟包埋,制成5 μm層厚的連續切片,分別進行HE染色、Masson染色后光鏡下觀察岡上肌止點腱-骨界面結構的形態學變化。
1.3.6 生物力學測試
選取后的BTJ樣本,用2號Ethibond縫線編織肌腱,用義齒基托包埋肱骨遠端,標本固定后應用萬能材試驗機進行生物力學拉伸試驗,2.5 N為初始負荷,以牽拉速度5 mm/min行拉斷實驗,記錄腱-骨界面承受的最大抗拉力值。
1.4 統計學方法
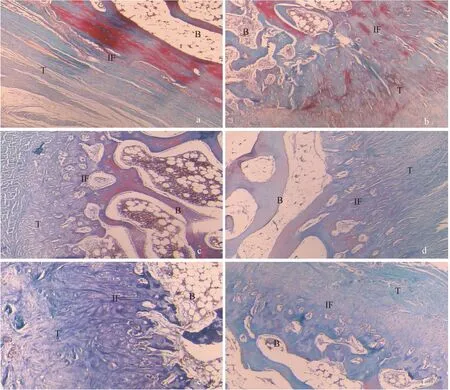
注:a:術后4周對照組可見疏松結締組織;b:術后4周實驗組可見大量膠原纖維排列;c:術后8周對照組膠原纖維連接,瘢痕愈合傾向;d:術后8周實驗組膠原纖維層和軟骨層交錯排列;e:術后12周對照組腱骨界面結構紊亂;f:術后12周實驗組腱骨界面愈合良好;T:肌腱;B:骨;IF:腱骨界面。圖3 兔BTJ組織Masson染色(×200)Note.a: At 4 weeks, loose connective tissue is found in the control group. b:At 4 weeks, a large amount of collagen fibers is observed in the experimental group. c: At 8 weeks, scar healing tendency is observed in the control group. d: At 8 weeks, the collagen fiber layer and cartilage layer are arranged alternately in the experimental group. e: At 8 weeks, a disordered tendon-bone interface in the control group. f: At 8 weeks, the tendon-bone interface healed well in the experimental group. T: Tendon. B: Bone. IFI: Tendon-bone Interface.Fig.3 Histological changes of the healing process of rabbit bone-tendon tear. Masson staining
2 結果
2.1 大體觀察
實驗動物于相同清潔環境中飼養,手術后所有新西蘭兔飲食等健康狀況良好,術前、術后均可自由活動,觀察期間無發熱、切口紅腫等情況發生,術后3 d后新西蘭兔上肢活動情況恢復術前狀況,未發現肢體活動量減少,僵硬等現象。
2.2 組織學觀察
HE染色可以大體觀察到BTJ的組織結構,初步評價愈合效果,Masson染色可以觀察組織的膠原纖維分布,有助于評估肩袖的腱-骨愈合效果。(見圖2,3)
實驗組:術后4周:腱骨間隙不明顯,間充質細胞增生明顯,骨膜內可見少量新生軟骨細胞和基質;術后8周:肌腱膠原纖維束狀排列,腱骨界面可見成骨反應,大量未成熟軟骨細胞,排列略規整,部分向肌腱內長入。術后12周:肌腱與骨結合緊密,肌腱膠原纖維粗大規則,軟骨細胞成熟排列規整,類似正常的腱骨界面結構。
對照組:術后4周:肌腱與骨的間隙較明顯,可見壞死組織,大量炎性細胞浸潤,其內有新生肉芽組織,成纖維細胞增生;術后8周:腱骨間隙由纖維肉芽組織填充,通過大量成纖維細胞和膠原纖維相連,少量軟骨細胞形成,提示瘢痕愈合傾向;術后12周:腱骨間隙模糊,膠原纖維連接,軟骨細胞排列紊亂
2.3 生物力學測試
在生物力學拉伸實驗過程中,所有標本最大負荷時均在岡上肌止點縫合處斷裂;其最大負荷隨術后時間延長而增大,差異有顯著性(P< 0.05);各時間段實驗組最大負荷強度明顯高于對照組,差異有顯著性(P< 0.05)。(見表1)
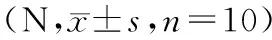
表1 實驗組、對照組不同時間段最大失效負荷對比Tab.1 Comparison of the maximum failure load in the experimental group and control group at different time points
注:與同時間段對照組相比,*P< 0.05;組內與前一時間段相比,#P< 0.05。
Note.Compared with the control group at the same time,*P< 0.05. Compared with the previous period in the same group,#P< 0.05.
3 討論
肩袖損傷修復術后最主要的難題是肩袖止點組織結構無法恢復到正常形態,其病理學研究表明肩袖損傷后的腱骨界面內纖維軟骨層無法再生,僅由瘢痕組織替代,導致形成的間接止點機械性能遠低于正常的直接止點,容易發生再撕裂。隨著人們對肩袖損傷修復過程及腱骨愈合機制的認識不斷加深,不同的治療策略得以開發、應用以促進肩袖損傷后修復效果[5]。最新的研究熱點是如何在肩袖損傷修復基礎上聯合生物增強技術或現代組織工程技術有效的促進肩袖損傷后腱骨愈合[6]。
目前應用較多的促進腱-骨愈合生物工程學方法包括骨形態發生蛋白(bone morphogenetic protein, BMP)、小腸黏膜下層組織(small intestinal submucosa, SIS)、富血小板血漿(platelet-rich plasma, PRP)等。然而,這些治療措施在加速腱骨愈合和降低腱骨界面纖維疤痕組織是有效的,但促進纖維軟骨的形成效果欠佳[7-8]。纖維軟骨區是腱骨連接部位特征性結構,它能夠緩沖應力,減少再撕裂發生,止點處軟骨再生對改善肩袖腱骨愈合質量起重要作用。本研究選用自體骨膜作為補片來源,主要由于骨膜內側含有大量未分化的間充質干細胞(MSCs),MSCs能夠在體內、體外快速增殖,同時具有多向分化能力,可以分化成為成骨細胞和軟骨細胞[9-11]。Lim等[12]在腘肌腱上移植MSCs,發現2周后腱骨界面有大片軟骨細胞形成,8周后有軟骨成熟區形成。在肩袖腱骨愈合過程中,骨膜補片還可產生提高細胞的生長和分化的生物活性因子[13-16],其主要包括轉化生長因子(TGF),BMP-2等,這些生長因子有助于骨膜向軟骨生長和轉化。Chen等[17]在肩袖損傷模型中使用骨形態發生蛋白-骨膜前體細胞水凝膠加強修復腱骨愈合,結果觀察到腱-骨界面組織愈合改善,生物力測試最大載荷明顯提高。此外,使用自體骨膜補片作為修復肩袖撕裂的組織工程支架,具有良好的生物學潛能。張琪等[18]通過對不同方案制備兔脛骨骨膜生物支架研究表明,處理后骨膜支架有良好的生物相容性,滿足生物工程支架要求。
既往動物學研究發現,兔的岡上肌形態和功能與人類相似,兔在籠養時比其他實驗動物上肢單獨活動機會多,本研究采用李奉龍等[19]的兔急性肩袖損傷的造模方法對肩袖的腱骨愈合進行研究。李衛國等[20]和陳百成等[21]研究證明骨膜成軟骨能力隨年齡增加而降低,但成年兔骨膜受刺激后再生軟骨能力可恢復,此外,脛骨近端的骨膜切取具有取材方便、并發癥少、對實驗肢體活動無影響等優點。多篇研究[22-24]通過動物模型研究證實肩袖修復術后需要8~12周的愈合時間,而肩袖補片需要8~10周的時間吸收降解,因此,本研究采用4、8和12周三個觀察時間點能更充分的說明自體骨膜補片對肩袖腱-骨愈合的影響。結果表明使用自體骨膜補片加強修復肩袖,在組織學方面,腱骨愈合早于對照組,并且肌腱與骨結合緊密,軟骨細胞排列規整,類似正常的腱骨界面結構,其腱骨連接緊密程度及止點軟骨細胞排列明顯優于單純修復組;在力學方面,實驗組修補術后各時間階段岡上肌腱抗牽拉強度也明顯高于對照組,利于術后早期康復鍛煉。此外,筆者認為在臨床實踐中,使用骨膜補片加強修復肩袖適用于肩袖撕裂直徑>5 cm的巨大型撕裂,尤其對于術前病程長,MRI顯示肩袖回縮嚴重,質地差,脂肪浸潤超過50%的老年患者,手術自體骨膜切取應避免副損傷發生。
綜上所述,使用自體骨膜作為補片來源能有效提高肩袖腱骨愈合強度,縮短腱骨愈合時間,有良好的生物學特性,為臨床上提高肩袖損傷修復手術成功率提供了一定的實驗基礎,但本研究還需進一步的臨床試驗證實。
[1] Abtahi AM, Granger EK, Tashjian RZ. Factors affecting healing after arthroscopic rotator cuff repair[J]. World J Orthop, 2015, 6(2): 211-220.
[2] Degen RM, Carbone A, Carballo C, et al. The effect of purified human bone marrow-derived mesenchymal stem cells on rotator cuff tendon healing in an athymic rat[J]. Arthroscopy, 2016, 32(12): 2435-2443.
[3] Tahririan MA, Moezi M, Motififard M, et al. Ultrasound guided platelet-rich plasma injection for the treatment of rotator cuff tendinopathy[J]. Adv Biomed Res, 2016, 5: 200.
[4] 張俊瑋, 陸海濤, 楊宇明, 等. 低溫培養對骨膜細胞成軟骨分化的影響[J]. 中華實驗外科雜志, 2016, 33(5): 1281-1283.
[5] Dewan AK, Petre BM, Wilckens JH, et al. Factors affecting perceptions of open, mini-open, and arthroscopic rotator cuff repair techniques among medical professionals[J]. Am J Orthop (Belle Mead NJ), 2015, 44(9): E317-325.
[6] Thangarajah T, Pendegrass CJ, Shahbazi S, et al. Augmentation of rotator cuff repair with soft tissue scaffolds[J]. Orthop J Sports Med, 2015, 3(6): 2325967115587495.
[7] Lannotti JP, Codsi MJ, Kwon YW, et al. Porcine small intestine submucosa augmentation of surgical repair of chronic two-tendon rotator cuff tears. A randomized, controlled trial[J]. J Bone Joint Surg Am, 2006, 88(6):1238-1244.
[8] 張頡鴻, 吳海山. 肩袖修復后促進腱骨界面軟骨再生的研究進展[J]. 中國矯形外科雜志,2016,24(14): 1299-1303.
[9] Hernigou P, Flouzat Lachaniette CH, Delambre J, et al. Biologic augmentation of rotator cuff repair with mesenchymal stem cells during arthroscopy improves healing and prevents further tears: a case-controlled study[J]. Int Orthop, 2014, 38(9): 1811-1818.
[10] 康少平, 劉淑艷, 李永升, 等. 低氧增強骨髓間充質干細胞增殖維持分化潛能[J]. 中國比較醫學雜志, 2017, 27(7): 70-74.
[11] 劉薇, 史俊文, 岳敏,等. 西藏小型豬肋軟骨細胞的分離培養及鑒定[J]. 中國比較醫學雜志, 2013, 23(3): 1-3, 86, 80.
[12] Lim JK, Hui J, Li L, et al. Enhancement of tendon graft osteointegration using mesenchymal stem cells in a rabbit model of anterior cruciate ligament reconstruction[J]. Arthroscopy, 2004, 20(9): 899-910.
[13] Mara CS, Sartori AR, Duarte AS, et al. Periosteum as a source of mesenchymal stem cells: The effects of TG-3 on chondrogenesis[J]. Clinics (Sao Paulo), 2011, 66(3): 487-492.
[14] 張沖, 李莉. TGF-β1對大鼠肩袖損傷修復術后腱-骨愈合的影響[J]. 醫用生物力學, 2016, 31(2): 167-170.
[15] Klatte-Schulz F, Pauly S, Scheibel M, et al. Characteristics and stimulation potential with BMP-2 and BMP-7 of tenocyte-like cells isolated from the rotator cuff of female donors[J]. PloS One, 2013, 8(6): e67209.
[16] Pauly S, Klatte F, Strobel C, et al. BMP-2 and BMP-7 affect human rotator cuff tendon cells in vitro[J]. J Shoulder Elbow Surg, 2012, 21(4): 464-473.
[17] Chen CH, Chang CH, Wang KC, et al. Enhancement of rotator cuff tendon-bone healing with injectable periosteum progenitor cells BMP-2 hydrogel in vivo[J]. Knee Surg Spotrs Traumatol Arthrosc, 2011, 19(9): 1597-1607.
[18] 張琪, 倪金虎, 林賢豐,等. 兔脛骨骨膜去細胞生物支架制備方案的優化[J]. 中華骨科雜志, 2016, 36(12):785-794.
[19] 李奉龍, 姜春巖, 魯誼,等. 兔肩袖損傷模型的建立及初步組織學研究[J]. 中國組織工程研究, 2012, 16(20): 3685-3689.
[20] 李衛國, 黃向紅, 唐景清,等. 自體骨膜游離移植的實驗研究-不同齡動物大塊關節軟骨缺損修復的比較[J]. 中華創傷骨科雜志, 2005, 7(9): 852-855.
[21] 陳百成, 欒廣, 張展翅, 等. 自體骨膜包裹肌腱對腱骨愈合的影響[J]. 中華骨科雜志, 2006, 26(2): 118-122.
[22] Hirose K, Kondo S, Choi HR, et al. Spontaneous healing process of a supraspinatus tendon tear in rabbits[J]. Arch Orthop Trauma Surg,2004,124(6):374-377.
[23] 張沖,劉玉杰.補片技術修復肩袖損傷的應用研究[J]. 中國微創外科雜志, 2017, 17(2): 179-183.
[24] 任士友, 江長青, 張文濤. 不同肩袖補片特點:應用強度、降解速率及酸性降解物的調控[J]. 中國組織工程研究, 2015, 19(30): 4876-4881.

