局部射頻消融術與開腹手術治療小肝癌臨床效果比較
黃 濤
(巴中市巴州區人民醫院肝膽外科,四川 巴中 636600)
原發性肝癌(Hepatocellular carcinoma,HCC)是我國常見、高發的消化系統惡性腫瘤之一,其死亡率占惡性腫瘤死因的第2位,并且發病率呈逐年上升趨勢。目前手術切除(hepatic resection,HR)仍是治療肝癌的有效方法,但存在創傷較大、術后恢復時間長、肝功能損傷等局限性,射頻消融術(radiofrequency ablation,RFA)是近年來發展起來的經皮非血管介入治療新技術,具有微創、操作簡單、可重復應用、費用低等優點,已廣泛應用于臨床,尤其是對于腫瘤直徑≤5 cm的小肝癌治療,可獲得與手術切除相當的療效[1]。本研究通過對局部射頻消融術與手術切除治療小肝癌療效比較,旨在為臨床小肝癌的治療選擇提供可行性方法。
1 資料與方法
1.1一般資料:以2013年4月~2015年3月我院肝膽外科收治的行射頻消融術(RFA)或行手術切除(SR)的原發性小肝癌患者73例作為研究對象,所有患者均經甲胎蛋白(AFP)、甲胎蛋白異質體(AFP-L3)等血清標志物及影像學檢查(超聲、CT等)或超聲引導下穿刺活檢診斷確診。納入標準參照衛計委《原發性肝癌診療規范》(2011年版)[2]:①腫瘤結節直徑>2 cm且≤5 cm,單發病灶直徑≤5 cm,多發病灶(2~3個),每個直徑≤3 cm;②無肝內大血管侵犯、淋巴結及肝外轉移;③肝功能Child-Pugh分級A或B級,且無肝性腦病、嚴重性腹水病史。根據治療方法將73例患者分為兩組,其中RFA組38例,男29例,女9例,年齡37~72歲,平均年齡(61.3±12.7)歲,手術組35例,男27例,女8例,年齡35~74歲,平均年齡(62.2±13.5)歲,兩組患者性別、年齡、肝功能分級、腫瘤病灶大小等一般資料比較差異無統計學意義(P>0.05),具有可比性。
1.2治療方法
1.2.1RFA組:采用美國RTC公司的RF2000型射頻治療儀,射頻電極針為多極帶鞘針,集束放射狀針群。患者取平臥位,采用局部浸潤麻醉,常規消毒胸腹術野。切開穿刺點皮膚約2 mm,在B超或CT引導下,射頻電極針刺入腫瘤,根據腫瘤大小釋放電極,開啟射頻,初始功率為30~50 W,以后每隔1 min增加10 W,漸增至90 W,待阻抗升至300 Ω以上,計算機控制功率自動降低至10 W以下,即可停止。在原位收回電極但不拔出射頻針,旋轉30°再次消融治療,可重復1~2次,以盡可能減少腫瘤熱凝不完全的情況。
1.2.2手術組:患者取左側臥位,加枕墊高右側腰部使身體向左側傾斜30°~45°,采用氣管插管全醉,術野常規消毒鋪巾,做右肋緣下弧形或反“L”形切口。入腹后做腹腔探查,了解肝臟病變范圍。分離三角韌帶及部分冠狀韌帶及肝十二指腸韌帶,阻斷肝動脈和門靜脈血流后,并逐步將肝實質連同肝內血管和膽管鉗夾、切斷、結扎,根據腫瘤位置決定行腫瘤切除。
1.3觀察指標:①于治療前后分別檢測兩組患者肝功能(ALT、AST、T-BIL、ALB)變化;②觀察記錄兩組患者住院時間及并發癥發生情況;③隨訪統計兩組患者術后1年復發率及1、2、3 年內無瘤生存率(eventfree survival,EFS)和總體生存率(overall survival,OS)。
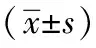
2 結果
2.1兩組患者術后情況比較:RFA組住院時間和并發癥發生率均明顯低于手術組,組間比較,差異有統計學意義(P<0.05),而術后1年兩組患者復發率比較,差異無統計學意義(P>0.05),見表1。
2.2兩組治療前后肝功能指標比較:兩組治療前肝功能指標水平比較差異無統計學意義(P>0.05),治療后RFA組ALT明顯低于手術組,組間比較差異具有統計學意義(P<0.05),其他肝功能指標(AST、T-BIL、ALB)無顯著變化,組間比較差異無統計學意義(P>0.05),見表2。
2.3兩組EFS和OS比較:兩組患者術后1年、2年、3年內無瘤生存率(EFS)和總體生存率(OS)比較,差異無統計學意義(P>0.05),見表3。
表1兩組患者術后情況比較
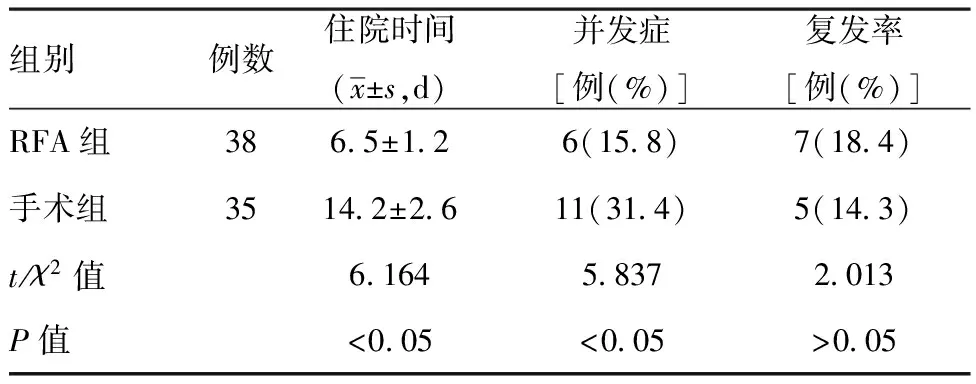
組別例數住院時間(x±s,d)并發癥[例(%)]復發率[例(%)]RFA組3865±126(158)7(184)手術組35142±2611(314)5(143)t/χ2值616458372013P值<005<005>005

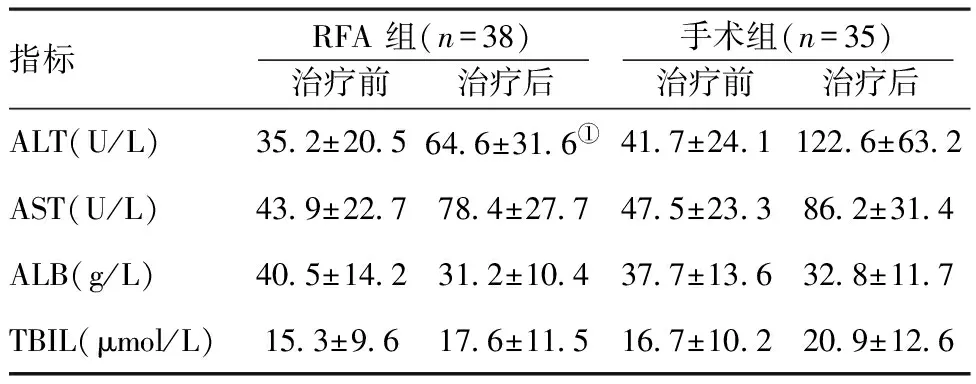
指標RFA組(n=38) 治療前 治療后 手術組(n=35) 治療前 治療后 ALT(U/L)352±205646±316①417±2411226±632AST(U/L)439±227784±277475±233862±314ALB(g/L)405±142312±104377±136328±117TBIL(μmol/L)153±96176±115167±102209±126
注:與手術組比較,t=6.731,①P<0.05
表3兩組患者術后1、2、3 年內EFS和OS比較[例(%)]
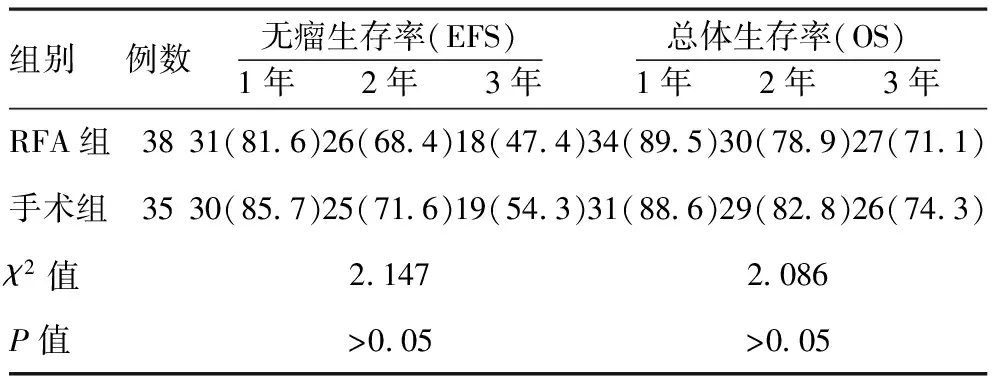
組別例數無瘤生存率(EFS)1年 2年 3年總體生存率(OS)1年 2年 3年RFA組3831(816)26(684)18(474)34(895)30(789)27(711)手術組3530(857)25(716)19(543)31(886)29(828)26(743)χ2值21472086P值>005>005
3 討論
腫瘤大小是影響切除后預后的重要因素。分子病理學研究表明,≤5 cm的小肝癌多以膨脹性生長為主,多有包膜,血管侵犯和肝內轉移發生較少,DNA含量以2倍體為主,生長相對緩慢[3]。近年來隨著甲胎蛋白(AFP)和多種血清標志物聯合檢測,以及醫學影像學技術和分子診斷方法的發展進步,使得微小肝癌(直徑≤2 cm)和小肝癌(直徑>2 cm,≤5 cm)篩查檢出率得到很大提高[4]。早期診斷,并根據不同病情進行針對性早期治療是提高療效的關鍵。既往手術切除是小肝癌患者獲得長期生存的主要途徑,但存在創傷較大、術后恢復時間長、肝功能損傷等局限性,尤其對于不宜、不愿手術切除、肝硬化嚴重及手術切除后早期復發的肝癌患者,采用非手術姑息性治療是較為適宜的選擇[5]。射頻消融術(RFA)是繼經皮無水酒精注射(PEI)后微創非血管介入治療新技術,其原理是組織中的離子在電極的作用下,周圍產生高頻震蕩,相互摩擦產生熱能,達到一定溫度可使組織凝固壞死,即將組織內累積的電磁能轉換為熱能通過熱凝固作用殺滅腫瘤。RFA是利用體內電極的針尖面積小能量集中,而體外電極面積大能量分散的差別,使體內電極的溫度明顯升高,產生蛋白熱凝固壞死作用。當消融溫度保持在50~100℃時可立即使腫瘤組織凝固壞死,并使腫瘤細胞的線粒體及溶酶體發生不可逆的損傷。具有創傷小操作簡單可重復性并發癥少等優點。劉磊采用計算機檢索2006年4月~2011年4月Pubmed數據庫、Wan Fang數據庫、Medline、中國知網(CNKI)等數據庫,收集RFA與HR治療小肝癌療效對照研究的相關文獻[6],通過篩選符合納入標準的高質量文獻10篇,其中中文文獻3篇,英文文獻7篇,采用Meta分析并經漏斗圖評估發表偏移,結果顯示RFA治療直徑≤5 cm小肝癌1、3年無瘤生存率(EFS)和總體生存率(OS)與HR相近,且術后并發癥發生率低于HR,可作為小肝癌首選治療方法之一。
本文結果顯示RFA組住院時間和并發癥發生率均明顯低于手術組,組間比較差異有統計學意義(P<0.05),而術后1年RFA組患者復發率為18.4%,手術組為14.3%,兩組比較無統計學意義(χ2=2.013,P>0.05),兩組治療后肝功能指標水平比較,RFA組ALT明顯低于手術組,組間比較差異具有統計學意義(P<0.05),其他肝功能指標(AST、T-BIL、ALB)無顯著變化,組間比較差異無統計學意義(P>0.05),隨訪1、2、3年兩組患者無瘤生存率(EFS)和總體生存率(OS)比較,差異無顯著性(P>0.05),與國內文獻[7-8]報道基本一致,表明RFA治療直徑≤5 cm小肝癌近、遠期療效與手術切除相當,并具有創傷小、操作簡單、并發癥少、費用低、患者恢復快等優點,可以部分替代手術切除術。
[1] 獨建庫,李冠海,何偉華,等.經皮射頻消融術與根治性切除術在小肝癌治療中的療效研究[J].臨床軍醫雜志,2012,40(3):570.
[2] 國家衛計委.原發性肝癌診療規范(2011年版)[J].中華肝臟病雜志,2012,20(6):929.
[3] 王洪武,楊 仁.腫瘤微創治療技術[M].北京科學技術出版社,2007:295-313.
[4] 曹月敏.小肝癌治療的現狀[J].中國微創外科雜志,2012,12(8):673.
[5] 鹿寧寧,李建軍,鄭加生.射頻消融術治療肝癌的研究進展[J].中華介入放射學電子雜志,2014,2(1):60.
[6] 劉 磊.射頻消融術與手術切除小肝癌的分析[D].新疆醫科大學,2013.
[7] 胡善雷.經皮射頻消融與手術切除治療小肝癌的療效對比分析[J].實用癌癥雜志,2015,30(2):188.
[8] 何秀婷,高普均,徐寶達,等.手術切除與射頻消融治療小肝癌的療效比較[J].臨床肝膽病雜志,29(8):585.

