骨碎補總黃酮基于Notch信號通路改善骨質疏松的作用及機制研究
韓亞力 羅 奕 曾佳學
(六盤水市人民醫院骨科,六盤水 553000)
骨質疏松癥是臨床上較為常見的疾病之一,主要是以骨組織微結構退化、以骨量減少為主要特征[1]。中藥骨碎補具有維持骨微結構的完整程度和提高骨密度等作用[2]。骨碎補總黃酮(Davallia mariesil flavones,DMF)為骨碎補中的主要成分,但關于骨碎補總黃酮改善骨質疏松的機制尚未可知。Notch信號通路中的多個信號分子參與多種疾病的發生和發展過程已被證實[3-5],但是關于Notch信號通路中各個信號分子,包括受體Notch 1、Notch 3及下游靶基因Hes-1家族在骨質疏松患者組織中的表達研究很少。本研究將探討DMF通過抑制Notch信號通路中Notch 1及下游靶基因Hes-1,緩解骨質疏松癥狀的分子機制,期望為骨質疏松治療探索新的治療靶點。
1 材料與方法
1.1材料
1.1.1臨床資料 選取2016年1月~2017年1月間我院收治的120例骨質疏松患者作為研究對象。納入標準:①根據WHO推薦診斷標準確診為骨質疏松;②體力狀況(Performance status,PS)評分0~2分,預計生存期>3個月。排除標準:①合并慢性感染性疾病、心肺功能障礙、惡性腫瘤者或其他重大疾病患者;②合并心理疾病、精神疾病患者。本研究采用回顧性分析的方法,把入選病例隨機分為試驗組和對照組,每組60例,試驗組60例,男29例,女31例,年齡40~86歲,平均(58.3±2.9)歲,體力狀況評分:0~1分40例,2分20例。對照組60例,男30例,女30例,年齡41~84歲,平均(56.9±3.1)歲,體力狀況評分:0~1分43例,2分17例。兩組患者的一般資料性別、年齡、體力狀況比較無明顯差異(P>0.05),資料具有可比性。本研究通過我院倫理委員會審核,所有患者在治療前均知情同意。
1.1.2實驗動物 出生24 h的新生SD大鼠,1月齡SD大鼠,6月齡SD雌性大鼠(由中國科學院上海實驗動物中心提供)。
1.1.3實驗藥物 強骨膠囊(成分為骨碎補總黃酮,davallia mariesil flavones,DMF):國藥準字Z20030007,北京岐黃制藥有限公司生產,規格:DMF 180 mg/粒。
1.1.4主要試劑和儀器 二甲基亞砜(DMSO)、四甲基偶氮唑藍(MTT)均購自Sigma公司;DMEM培養基、胎牛血清、胰蛋白酶均購自Gibco公司;Notch-1、Hes-1及GAPDH一抗均購自Cell Signaling Technology公司;二抗購自碧云天公司;Trizol試劑盒、逆轉錄試劑盒、PCR擴增試劑盒均購自TaKaRa Bio公司;TNF-α、MCP-1、IL-6試劑盒均購自南京生物建成研究所。TGL-16G-A型高速冷凍離心機(上海安亭科學儀器廠);7300型實時熒光定量PCR儀(美國Applied Biosystems公司);基礎電泳儀(美國Bio-Rad公司);酶標儀(Thermo公司);EL204-電子天平(上海特勒-托多利多儀器有限公司);凝膠成像儀(美國Bio-Rad公司);電泳儀(北京六一儀器廠)。
1.2方法
1.2.1治療方法 試驗組用強骨膠囊(國藥準字Z20030007,北京岐黃制藥有限公司生產,規格:DMF 180 mg/粒)聯合治療鈣爾奇D(惠氏一百宮制藥有限公司,維生素D 125 U/片,鈣600 mg/片)治療[6]。2粒/次,3次/日。對照組單純用鈣爾奇D(惠氏一百宮制藥有限公司,維生素D 125 U/片,鈣600 mg/片)治療。1片/次,1次/日。3個月為一個療程,使用2個療程。
1.2.2檢測指標 (1)臨床療效:骨質疏松癥患者療效評價標準:無效:疼痛感無減輕,骨密度無改變;有效:腰背部存在輕度疼痛,骨密度提高;顯效:骨質疏松癥狀消失,骨密度顯著提高。臨床總有效率=(顯效例數+有效例數)/總例數×100%。(2)血鈣和血磷測定 采血,3 000 r/min離心5 min,分離上層血清,采用全自動生化儀檢測血鈣、血磷。(3)炎癥因子指標的測定:分別在用藥前后取患者血液于3 000 r/min離心10 min,分離血清,按各試劑盒說明書的要求測定炎癥因子TNF-α、MCP-1、IL-6含量。試劑盒均購自南京生物建成研究所。
1.2.3含藥血清的制備 將6月齡的SD大鼠,隨機分成2組:蒸餾水組和DMF組,每組12只。DMF組:按1 800 mg/kg體重進行灌胃強骨膠囊懸液;蒸餾水組:按17.5 ml/kg體重進行灌胃蒸餾水;2次/d,連續灌胃3 d。接著含藥血清制備方法參考文獻[7]。
1.2.4骨髓基質細胞的分離與鑒定 取1月齡SD大鼠的股骨和脛骨,分離骨髓基質細胞,分離和鑒定方法參考文獻[8]。
1.2.5RT-PCR檢測大鼠骨髓基質細胞Notch-1、Hes-1 mRNA表達水平 采用Notch激活劑Jaggedl蛋白(1 000 μg/L)和抑制劑γ-分泌酶抑制劑(DAPT,16 μmol/L),利用維甲酸(Retinoic acid,RA)建立骨質疏松模型,探討DMF改善骨質疏松的作用是否與Notch信號通路有關。取對數生長期的大鼠骨髓基質細胞,以5×103ml-1濃度接種于6孔板,每組設置3個復孔。用含10%胎牛血清的〗DMEM培養基培養在37℃、5%CO2培養箱中培養24 h至貼壁,實驗分組與給藥:①NC組:DMEM高糖完全培養液(含10% FBS);②RA組:RA(0.4 mmol/L);③DMF+RA組:DMEM高糖完全培養液(含DMF的血清)+RA(0.4 mmol/L);④Jaggedl+RA組:Jaggedl[1 000 μg/L+RA(0.4 mmol/L)];⑤Jaggedl+DMF+RA組:Jaggedl(1 000 μg/L)+DMEM高糖完全培養液(含DMF的血清)+RA(0.4 mmol/L);⑥DAPT+RA組:DAPT(16 μmol/L)+RA(0.4 mmol/L);⑦DAPT+DMF+RA組:DAPT(16 μmol/L)+DMEM高糖完全培養液(含DMF的血清)+RA(0.4 mmol/L)。根據Trizol試劑盒提取組織總RNA,采用核酸測定儀測定RNA純度和濃度,取1 μg進行逆轉錄,生成cDNA。采用SYBR green染料法進行定量檢測,Notch-1、Hes-1及GAPDH(內參)擴增引物序列如表1,擴增條件及計算方法參考文獻[9]。
1.2.6Western blot檢測大鼠骨髓基質細胞Notch-1、Hes-1蛋白的表達水平 細胞培養與給藥方法同1.2.3項下,常規方法提取組織總蛋白,二喹啉甲酸(Bicinchoninic acid,BCA)方法測定蛋白質含量后,進行凝膠電泳,每孔上樣20 μg,電轉至聚偏氟乙烯薄膜(Polyvinylidene fluoride,PVDF)上后,3%的脫脂奶封閉2 h,分別孵育Notch-1、Hes-1(目的蛋白)和GAPDH(內參蛋白)一抗,4℃孵育過夜,TBST洗膜,孵育二抗后顯影。采用Quantityone軟件對條帶亮度進行分析。
1.2.7免疫組化檢測大鼠骨髓基質細胞Notch-1、Hes-1蛋白的表達水平 采用常規方法制備5 μm厚的石蠟切片,進行免疫組化染色,在10 mmol/L檸檬酸鹽緩沖液(pH6.0)的熱激30 min介導抗原復性,采用抗Notch-1、Hes-1單克隆抗體孵育,4℃過夜。洗滌后孵育二抗,加顯色液后進行曝光。根據染色強度(0~3分,0分為無染色,1分為弱染色,2分為中度染色,3分為強染色)進行判分。

2 結果
2.1臨床療效 試驗組總有效率高于對照組總有效率(91.67%>76.67%),P<0.05,具體見表2。
2.2兩組患者血鈣和血磷水平比較 兩組患者治療前血鈣和血磷水平比較差異無統計學意義(P>0.05);治療后,兩組患者血鈣和血磷水平較治療前均升高(P<0.05);治療后,試驗組血鈣和血磷水平高于對照組(P<0.05),具體見表3。
2.3炎癥因子水平比較 兩組患者治療前TNF-α、MCP-1、IL-6水平比較差異無統計學意義(P>0.05);治療后兩組患者TNF-α、MCP-1、IL-6水平較治療前均降低(P<0.05);治療后,試驗組TNF-α、MCP-1、IL-6水平低于對照組(P<0.05),具體見表4。
2.4RT-PCR檢測大鼠骨髓基質細胞Notch-1、Hes-1 mRNA表達水平 與RA組相比,Jaggedl+RA組中Notch-1、Hes-1 mRNA水平均上調,DMF+RA組、DAPT+RA組中Notch-1、Hes-1 mRNA均下調,差異均具有統計學意義(P<0.05)。與Jaggedl+RA組相比,Jaggedl+DMF+RA組中Notch-1、Hes-1 mRNA水平均下調,差異均具有統計學意義(P<0.05)。與DAPT+RA組相比,DAPT+DMF+RA組中Notch-1、Hes-1 mRNA水平均下調,差異均具有統計學意義(P<0.05)。具體見表5。
2.5Western blot檢測大鼠骨髓基質細胞Notch-1、Hes-1蛋白的表達水平 與RA組相比,Jaggedl+RA組中Notch-1、Hes-1 蛋白水平均上調,DMF+RA組、DAPT+RA組中Notch-1、Hes-1 蛋白均下調,差異均具有統計學意義(P<0.05)。與Jaggedl+RA組相比,Jaggedl+DMF+RA組中Notch-1、Hes-1 蛋白水平均下調,差異均具有統計學意義(P<0.05)。與DAPT+RA組相比,DAPT+DMF+RA組中Notch-1、Hes-1 蛋白水平均下調,差異均具有統計學意義(P<0.05)。具體結果表6、圖1。
表1RT-PCR引物設計
Tab.1RT-PCRprimerdesign
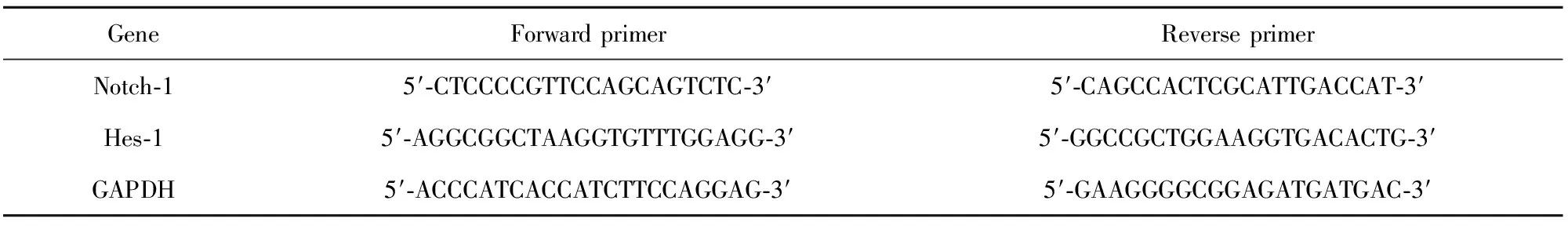
GeneForwardprimerReverseprimerNotch?15′?CTCCCCGTTCCAGCAGTCTC?3′5′?CAGCCACTCGCATTGACCAT?3′Hes?15′?AGGCGGCTAAGGTGTTTGGAGG?3′5′?GGCCGCTGGAAGGTGACACTG?3′GAPDH5′?ACCCATCACCATCTTCCAGGAG?3′5′?GAAGGGGCGGAGATGATGAC?3′
2.6免疫組化檢測大鼠骨髓基質細胞Notch-1、Hes-1蛋白的表達水平 與RA組相比,Jaggedl+RA組中Notch-1、Hes-1 免疫組化評分均升高,DMF+RA組、DAPT+RA組中Notch-1、Hes-1免疫組化評分均下降,差異均具有統計學意義(P<0.05)。與Jaggedl+RA組相比,Jaggedl+DMF+RA組中Notch-1、Hes-1 免疫組化評分均下降,差異均具有統計學意義(P<0.05)。與DAPT+RA組相比,DAPT+DMF+RA組中Notch-1、Hes-1 免疫組化評分均下降,差異均具有統計學意義(P<0.05)。具體結果圖2、3,表7。
表2兩組患者臨床療效比較
Tab.2Comparisonclinicalefficacyoftwogroups
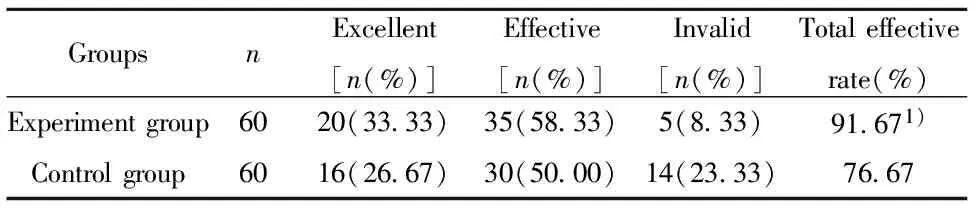
GroupsnExcellent[n(%)]Effective[n(%)]Invalid[n(%)]Totaleffectiverate(%)Experimentgroup6020(33 33)35(58 33)5(8 33)91 671)Controlgroup6016(26 67)30(50 00)14(23 33)76 67
Note:Compared with control group,1)P<0.05.
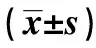
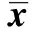
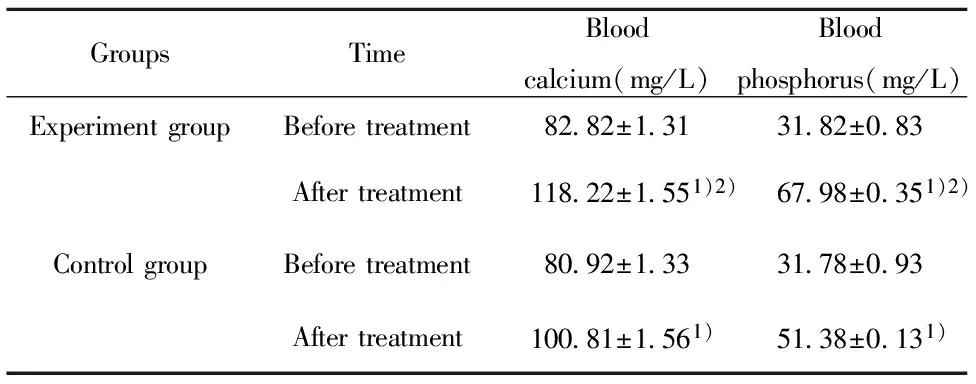
GroupsTimeBloodcalcium(mg/L)Bloodphosphorus(mg/L)ExperimentgroupBeforetreatment82 82±1 3131 82±0 83Aftertreatment118 22±1 551)2)67 98±0 351)2)ControlgroupBeforetreatment80 92±1 3331 78±0 93Aftertreatment100 81±1 561)51 38±0 131)
Note:Compared with before treatment,1)P<0.05;compared with control group,2)P<0.05.
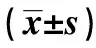
GroupsTimeTNF?α(pg/ml)MCP?1(pg/ml)IL?6(pg/ml)ExprerimentgroupBeforetreatment182 82±1 31131 82±0 83141 82±0 83Aftertreatment108 22±1 551)2)57 98±0 351)2)67 98±0 351)2)ControlgroupBeforetreatment180 92±1 33131 78±0 93141 78±0 93Aftertreatment140 81±1 561)71 38±0 131)81 38±0 131)
Note:Compared with before treatment,1)P<0.05;compared with control group,2)P<0.05.
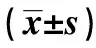
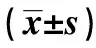
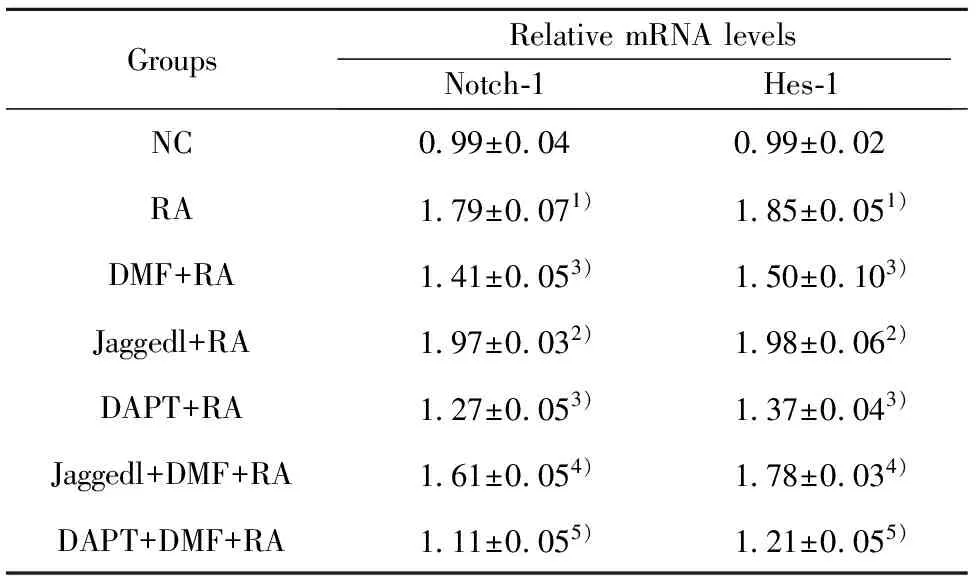
GroupsRelativemRNAlevelsNotch?1Hes?1NC0 99±0 040 99±0 02RA1 79±0 071)1 85±0 051)DMF+RA1 41±0 053)1 50±0 103)Jaggedl+RA1 97±0 032)1 98±0 062)DAPT+RA1 27±0 053)1 37±0 043)Jaggedl+DMF+RA1 61±0 054)1 78±0 034)DAPT+DMF+RA1 11±0 055)1 21±0 055)
Note:Compared with NC group,1)P<0.05;compared with RA group,2)P<0.05,3)P<0.01;compared with Jaggedl+RA group,4)P<0.05;compared with DAPT+RA group,5)P<0.05.
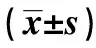
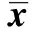
GroupsRelativeproteinlevelNotch?1Hes?1NC0 23±0 040 26±0 04RA0 67±0 111)0 70±0 061)DMF+RA0 45±0 083)0 48±0 033)Jaggedl+RA0 83±0 032)0 88±0 042)DAPT+RA0 35±0 043)0 40±0 053)Jaggedl+DMF+RA0 53±0 044)0 58±0 054)DAPT+DMF+RA0 28±0 045)0 31±0 045)
Note:Compared with NC group,1)P<0.05;compared with RA group,2)P<0.05,3)P<0.01;compared with Jaggedl+RA group,4)P<0.05;compared with DAPT+RA group,5)P<0.05.
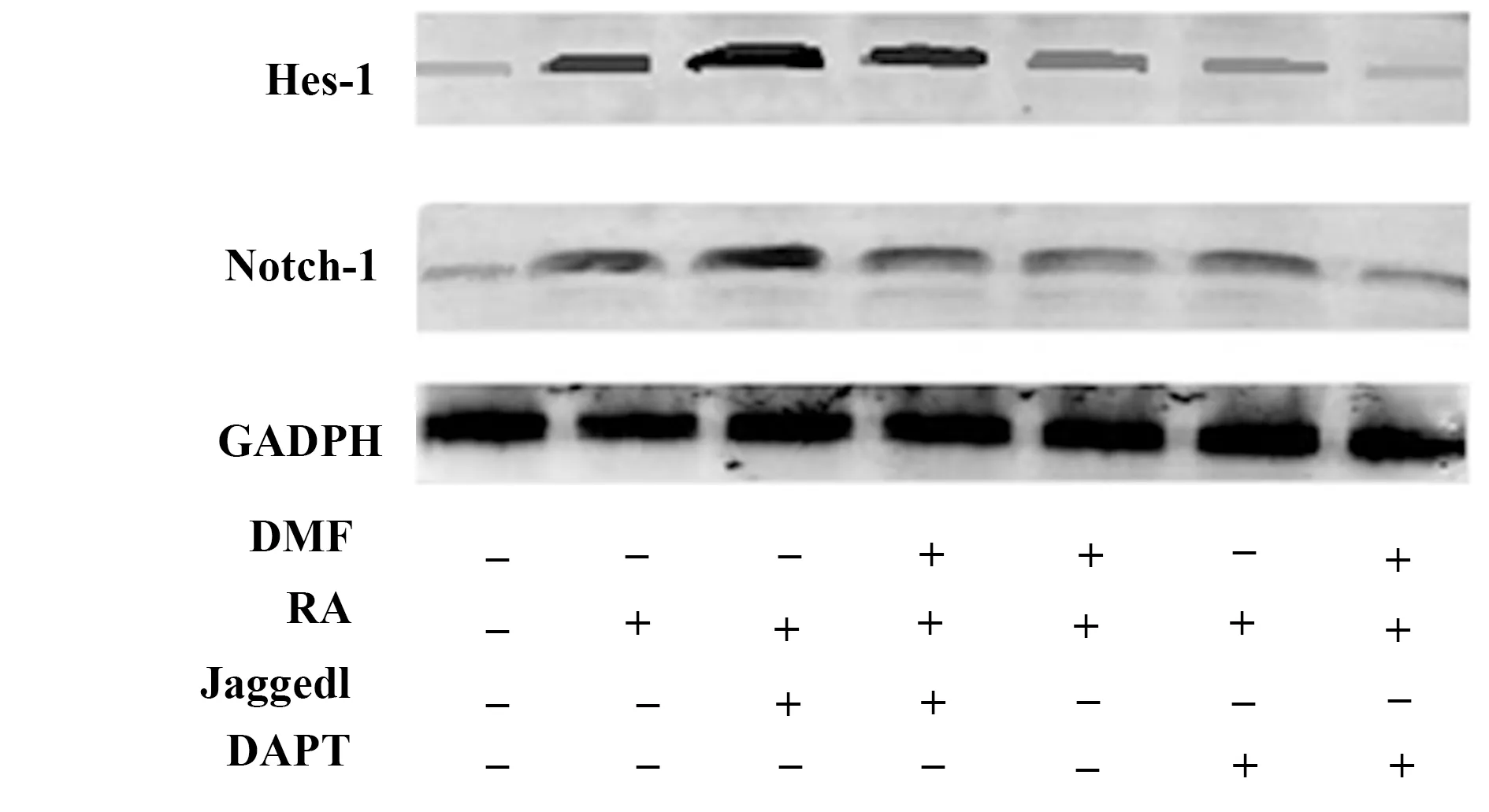
圖1 Western blot檢測大鼠骨髓基質細胞Notch-1、Hes-1蛋白的表達水平Fig.1 Western blot were performed to assess protein levels of Notch-1,Hes-1 in mice bone marrow stromal cells
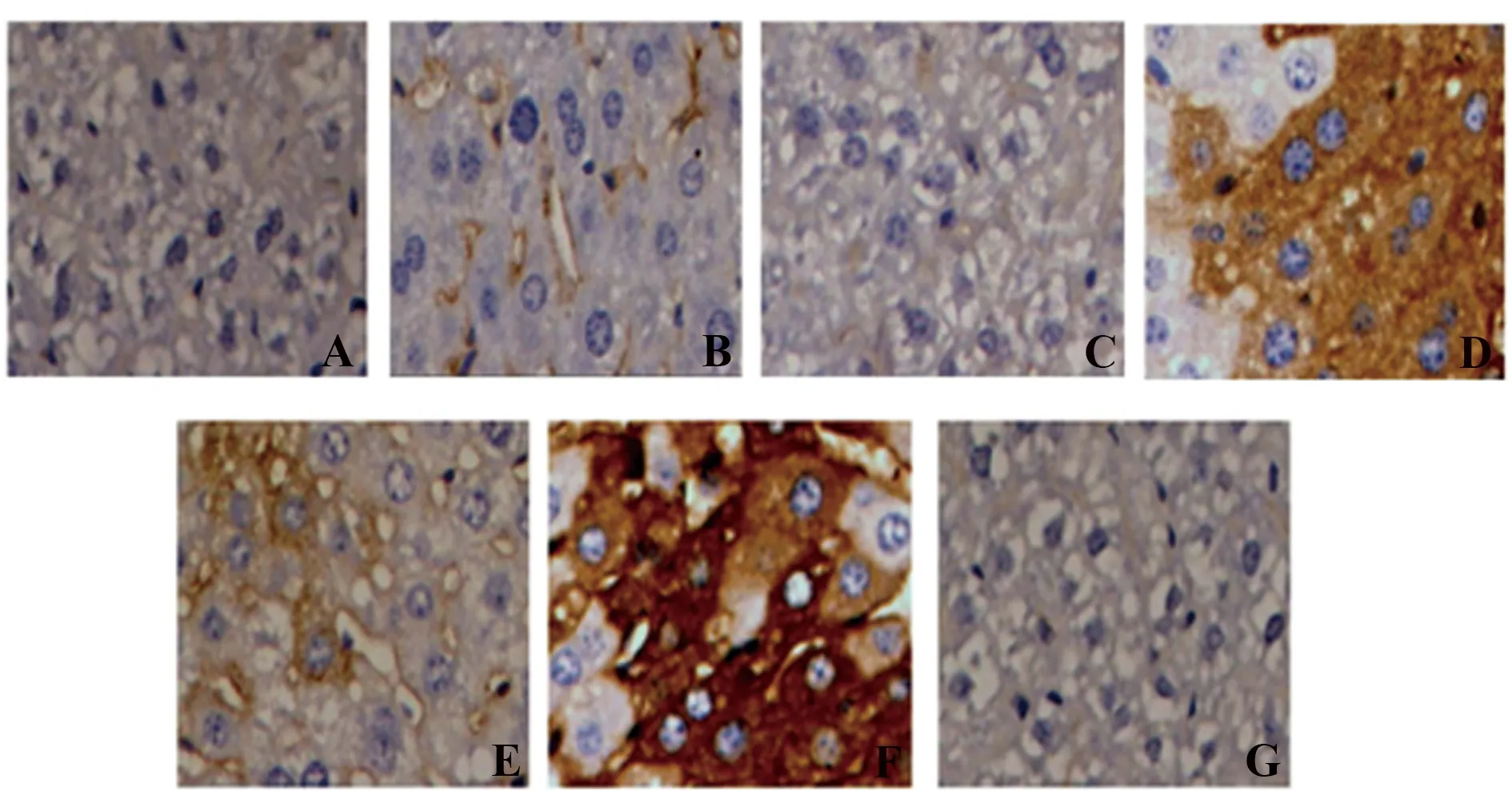
圖2 免疫組化檢測大鼠骨髓基質細胞Notch-1蛋白的表達水平Fig.2 Immunohistochemistry were performed to assess protein levels of Notch-1 in mice bone marrow stromal cells
3 討論
骨質疏松癥是臨床上較為常見的疾病之一,其具有較高的發病率,主要是以骨組織微結構退化、以骨量減少為主要特征。Notch信號通路參與多種疾病的發生和發展,其調控細胞多種進程[10-12]。Notch-1、Notch-2、Notch-3和Notch-4是Notch受體,當Notch配體與Notch受體特異性結合后,Notch信號通路隨后被激活,進而激活下游靶基因Hes家族的轉錄[13]。Hes-1作為Notch信號通路下游靶基因Hes-1家族的主要成員,也隨之被激活[14-16]。目前,關于Notch信號通路中各個信號分子,包括受體Notch-1、Notch-3等及下游靶基因Hes-1家族在骨質疏松組織中的表達研究較少,對此本文將進一步探討。
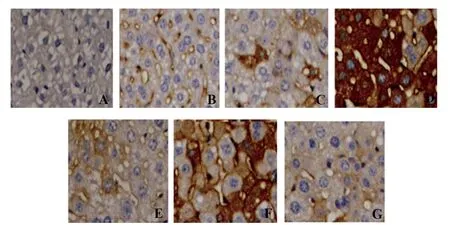
圖3 免疫組化檢測大鼠骨髓基質細胞Hes-1蛋白的表達水平Fig.3 Immunohistochemistry were performed to assess protein levels of Hes-1 in mice bone marrow stromal cells
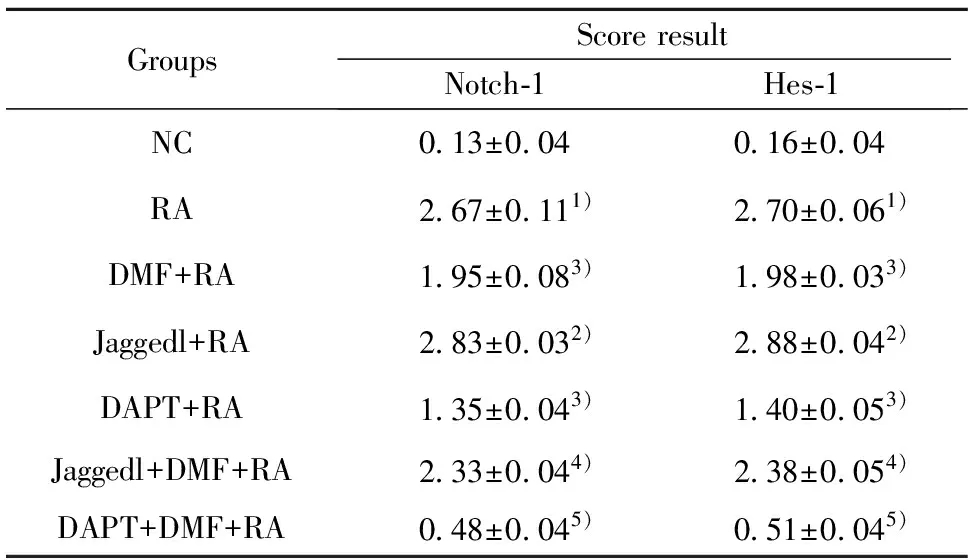
GroupsScoreresultNotch?1Hes?1NC0 13±0 040 16±0 04RA2 67±0 111)2 70±0 061)DMF+RA1 95±0 083)1 98±0 033)Jaggedl+RA2 83±0 032)2 88±0 042)DAPT+RA1 35±0 043)1 40±0 053)Jaggedl+DMF+RA2 33±0 044)2 38±0 054)DAPT+DMF+RA0 48±0 045)0 51±0 045)
Note:Compared with NC group,1)P<0.05;compared with RA group,2)P<0.05,3)P<0.01;compared with Jaggedl+RA group,4)P<0.05;compared with DAPT+RA group,5)P<0.05.
臨床研究結果發現,DMF試驗組總有效率高于對照組總有效率;治療后試驗組血鈣和血磷水平高于對照組,而TNF-α、MCP-1和IL-6水平低于對照組。試驗組Notch-1、Hes-1蛋白表達量低于對照組Notch-1、Hes-1蛋白表達量,結果提示骨碎補總黃酮可改善骨質疏松癥,且其機制可能與Notch信號通路相關。接著在分離培養大鼠骨髓基質細胞進行體外實驗研究,采用Notch激活劑Jaggedl和抑制劑DAPT,利用RA建立骨質疏松模型,探討DMF改善骨質疏松的作用是否與Notch信號通路有關。研究發現DMF同DAPT(Notch阻斷劑)一樣,可以下調RA所致的大鼠骨髓基質細胞Notch-1、Hes-1 mRNA和蛋白水平升高。Jaggedl作為Notch激動劑,可部分逆轉DMF對大鼠骨髓基質細胞上述基因和蛋白的調控作用。
綜上所述,骨碎補總黃酮可改善骨質疏松癥,且其機制可能與抑制Notch信號通路相關。
[1] 張智海,劉忠厚,李 娜,等.中國人骨質疏松癥診斷標準專家共識[J].中國骨質疏松雜志,2014,20(9):1007-1010.
Zhang ZH,Liu ZH,Li N,etal.Chinese expert consensus on the diagnosis of osteoporosis[J].Chin J Osteoporosis,2014,20(9):1007-1010.
[2] 彭 雙,韓立峰,王 濤,等.骨碎補中的化學成分及藥理作用研究進展[J].天津中醫藥大學學報,2012,31(2):122-125.
Peng S,Han LF,Wang T,etal.Research progress of chemical constituents and pharmacological effects in Drynariae[J].J Tianjin Uni Traditional Chin Med,2012,31(2):122-125.
[3] 劉國巖,徐展望,徐琬梨,等.骨碎補提取物對骨髓間充質干細胞向成骨細胞分化Cbfa-1 表達的影響及意義[J].中國骨質疏松雜志,2013,19(12):1224-1227,1229.
Liu GY,Xu ZW,Xu YL,etal.Effect of Drynaria fortunei extract on the expression of Cbfa-1 in osteoblasts from bone marrow mesenchymal stem cells and its significance[J].Chin J Osteoporosis,2013,19(12):1224-1227,1229.
[4] 劉國巖,徐展望,徐琬梨.骨碎補提取物對骨髓間充質干細胞向成骨細胞分化及CXCL12 表達的影響及意義[J].中華中醫藥雜志,2013,28(5):1484-1487.
Liu GY,Xu ZW,Xu YL.Effect of Rhizoma Drynariae on the differentiation of bone marrow mesenchymal stem cells into osteoblasts and the expression of CXCL12[J].Zhonghua Zhong Yi Yao Za Zhi,2013,28(5):1484-1487.
[5] 歐陽露.中藥骨碎補調節骨代謝作用及機制研究進展[J].湖北醫藥學院學報,2013,32(2):187-190.
Ou YL.Traditional Chinese medicine Osteopractic regulation of metabolism and mechanism of progress[J].Hubei Med Coll,2013,32(2):187-190.
[6] 劉冬梅,袁 林,蘇林沖,等.強骨康疏膠囊對去卵巢骨質疏松癥模型大鼠細胞因子的影響[J].中國免疫學雜志,2014,30(3):338-341.
Liu DM,Yuan L,Su C,etal.Strong influence on Gukang Shu Capsule to ovarian cell factor of osteoporosis model rats[J].Chin J Immunol,2014,30(3):338-341.
[7] 田 剛,張治國,付小偉,等.骨碎補對卵巢切除所致大鼠骨質疏松癥的治療作用以及機理探討[J].中國中醫基礎醫學雜志,2013,19(1):47-49.
Tian G,Zhang ZG,Fu XW,etal.The mechanism and therapeutic effect of Rhizoma Drynariae on ovariectomy induced osteoporosis rats[J].China J Basic Med Traditional Chin Med ,2013,19(1):47-49.
[8] 眭承志,樊孝俊,林景雄,等.骨碎補總黃酮治療老年性骨質疏松癥生命質量的評價[J].光明中醫,2012,27(1):15-20.
Gui CZ,Fan XJ,Lin JX,etal.The quality of life of Osteopractic Total Flavone in the treatment of senile osteoporosis evaluation[J].Guangming Traditional Chin Med,2012,27(1):15-20.
[9] 樊繼波,覃 勇,李 莎,等.離子導入骨碎補總黃酮對骨質疏松癥患者腰椎骨密度影響臨床研究[J].中國骨質疏松雜志,2013,19(12):1256-1258.
Fan J,Qin Y,Li S,etal.The clinical study of total flavonoids of Rhizoma Drynariae iontophoresis on bone mineral density in the lumbar vertebrae in osteoporosis patients[J].China Osteoporosis,2013,19(12):1256-1258.
[10] 丁小剛,覃 勇,鄂建設,等.骨碎補總黃酮對老年性骨質疏松癥患者血清骨鈣素水平及骨密度影響[J].中國骨質疏松雜志,2013,19(5):519-521.
Ding XG,Qin Y,E JS,etal.The effect of Total flavonoids of Rhizoma Drynariae on skull defect repair of rat serum alkaline phosphatase,calcium and phosphorus[J].China Osteoporosis J,2013,19(5):519-521.
[11] 金 合,李晉玉,俞 興,等.骨碎補總黃酮對顱骨缺損修復大鼠血清堿性磷酸酶、鈣、磷的影響[J].中國骨傷,2012,25(9):757-760.
Jin H,Li JY,Yu X,etal.The effect of total flavonoids of Rhizoma Drynariae on skull defect repair of rat serum alkaline phosphatase,calcium and phosphorus[J].China Bone,2012,25(9):757-760.
[12] Ren BX,Gu XP,Zheng YG,etal.Intrathecal injection of metabotropic glutamate receptor subtype 3 and 5 agonist/antagonist attenuates bone cancer pain by inhibition of spinal astrocyte activation in a mouse model[J].Anesthesiology,2012,116(1):122-132.
[13] Shibasaki S,Kitano S,Karasaki M,etal.Blocking e-Met signaling enhances bone morphogenetic protein-2-induced osteoblast differentiation[J].FEBS Open Bio,2015,5(2):341-347.
[14] Qu X,Cao Y,Chen C,etal.A poly(1actide-co-glyeolide) film loaded with abundant bone morphogenetic protein-2:a substrate-promoting osteoblast attachment,proliferation,and differentiation in bone tissue engineering[J].J Biomed Mater Res A,2015,103(8):2786-2796.
[15] Price PA,Parthemore JG,Deftos LJ.New biochemical marker for bone metabolism.Measurement by radioimmunoassay of bone GLA protein in the plasma of normal subjects and patients with bone disease[J].J Clin Invest,2013,66(5):878-883.
[16] Duey P.The role of osteocalcin in the endocrine cross-talk between bone remodelling and energy metabolism[J].Diabetologia,2014,54(6):1291-1297.

