原發性干燥綜合征的自身抗體研究進展①
喻曉雯 王 琴 馮 婧 白殊同 劉金坤 高洪燕 吳 斌
(重慶市中醫院中醫藥基礎研究室,重慶 400021)
原發性干燥綜合征(primary Sj?gren′s syndrome,pSS)是一種病因未明的慢性自身免疫性疾病,以淋巴細胞浸潤和外分泌腺功能損傷為特征。pSS好發于女性,多于40~60歲發病,口干、眼干是常見的臨床表現。成人患病率為0.5%~1%,是風濕病科第二大疾病[1,2]。由于非專科醫生對本病認識不足,同時pSS的診斷常需完善唾液腺功能、眼科檢查、唇腺活檢等,在基層醫院往往無法完成診斷,有研究提示超過一半的pSS患者出現漏診或誤診,平均需要3.9年才能確診[3,4 ]。基于上述原因,自身抗體在pSS診斷中的作用就尤為突出。在pSS患者血清中可檢測出多種自身抗體,抗Ro/SSA和抗La/SSB抗體是pSS的標志性抗體,但其特異性較低[5]。近年來,抗M3毒蕈堿乙酰膽堿受體(anti-M3 muscarinic acetylcholine receptor,抗M3R)抗體和抗α-胞襯蛋白抗體(anti-α-Fodrin antibody,AFA)逐漸運用于臨床診斷,且特異性有所提高[6]。此外,其他自身抗體也引起研究者的重視,如抗著絲點抗體、抗環瓜氨酸抗體、抗線粒體抗體和抗平滑肌抗體等[7],其檢出率和臨床意義具體見表1。
1 抗Ro/SSA 和抗La/SSB抗體
抗Ro/SSA和抗La/SSB抗體是pSS的標志性抗體,已經被列入診斷標準[5]。抗Ro/SSA和抗La/SSB抗體在pSS的病程中比較穩定,即使是生物制劑利妥昔單抗治療后亦很難改變[10]。研究發現抗La/SSB與抗Ro/SSA抗體與pSS疾病活動度有一定的相關性,其中抗Ro/SSA抗體具有更高的相關性[11]。抗Ro/SSA抗體包括抗Ro52和抗Ro60兩種自身抗體,抗Ro52抗體是pSS患者中最常被檢出的自身抗體[7]。研究還發現12%的抗Ro/SSA抗體陰性的pSS患者可檢測到抗Ro52抗體陽性,提示抗Ro52抗體提高了pSS的檢出率[5]。在臨床上,檢測抗Ro/SSA和抗La/SSB抗體的常用方法為ELISA,其敏感性偏低且易出現假陽性。Volchenkov等[12]發現液相熒光素酶免疫沉淀系統技術能提高抗Ro/SSA和抗La/SSB抗體的檢出率,抗La/SSB抗體可提高11%,抗Ro60抗體可提高4%,可見新的實驗方法可以提高pSS的診斷率。
抗Ro/SSA和抗La/SSB對pSS疾病有預測作用,早在1982年,Isenberg等[2]發現15例關節炎伴抗La/SSB抗體陽性的患者,其中有11例患者2年后發展為pSS。最近亦發現抗Ro/SSA和抗La/SSB抗體在確診pSS前20年就已經存在[13]。此外,Tandander等[14]也發現ANAs在pSS患者中最早出現,其次是類風濕因子(Rheumatoid factor,RF)、抗Ro60/SSA、抗Ro52/SSA和抗La/SSB,表明早期檢測對pSS的早期篩查意義重大。
抗Ro/SSA和抗La/SSB抗體參與了pSS的發病機制。研究發現抗Ro/SSA抗體陽性的pSS患者的唾液流率明顯低于抗Ro/SSA抗體陰性的患者,提示抗Ro/SSA抗體可能介導唾液腺的機能障礙[4]。其機制可能是自身抗體沉積于唾液腺,促炎的細胞因子KC、IL-1α、MIG、MIP2和PDGF-β的上調協助自身抗體介導唾液腺的損傷,進而誘發口干癥狀[15]。此外,抗Ro/SSA和抗La/SSB抗體還介導了pSS患者的腺外損傷。有報道pSS患者中抗Ro/SSA和抗La/SSB抗體與腺外癥狀(脾腫大,淋巴結病,脈管炎和雷諾現象)呈正相關[10]。高滴度的抗-Ro52抗體與唇腺活檢陽性,腮腺腫脹、貧血、白細胞減少和RF顯著相關[5]。韓國的一項研究也發現抗-Ro52與肝臟和肌肉的受累高度相關,而抗-Ro60與肝臟的受累呈負相關[16]。可見抗Ro/SSA、抗La/SSB參與了pSS腺體及腺體外損傷的發病機理,將近年研究發現的一些參與了pSS的發病機制自身抗體總結于表2。
2 抗M3R抗體
抗M3R抗體是可以作為pSS診斷的另一個的血清學標志物。M3R是一個膜結合蛋白,表達于外分泌腺,在腺體分泌中發揮著關鍵作用。血清中的抗M3R抗體檢出率較低,約為50%[19]。采用唾液樣本可提高抗M3R抗體的檢出率,且特異性可達到88.16%。研究還發現唾液抗M3R IgG抗體與年齡、病程和球蛋白水平相關[17]。國內報道69%的pSS患者在唾液中能檢測到抗M3R抗體[18]。從方便臨床診斷角度看,唾液中抗M3R抗體檢測可能更貼近臨床。
越來越多的證據表明抗M3R抗體可能是引起唾液腺分泌功能喪失的重要因素,其可能的機制如下:首先pSS患者血清中純化的抗膽堿自身抗體以肌醇磷脂、半胱天冬酶-3和MMP-3依賴的方式介導了A253細胞系的凋亡,抗M3R抗體通過與磷脂酶C、鈣通信激活半胱天冬酶-3和MMP-3,從而誘導上皮細胞凋亡,進而導致唾液腺的破壞性損傷[22]。其次,抗M3R抗體能抑制人類頜下腺、唾液腺細胞的分泌功能[23]。如Iwabuchi等[24]發現在小鼠唾液腺中M3R的活化引起唾液的產生,M3R對唾液分泌的副交感神經有非常重要的調控作用[25],因此抗M3R抗體可能直接通過阻斷神經傳輸導致干燥癥狀的顯現。最后,抗M3R抗體介導的氧化壓力與唾液腺的損傷有關。在正常情況下,淚腺和唾液腺的眼睛和口腔表面存在ROS/抗氧化劑的平衡,一旦這種平衡被打破,眼睛和口腔會受到損傷[26]。ROS的水平和抗氧化物酶系統的不平衡在唾液腺的致病性中發揮著關鍵的作用[27]。抗M3R抗體刺激pSS唾液腺中超氧化物歧化酶(Superoxide dismutase,SOD)和過氧化氫酶(Catalase,CAT)的活性增加,并且上調NO和前列腺素E2的表達。因此,我們推斷SOD和CAT在pSS患者中活性的增加可能是機體對ROS增加的一個防御反應,但這種防御反應一旦過度就會引起唾液腺細胞和組織不可逆的損傷[28]。
表1pSS疾病相關自身抗體
Tab.1AssociatedautoantibodiesdetectedinpSS
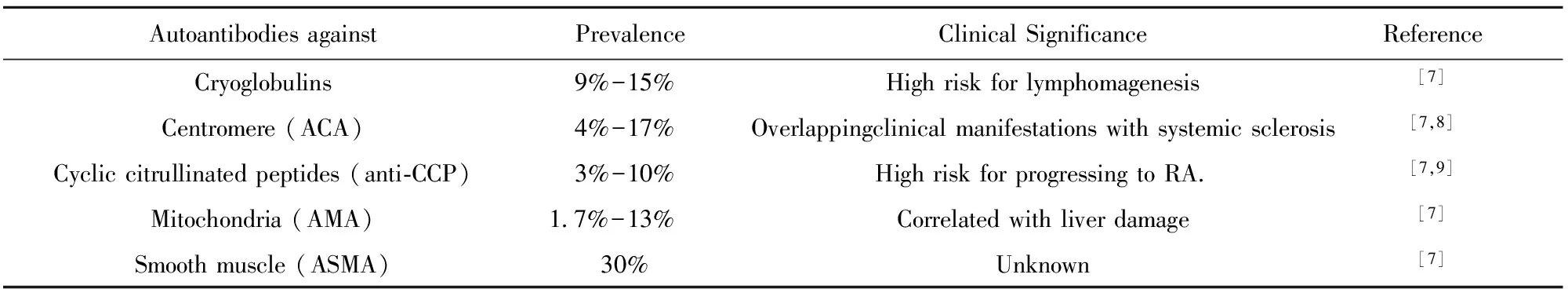
Autoantibodiesagainst PrevalenceClinicalSignificanceReferenceCryoglobulins 9%-15%Highriskforlymphomagenesis[7]Centromere(ACA) 4%-17%Overlappingclinicalmanifestationswithsystemicsclerosis[7,8]Cycliccitrullinatedpeptides(anti?CCP) 3%-10%HighriskforprogressingtoRA [7,9]Mitochondria(AMA)1 7%-13%Correlatedwithliverdamage[7]Smoothmuscle(ASMA) 30%Unknown[7]
表2參與pSS發病機理的相關自身抗體
Tab.2AssociationofautoantibodieswithpSSpathogenesis
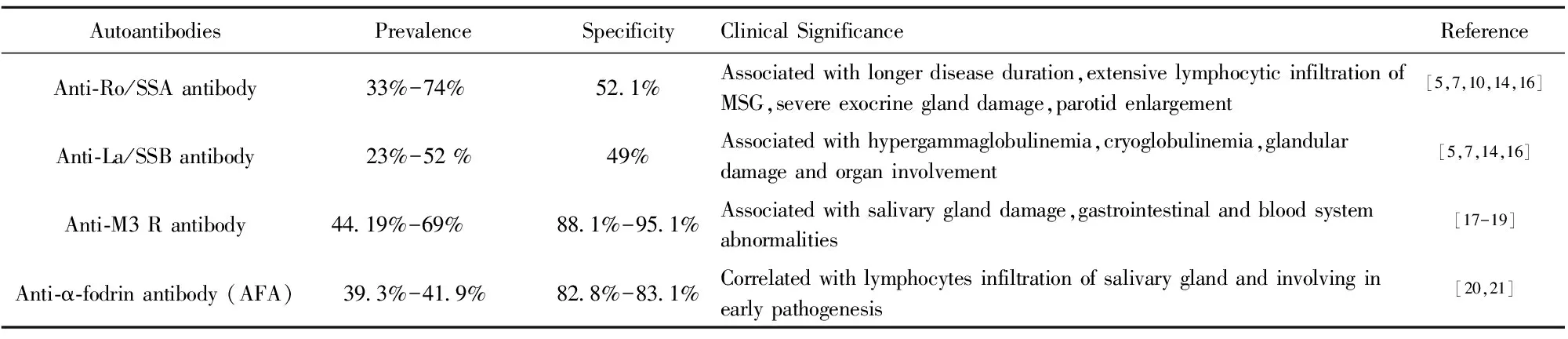
AutoantibodiesPrevalenceSpecificityClinicalSignificanceReferenceAnti?Ro/SSAantibody 33%-74%52 1%Associatedwithlongerdiseaseduration,extensivelymphocyticinfiltrationofMSG,severeexocrineglanddamage,parotidenlargement[5,7,10,14,16]Anti?La/SSBantibody 23%-52%49%Associatedwithhypergammaglobulinemia,cryoglobulinemia,glandulardamageandorganinvolvement[5,7,14,16]Anti?M3Rantibody44 19%-69%88 1%-95 1%Associatedwithsalivaryglanddamage,gastrointestinalandbloodsystemabnormalities[17-19]Anti?α?fodrinantibody(AFA)39 3%-41 9%82 8%-83 1%Correlatedwithlymphocytesinfiltrationofsalivaryglandandinvolvinginearlypathogenesis[20,21]
抗M3R抗體也介導了pSS患者的腺外系統的損傷。pSS患者普遍存在胃腸道的損傷,但具體原因未知。Park等[29]發現在pSS患者中,抗M3R抗體有介導胃腸道多重機能不良的潛在風險,包括食道蠕動減弱和結腸動力改變等,因此推測pSS患者胃腸道動力的改變可能部分是由抗M3R抗體介導的功能障礙。另外在pSS患者中,抗M3R抗體還介導了神經免疫的相互作用,這種相互作用可能與pSS復雜的病理生理相關。換言之自身抗體的產生直接靶向自發的神經遞質受體抗M3R抗體,從而抑制了唾液的分泌[30]。此外,最近發現pSS患者的抗M3R抗體可誘導存在于質膜的M3R和MHCⅠ類分子的下調和隨后的NK細胞介導的細胞死亡,這可能是pSS患者易發生白細胞減少的原因[31]。上述研究表明抗M3R抗體介導了腺外系統損傷,其機理是復雜的。
3 抗α-胞襯蛋白抗體
AFA是pSS早期診斷的標志物[32]。AFA在唾液腺炎和組織凋亡時形成,是一個器官特異性自身抗原,與自身免疫損傷和組織破壞存在相關[10]。早在1997年,在pSS小鼠模型中發現了AFA[32]。通常AFA的出現早于抗Ro/SSA或抗La/SSB抗體[10]。有研究者檢測了64例pSS患者和108例非pSS患者血清中的AFA IgA和IgG抗體,通過ROC分析以評估其對pSS診斷的準確性,結果發現敏感性分別為59%和55%,特異性為75%和73%,證明了其在pSS中的診斷潛能[33]。由于不同研究對AFA抗體在pSS診斷中的準確性相差較大,Hu等[20]選取23個研究,通過meta分析系統評價了AFA對pSS診斷的準確性,結果發現AFA的敏感性和特異性分別為39.3%和83%,IgG亞型、IgA亞型的敏感性分別為38%和41.9%,特異性分別為82.8%和83.1%,因此認為AFA在pSS診斷中具有可靠性。最近發現在抗SSA/SSB抗體陰性的pSS患者中,AFA與RF和/或ANA聯合可把診斷的敏感性從56.9%提高到70.7%,提示可作為pSS診斷的替代免疫學標準[21]。此外,AFA的濃度與唾液腺中淋巴細胞的浸潤程度呈正相關,AFA可能參與了早期的致病過程,因為AFA IgG抗體陽性的pSS患者往往有更短的疾病病程[10]。
4 其他自身抗體
在pSS患者中,一些抗體的出現可能提示發生相關疾病的風險,如aβ2GP Ⅰ 和p-ANCA抗體可能預示pSS患者有發生神經病變的可能[34]。ADAMTS13抗體陽性提示可能有并發血液系統疾病的風險[35]。IFN-γ的過度表達與肺間質病變有緊密的聯系[36]。PAX6的下調與眼睛損傷高度相關,可作為預測pSS早期眼睛并發癥的指標之一[37]。而且一些自身抗體具有一定的預測作用,如抗NA-14抗體陽性提示pSS病程短[38]。抗MDM2陽性提示pSS病程長,同時常伴有貧血、血小板減少和抗-SSB抗體陽性,且與疾病活動度和IgG的水平正相關[39]。
表3近年發現與pSS相關的自身抗體
Tab.3AutoantibodiesnewlyfoundinpSS

AutoantibodiesClinicalSignificanceReferenceaβ2GPⅠHintingtheriskoftheoccurrenceofneuropathy[34]p?ANCAHintingtheriskoftheoccurrenceofneuropathy[34]Anti?ADAMTS13antibodyOverlappingpSSwiththromboticthrombocytopenicpurpura[35]Anti?NA?14antibodyIndicatingshortdiseaseduration[38]Anti?IFN?γantibodyReducingthefrequencyofpulmonaryfibrosis[36]Anti?PAX6antibodyDetectingearlylossofocularphenotype[37]Anti?MDM2antibodyLongerdiseaseduration,severeDiseaseactivity[39]Anti?REGIαantibodyDiminishedsalivaryglandacinarcellproliferation[40,41]
Reg家族基因產物作為生長因子,可促進細胞增殖和再生,與各種炎癥疾病關系密切。研究發現REG Iα在pSS患者的唾液腺導管上皮細胞中過表達,并且在血清中可檢測到抗REG Iα自身抗體[40]。Fujimura等[41]發現抗REG Iα抗體陽性的患者唾液分泌功能低下,其機理與IL-6誘導REG Iα破壞唾液腺管狀上皮細胞的再生有關。各種近年發現自身抗體的臨床意義,見表3。
5 自身抗體與疾病預后
自身抗體與風濕病預后往往存在一定的聯系,如在系統性硬化癥,抗ACA陽性的患者預后多良好,而抗topo I抗體與不良預后相關[42]。高滴度的RF(IgM和/或IgA)、抗CCP抗體和抗核周因子等多提示類風濕性關節炎疾病活動度高,難以控制[43,44]。目前自身抗體與pSS預后相關的研究明顯不足,以后應加強這方面的研究。
6 結語
自身抗體及其在疾病pSS的預測、診斷和發病機制中都發揮著重要的作用。當前用于實驗室診斷的自身抗體-抗Ro/SSA、抗La/SSB、抗M3R和AFA普遍存在著特異性或者敏感性較低的缺陷,致使pSS患者易出現漏診或誤診。探索提高診斷準確性的方法就迫在眉睫,是否可以考慮多種自身抗體的聯合應用?如AFA與RF和/或ANA聯合敏感性從56.9%提高到70.7%。另外新技術也是提高傳統自身抗體敏感性的有效途徑。此外,研究發現許多自身抗體與pSS相關,尋找特異性和敏感性較高的新的自身抗體或者通過整合生物標志物體系,或許對提高診斷的準確性和深入闡述致病機理具有重要意義。
[1] Hauk V,Calafat M,Larocca L,etal.Vasoactive intestinal peptide/vasoactive intestinal peptide receptor relative expression in salivary glands as one endogenous modulator of acinar cell apoptosis in a murine model of Sjogren′s syndrome[J].Clin Exp Immunol,2011,166(3):309-316.
[2] Henriksson G.Presymptomatic autoantibodies in Sjogren′s syndrome:what significance do they hold for the clinic?[J].Exp Rev Clin Immunol,2014,10(7):815-817.
[3] Beckman KA,Luchs J,Milner MS.Making the diagnosis of Sj?gren′s syndrome in patients with dry eye[J].Clin Ophthalmol,2016,10:43-53.
[4] Wei P,Li CL,Qiang L,etal.Role of salivary anti-SSA/B antibodies for diagnosing primary Sj?gren′s syndrome[J].Med Oral Patologia Oral Y Cirugia Bucal,2015,20(2):E156-E160.
[5] Retamozo S,Akasbi M,Brito-Zeron P,etal.Anti-Ro52 antibody testing influences the classification and clinical characterisation of primary Sjogren′s syndrome[J].Clin Exp Rheumatol,2012,30(5):686-692.
[6] Chen Y,Zheng JF,Huang QN,etal.Autoantibodies against the second extracellular loop of M3R do neither induce nor indicate primary sjogren′s syndrome[J].PLoS One,2016,11(2):e0149485.
[7] Kyriakidis NC,Kapsogeorgou EK,Tzioufas AG.A comprehensive review of autoantibodies in primary Sjogren′s syndrome:Clinical phenotypes and regulatory mechanisms[J].J Autoimmunity,2014,51:67-74.
[8] Kitagawa T,Shibasaki K,Toya S.Clinical significance and diagnostic usefulness of anti-centromere antibody in Sjogren′s syndrome[J].Clin Rheumatol,2012,31(1):105-112.
[9] Ryu YS,Park SH,Lee J,etal.Follow-up of primary Sjogren′s syndrome patients presenting positive anti-cyclic citrullinated peptides antibody[J].Rheumatol Int,2013,33(6):1443-1446.
[10] Shen L,Suresh L.Autoantibodies,detection methods and panels for diagnosis of Sjogren′s syndrome[J].Clin Immunol,2017,182:24-29.
[11] Maslinska M,Manczak M,Wojciechowska B,etal.The prevalence of ANA antibodies,anticentromere antibodies,and anti-cyclic citrullinated peptide antibodies in patients with primary Sjogren′s syndrome compared to patients with dryness symptoms without primary Sjogren′s syndrome confirmation[J].Reumatologia,2017,55(3):113-119.
[12] Volchenkov R,Jonsson R,Appel S.Anti-Ro and anti-La autoantibody profiling in Norwegian patients with primary Sjogren′s syndrome using luciferase immunoprecipitation systems(LIPS)[J].Scand J Rheumatol,2012,41(4):314-315.
[13] Trier NH,Nielsen IO,Friis T,etal.Comparison of antibody assays for detection of autoantibodies to Ro 52,Ro 60 and La associated with primary Sjogren′s syndrome[J].J Immunological Methods,2016,433:44-50.
[14] Theander E,Jonsson R,Sjostrom B,etal.Prediction of Sjogren′s syndrome years before diagnosis and identification of patients with early onset and severe disease course by autoantibody profiling[J].Arthritis Rheumatol,2015,67(9):2427-2436.
[15] Szczerba B,Kaplonek M,Wolska N,etal.Interaction between innate immunity and Ro52-induced antibody causes Sjogren′s syndrome-like disorder in mice[J].Ann Rheum Dis,2016,75(3):617-622.
[16] Song JS,Do JH,Lee SW.The prevalence and the clinical relevance of anti-Ro52 in Korean patients with primary Sjogren′s syndrome[J].Rheumatol Int,2012,32(2):491-495.
[17] Jayakanthan K,Ramya J,Mandal SK,etal.Younger patients with primary Sjogren′s syndrome are more likely to have salivary IgG anti-muscarinic acetylcholine receptor type 3 antibodies[J].Clin Rheumatol,2016,35(3):657-662.
[18] He J,Guo J,Ding Y,etal.Diagnostic significance of measuring antibodies to cyclic type 3 muscarinic acetylcholine receptor peptides in primary Sjogren′s syndrome[J].Rheumatology,2011,50(5):879-884.
[19] Sumida T,Iizuka M,Asashima H,etal.Pathogenic role of anti-M3 muscarinic acetylcholine receptor immune response in Sjogren′s syndrome[J].Presse Med,2012,41(9 Pt 2):e461-e466.
[20] Hu Q,Wang D,Chen W.The accuracy of the anti-alpha-fodrin antibody test for diagnosis of Sjogren′s syndrome:a meta-analysis[J].Clin Biochem,2013,46(15):1372-1376.
[21] Hernandez-Molina G,Nunez-Alvarez C,Avila-Casado C,etal.Usefulness of IgA anti-alpha-fodrin antibodies in combination with rheumatoid factor and/or antinuclear antibodies as substitute immunological criterion in sjogren syndrome with negative anti-SSA/SSB antibodies[J].J Rheumatol,2016,43(10):1852-1857.
[22] Reina S,Sterin-Borda L,Borda E.Anti-M(3)peptide IgG from Sjogren′s syndrome triggers apoptosis in A253 cells[J].Cell Immunol,2012,275(1-2):33-41.
[23] Dawson LJ,Stanbury J,Venn N,etal.Antimuscarinic antibodies in primary Sjogren′s syndrome reversibly inhibit the mechanism of fluid secretion by human submandibular salivary acinar cells[J].Arthritis Rheum,2006,54(4):1165-1173.
[24] Iwabuchi Y,Masuhara T.Sialogogic activities of SNI-2011 compared with those of pilocarpine and McN-A-343 in rat salivary glands:identification of a potential therapeutic agent for treatment of Sjorgen′s syndrome[J].Gen Pharmacol,1994,25(1):123-129.
[25] Nakamura T,Matsui M,Uchida K,etal.M(3)muscarinic acetylcholine receptor plays a critical role in parasympathetic control of salivation in mice[J].J Physiol,2004,558(Pt 2):561-575.
[26] Brik R,Rosen I,Savulescu D,etal.Salivary antioxidants and metalloproteinases in juvenile idiopathic arthritis[J].Mol Med,2010,16(3-4):122-128.
[27] Zalewska A,Knas M,Gindzienska-Sieskiewicz E,etal.Salivary antioxidants in patients with systemic sclerosis[J].J Oral Pathol Med,2014,43(1):61-68.
[28] Reina S,Rodriguez M,Stranieri G,etal.Action of anti-M(3)muscarinic acetylcholine receptor IgG of primary Sjogren′s syndrome on the enzymatic antioxidant system in rat submandibular gland[J].J Oral Pathol Med,2015,44(10):876-883.
[29] Park K,Haberberger RV,Gordon T,etal.Antibodies interfering with the type 3 muscarinic receptor pathway inhibit gastrointestinal motility and cholinergic neurotransmission in Sjogren′s syndrome[J].Arthritis Rheum,2011,63(5):1426-1434.
[30] Deak M,Szvetnik A,Balog A,etal.Neuroimmune interactions in Sjogren′s syndrome:relationship of exocrine gland dysfunction with autoantibodies to muscarinic acetylcholine receptor-3 and mental health status parameters[J]Neuro Immunomodulation,2013,20(2):79-86.
[31] Namkoong E,Lee SW,Kim N,etal.Effect of anti-muscarinic autoantibodies on leukocyte function in Sjogren′s syndrome[J]Mol Immunol,2017,90:136-142.
[32] Haneji N,Nakamura T,Takio K,etal.Identification of alpha-fodrin as a candidate autoantigen in primary Sjogren′s syndrome[J]Science,1997,276(5312):604-607.
[33] Qin Q,Wang H,Wang HZ,etal.Diagnostic accuracy of anti-alpha-fodrin antibodies for primary Sjogren′s syndrome[J]Modern Rheumatol,2014,24(5):793-797.
[34] Hsu CW,Su YJ,Chang WN,etal.The association between serological biomarkers and primary Sjogren′s syndrome associated with peripheral polyneuropathy[J].Biomed Res Int,2014,2014:902492.
[35] Yamashita H,Takahashi Y,Kaneko H,etal.Thrombotic thrombocytopenic purpura with an autoantibody to ADAMTS13 complicating Sjogren′s syndrome:two cases and a literature review[J].Mod Rheumatol,2013,23(2):365-373.
[36] Yang L,Bai L,Wei F,etal.Autoantibodies against interferon-gamma reduce the frequency of pulmonary fibrosis and concentration of C-reactive protein in patients with primary Sjogren′s syndrome[J].Mod Rheumatol,2015,25(2):325-327.
[37] McNamara NA,Gallup M,Porco TC.Establishing PAX6 as a biomarker to detect early loss of ocular phenotype in human patients with Sjogren′s syndrome[J].Invest Ophthalmol Vis Sci,2014,55(11):7079-7084.
[38] Uomori K,Nozawa K,Ikeda K,etal.A re-evaluation of anti-NA-14 antibodies in patients with primary Sjogren′s syndrome:Significant role of interferon-gamma in the production of autoantibodies against NA-14[J].Autoimmunity,2016,49(5):347-356.
[39] Liu Y,Liao X,Wang Y,etal.Autoantibody to MDM2:A potential serological marker of primary Sjogren′s syndrome[J].Oncotarget,2017,8(9):14306-14313.
[40] Yoshimoto K,Fujimoto T,Itaya-Hironaka A,etal.Involvement of autoimmunity to REG,a regeneration factor,in patients with primary Sjogren′s syndrome[J].Clin Exp Immunol,2013,174(1):1-9.
[41] Fujimura T,Fujimoto T,Itaya-Hironaka A,etal.Significance of interleukin-6/STAT pathway for the gene expression of reg ialpha,a new autoantigen in sjogren′s syndrome patients,in salivary duct epithelial cells[J].Clin Rev Allergy Immunol,2017,52(3):351-363.
[42] Hamaguchi Y.Autoantibody profiles in systemic sclerosis:predictive value for clinical evaluation and prognosis[J].J Dermatol,2010,37(1):42-53.
[43] Mota LM,Santos Neto LL,Burlingame RW,etal.Disability and quality-of-life are not influenced by the prevalence of autoantibodies in early rheumatoid arthritis patients-results of the Brasilia Cohort[J].Rev Bras Reumatol,2012,52(6):824-829.
[44] Nell-Duxneuner V,Machold K,Stamm T,etal.Autoantibody profiling in patients with very early rheumatoid arthritis:a follow-up study[J].Ann Rheum Dis,2010,69(1):169-174.

