晚期糖化終末產物在乳腺癌中表達及其臨床意義
彭偉 陳津 崔兆磊 蘇光建 肖振洲 陳燕
乳腺癌是女性最常見的惡性腫瘤之一,而轉移是乳腺癌患者死亡的主要原因。了解乳腺癌轉移的相關機制對于預防和治療乳腺癌轉移具有重要作用。新近研究發現糖尿病在腸癌、肝癌、前列腺癌等多種腫瘤的發生發展中起作用[1-2],AGEs高表達于糖尿病患者體內,但有關AGEs與腫瘤轉移相關的研究甚少。本研究采用酶聯免疫吸附法檢測乳腺癌患者治療前血清AGEs的表達,分析其與乳腺癌臨床病理特征的關系,探討其在腫瘤發生、發展過程中的作用機制及其在腫瘤治療方面的臨床意義。
1 材料和方法
1.1 研究對象
選取2016年7—11月在福建省腫瘤醫院新入院且接受正規治療的160例乳腺癌患者,同時選擇已確診的纖維腺瘤、腺病伴導管擴張等乳腺良性疾病患者(30例)和健康人群(30例)。入組條件:(1) 首次發現乳腺癌患者; (2) 細胞學或病理學診斷的浸潤性乳腺癌患者; (3) KPS評分≥60分;(4)未合并其它腫瘤。排除標準:合并糖尿病病史、糖耐量受損及空腹受損的患者。按照以上標準,收集患者的姓名、性別、年齡、原發腫瘤大小狀態、區域淋巴轉移狀態[1988年美國癌癥研究委員會(AJCC)和國際抗癌聯盟(UICC)聯合制定的乳腺癌分期標準]、組織病理類型、治療前血清標志物水平等臨床資料。
1.2 研究方法
血清AGEs水平檢測:所有患者入院空腹靜脈采血3~4 ml,靜置30 min,3 000 r/min離心5分鐘,分離血清,-80℃冰箱保存待測;采用上海酶聯生物科技有限公司試劑盒,酶聯免疫吸附法檢測AGEs。
1.3 統計學方法
2 結果
2.1 乳腺癌患者血清AGEs水平
160例新入院的乳腺癌患者包括浸潤性導管癌(invasive ductal carcinoma,IDC)156例和浸潤性小葉癌(invasive lobular carcinoma,ILC)4例,平均年齡為 (51.01±10.58)歲;30例乳腺良性疾病患者和30例健康對照人群平均年齡分別為(48.32±12.66)歲和(50.46±11.45)歲,與乳腺癌組均差異無統計學意義;三組每例患者均進行血清AGEs檢測,乳腺癌組平均表達水平分別為(124.84±74.86)μg/ml,明顯高于乳腺良性疾病組[(102.11±42.83)μg/ml,P=0.039)]及健康對照組[(97.85±37.87)μg/ml,P=0.020)],差異具有統計學意義。
2.2 血清AGEs水平與各臨床病理特征的關系
根據不同病理特征分組分析發現:不同的患者年齡、病理類型間AGEs表達水平沒有明顯差異;AGEs表達水平與原始腫瘤大小(T)、雌激素受體(estrogen receptors,ER)、孕激素受體(progesterone receptors,PR)及原癌基因人類表皮生長因子受體2(human epidermal growth factor receptor-2,Her-2)的表達水平沒有明顯關聯。在平衡年齡因素后發現,區域淋巴結轉移狀況(N)2-3級患者(137.72±86.65)μg/ml AGEs表達水平明顯高于N0-1級患者(117.51±66.76)μg/ml,差異具有統計學意義(P=0.025);臨床分期Ⅲ~Ⅳ期患者(136.56±85.27)μg/ml AGEs表達水平明顯高于Ⅰ~Ⅱ期患者(117.81±67.49)μg/ml,差異具有統計學意義(P=0.045)。見表1。
3 討論
乳腺癌是女性最常見的惡性腫瘤,而轉移是乳腺癌患者死亡的主要原因。新近研究發現糖尿病在腸癌、肝癌等多種腫瘤的發生發展中起作用[1-2],AGEs高表達于糖尿病患者體內,但有關其與腫瘤轉移相關的研究甚少。本研究檢測乳腺癌患者治療前血清AGEs表達水平,發現血清AGEs的表達與區域淋巴結轉移狀況、臨床分期相關,提示AGEs在乳腺癌的侵襲和轉移中起作用。
AGEs是還原糖如葡萄糖的羰基與蛋白質、核酸等生物大分子通過非酶糖基化作用形成可逆產物Schiff堿和Amadori產物,后者再經過一系列分子重排形成不可逆的聚合物,所產生的系列聚合物。已有研究發現AGEs在糖尿病及其并發癥、腎臟疾病等慢性疾病及衰老的病理機制中有重要的作用[3]。近年,越來越多的研究發現糖尿病在腸癌、肝癌等多種腫瘤的發生發展中起作用[1-2]。DE等發現合并糖尿病的乳腺癌患者區域治療失敗時間(DFS)和總生存時間(OS)明顯短于未合并糖尿病的患者[4];Hou等發現糖尿病是乳腺癌預后差的獨立危險因子[5],表明糖尿病參與了乳腺癌的病情進展。
AGEs高表達于糖尿病患者體內,而糖尿病在乳腺癌侵襲轉移中起作用,但有關AGEs在乳腺癌細胞侵襲轉移中作用的研究鮮有報道。有研究[6]發現:AGEs促進乳腺癌細胞MDA-MB-231增殖,并通過上調表達基質金屬蛋白酶(MMP)-9,使乳腺癌細胞侵襲和遷移能力增強;同時,Stratigoula等[7]的研究發現AGEs高表達于腸癌組織中,并且與腫瘤的病理分級相關,本研究結果顯示:在平衡年齡等因素后,160例新入院的乳腺癌患者平均表達水平分別為(124.84±74.86)μg/ml,明顯高于乳腺良性疾病組(102.11±42.83)μg/ml及健康對照組(97.85±37.87)μg/ml;進一步分析發現血清AGEs水平與患者區域淋巴結轉移狀況和臨床分期密切相關,區域淋巴結轉移狀況(N)2-3級患者(137.72±86.65)μg/ml AGEs表達水平明顯高于N0-1級患者(117.51±66.76)μg/ml,差異具有統計學意義(P<0.05);臨床分期Ⅲ-Ⅳ期患者(136.56±85.27μg/ml)表達水平明顯高于Ⅰ~Ⅱ期患者(117.81±67.49)μg/ml,差異具有統計學意義(P<0.05),與Stratigoula等的研究結果一致。
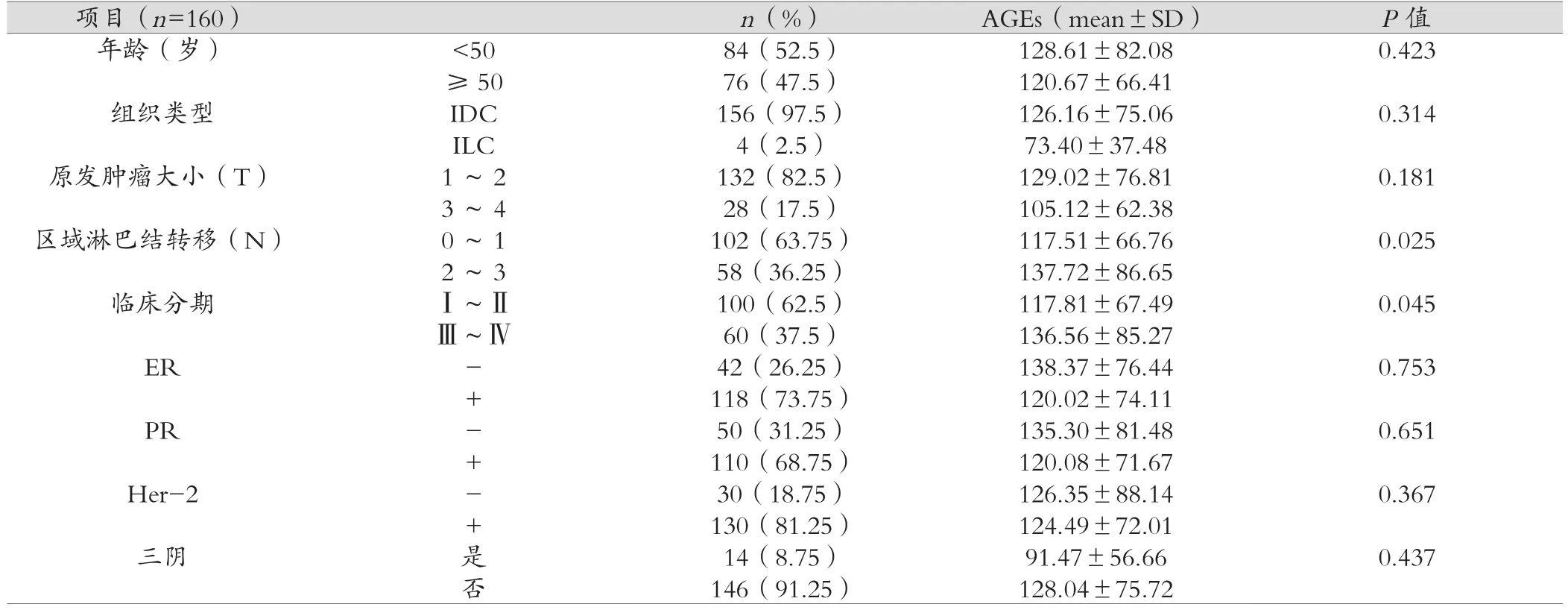
表1 血清AGEs水平與乳腺癌臨床病理特征的關系
本研究結果顯示AGEs在乳腺癌患者體內表達增高,同時與乳腺癌淋巴結轉移分級、臨床分期密切相關。AGEs在乳腺癌轉移中起作用的機制可能與其受體晚期糖化終末產物受體(RAGE,receptor of advanced glycation endproducts)有關。RAGE是細胞表面表達的免疫球蛋白超家族成員之一,表達于多種腫瘤細胞表面,通過與多種配體結合,參與腫瘤的分裂增殖、浸潤、轉移等多種生物學效應[8-9]。Fuentes等[10]發現S100P/RAGE通過ERK磷酸化和NF-κB活化促進腸癌細胞增殖和轉移;Chen等發現[11]HMGB1/RAGE通過ERK/c-Myc 通路下調P21表達,使肝癌細胞表達基質金屬蛋白酶MMM-2增多,參與肝癌進展。
總之,AGEs在乳腺癌患者體內表達增高,同時與乳腺癌淋巴結轉移分級、臨床分期密切相關,可能在乳腺癌發生和轉移中起作用,有可能成為乳腺癌治療的新靶點。同時,AGEs高表達于糖尿病患者體內,對于治療合并糖尿病的乳腺癌患者具有一定的臨床指導意義。在以后的研究中,我們將進一步深入研究AGEs參與乳腺癌侵襲轉移的機制,以期為乳腺癌的臨床診斷、預后評估及治療等奠定實驗及理論基礎。
[1] Bella F,Minicozzi P,Giacomin A,et al. Impact of diabetes on overall and cancer-specific mortality in colorectal cancer patients[J]. J Cancer Res Clin Oncol,2013,139(8):1303-1310.
[2] Minicozzi P,Berrino F,Sebastiani F,et al. High fasting blood glucose and obesity significantly and independently increase risk of breast cancer death in hormone receptor-positive disease[J]. Eur J Cancer,2013,49(18):3881-3888.
[3] Jie You,Wei Peng,Xu Lin,et al. PLC/CAMK IV–NF-κB involved in the receptor for advanced glycation endproducts mediated signaling pathway in human endothelial cells[J]. Molecular and Cellular Endocrinology,2010,320(1-2):111-117.
[4] He DE,Bai JW,Liu J,et al. Clinicopathological characteristics and prognosis of breast cancer patients with type 2 diabetes mellitus[J].Molecular and clinical oncology,2015,3(3):607-612.
[5] Guofang Hou,Sheng Zhang,Xiaobei Zhang,et al. Clinical pathological characteristics and prognostic analysis of 1,013 breast cancer patients with diabetes[J]. Breast Cancer Res Treat,2013,137(3):807-816.
[6] Hana Sharaf,Sabine Matou-Nasri,QiuyuWang,et al. Advanced glycation endproducts increase proliferation,migration and invasion of the breast cancer cell line MDA-MB-231[J]. Biochimica et Biophysica Acta,2015,1852:429-441.
[7] Stratigoula Sakellariou,Paraskevi Fragkou,Georgia Levidou,et al. Clinical significance of AGE-RAGE axis in colorectal cancer:associations with glyoxalase-I,adiponectin receptor expression and prognosis[J]. BMC Cancer,2016,16(1):174.
[8] Ji-Ming Bao,Min-Yi He ,Ya-Wei Liu, et al. AGE/RAGE/Akt pathway contributes to prostate cancer cell proliferation by promoting Rb phosphorylation and degradation[J]. Am J Cancer Res,2015,5(5):1741-1750.
[9] Leclerc E,Vetter SW. The role of S100 proteins and their receptor RAGE in pancreatic cancer[J]. Biochim Biophys Acta,2015,1852(12):2706-2711.
[10] Fuentes MK,Nigavekar SS,Arumugam T,et al. RAGE activation by S100P in colon cancer stimulates growth,migration,and cell signaling pathways[J]. Dis Colon Rectum,2007,50(8):1230-1240.
[11] Chen Y,Lin C,Liu Y,et al. HMGB1 promotes HCC progression partly by downregulating p21 via ERK/c-Myc pathway and upregulating MMP-2[J]. Tumour Biol,2016,37(4):4399-4408.

