番茄紅素對2型糖尿病腎臟的保護作用及其機制研究
王芳 張萍 韓娟 馬佳佳


【摘要】目的:研究番茄紅素對實驗性糖尿病小鼠腎臟的氧化應激損傷的保護作用。方法:采用高能量飼料加鏈脲佐菌素制備2型糖尿病小鼠模型。建模成功后,實驗組分別給予口服灌胃40mg/kg和80mg/kg劑量的番茄紅素,每周5次,連續治療8周。第8周后剪尾采血測定血糖值變化。腹主動脈取血分離血清。分別用試劑盒測定SOD、GSH-Px以及24h尿蛋白的含量。H&E染色觀察腎臟組織病理形態的變化,RT-PCR法檢測腎組織中血紅素氧合酶一1(HO-1) mRNA的表達。結果:與正常對照組相比糖尿病模型組尿蛋白含量顯著上升,SOD和GSH-Px含量明顯減少,而經過番茄紅素治療后,SOD和GSH-Px的含量明顯提升,病理學形態也明顯得到改善。結論:番茄紅素能降低糖尿病小鼠動物模型的尿蛋白,改善腎臟功能,減輕腎組織的病理損傷,增強HO-1 mRNA的表達水平,可減緩糖尿病早期的腎損傷。
【關鍵詞】番茄紅素;糖尿病;血紅色氧合酶一1;腎損傷
糖尿病腎病是糖尿病最常見的慢性并發癥之一,也是糖尿病患者致死、致殘的主要原因之一[1]。以往的研究認為,實驗性糖尿病的發病與氧自由基反應增加和氧自由基酶類活性降低有密切關系[2],同時發現血紅素氧合酶一l (heme oxygenase-l,HO-I)具有抗感染、抗氧化、抗凋亡及抗增生效應。有研究報道HO-1上可以被多種因素誘導表達,提示HO-1可能作為一種自我保護因子被刺激分泌。番茄紅素是一種具有13個雙鍵的直鏈烴化物,屬于類胡蘿卜素,廣泛存在于番茄、胡蘿卜等紅色蔬菜和水果中。大量的研究表明,番茄紅素具有抗氧化性、降血脂、抗腫瘤、保護心血管、增強機體免疫力等多種生物學效應[3]。本研究主要采用高脂、高糖和鏈脲佐菌素(STZ)方式制備2型糖尿病小鼠模型,研究番茄紅素對2型糖尿病腎病的保護作用及其機制。
1 材料與方法
1.1 實驗材料
I.l.l 實驗動物
健康的雄性C57BL/6J小鼠60只,體重18-22g,購自西安交通大學實驗動物中心,生產許可證號【SYXK(陜)2014-003】;動物飼養在西安交通大學實驗動物中心SPF動物實驗室,使用許可證號:【SYXK(陜)2015-002】。墊料采用滅菌楊樹木刨花墊料,飼料為鈷源照射處理的全價顆粒飼料,飲水為高壓滅菌的無菌水,光照周期為12h/12h。動物實驗和飼養條件嚴格按照SPF動物的規范要求進行操作。
1.1.2 主要試劑盒儀器
鏈脲佐菌素(STZ)購自sigma公司;谷胱甘肽過氧化物酶( GSH-PX)測定試劑盒(比色法)(貨號:A005);總超氧化物歧化酶(SOD)測定試劑盒(WST-I法)(貨號:A001-3);尿蛋白定量測試盒(CBB法)(貨號:C035-2)均購自南京建成生物工程研究所;羅氏血糖儀及試紙條通過剪尾取血測定血糖濃度;總RNA提取試劑盒購自QIAGEN(貨號:DP431)。
2 方法
2.1 糖尿病動物模型的篩選及分組
C57BL/6J小鼠60只,適應性飼養3天后,60%熱量的高脂飼料飼養4w后,空腹12h,使用pH4.5,50mM的檸檬酸緩沖液配置SZT,使其終濃度為4mg/ml[4]。每只動物按40mg/kg腹腔注射SZT。飲水替換為10%蔗糖水。此后4天,每天給予同樣處理,由于STZ容易降解,每次使用需新鮮配制。第6天開始,撤掉蔗糖給予正常無菌水飼養。48h后尾靜脈采血測定血糖值,血糖值大于ll.lmmol/L的選為實驗對象[4],隨機分為糖尿病組,番茄紅素40mg/kg組合番茄紅素80mg/kg組。其余動物淘汰處理。由于番茄紅素不溶于水,選用25%聚氧乙烯蓖麻油作為增溶劑溶解番茄紅素,分別配置番茄紅素兩個不同劑量進行口服灌胃治療。糖尿病組和正常對照組采用25%聚氧乙烯蓖麻油灌胃。連續治療8W后進行檢測。
2.2 尿蛋白濃度和血糖的測定
將番茄紅素干預末期的各組動物轉移至代謝籠內飼養24h,收集尿液。并通過尿蛋白定量測試盒(CBB法)測定動物的尿蛋白含量。血糖測定前,各組動物空腹12h后,通過剪尾取血的方式,利用羅氏血糖儀剪尾采血測定血糖值并記錄。
2.3 氧化應激指標的測定與觀察
氧化應激是體內活性氧化物質的產生和抗氧化防御體系之間失衡所致的損傷。糖尿病存在明顯的氧化應激。SOD和GSH-Px是人體氧化酶促反應中主要的兩種酶,在維持體內的氧化抗氧化動態平衡和免疫動態平衡中發揮重要的作用。利用谷胱甘肽過氧化物酶( GSH-PX)測定試劑盒和總超氧化物歧化酶(SOD)測定試劑盒。
2.4 腎組織的病理形態觀察
小鼠頸椎脫臼處死后,摘取一側腎臟,4%多聚甲醛固定,室溫保存72h后切片,H&E染色。顯微鏡下觀察糖尿病模型的腎損傷和番茄紅素對腎臟的保護修復效果。2.5腎臟組織中HO-1表達的測定
取新鮮的腎臟組織lOOmg液氮處理,加Iml的Trizol裂解并研磨。按照總RNA提取試劑盒提取小鼠總RNA。QIAGEN的Total RNA抽提試劑盒抽提組織中的總RNA。測定RNA濃度和純度后逆轉錄成cDNA,設計HO-I引物:HO-1-F:AGGTACACATCCAAGCCGAGA; HO-1-R: CATCACCAGCTTAAAGCCTTCT;p-actin-F: GGCTGTATTCCCCTCCATCG;p-actin-R: CCAGTTGGTAACAATGCCATGT。擴增產物1.6%瓊脂糖核酸電泳,凝膠成像儀成像并分析,ImageJ進行灰度掃描,計算HO-1基因的相對表達含量。
3 結果
3.1 番茄紅素能對有效控制糖尿病動物的尿蛋白和血糖
經過8周的資番茄紅素治療后,各組動物飼養在代謝籠中,收集24h的尿液。通過CBB法,按照試劑盒說明書測定各組小鼠的尿蛋白含量。同時,尾靜脈采血測定經番茄紅素治療后各組動物的血糖值(圖1)。
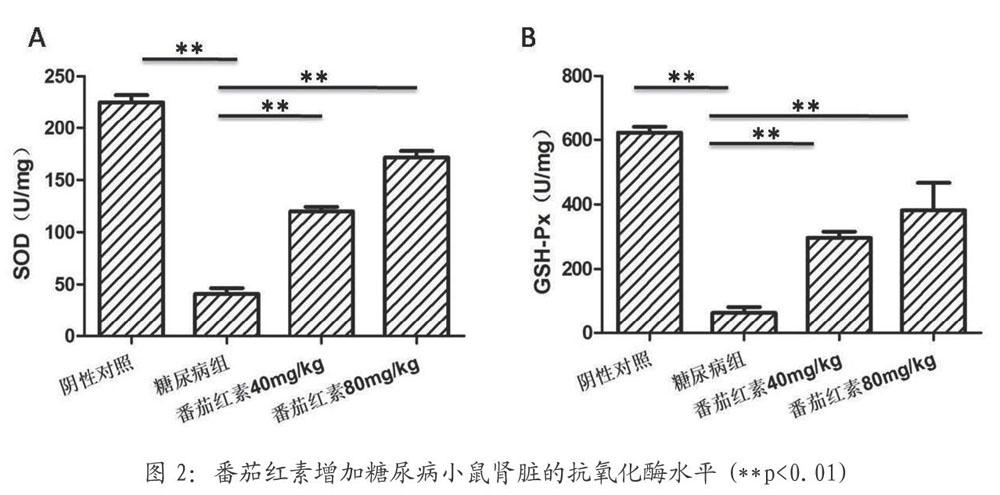
3.2 番茄紅素能改善糖尿病模型動物的氧化應激水平
與正常陰性對照組相比較,糖尿病動物模型的SOD和GSH-Px的含量明顯被抑制。隨著血清番茄紅素水平的增加,血清中SOD和GSH-Px含量升高。機體抗氧化能力得到了顯著提升。有效保護糖尿病腎損傷(圖2)。
3.3 番茄紅素能改善糖尿病動物腎臟的病理損傷
STZ誘導的糖尿病模型鼠腎臟出現典型的腎小球損傷,如腎小球硬化,細胞空泡化,基底膜增生以及炎性細胞浸潤等病例表現。而經過番茄紅素的干預后,損傷得到一定的控制。形態學也反映出細胞損傷減輕、細胞壞死減少,炎性細胞親潤減輕并對腎基底膜進行有效的修復(圖3)。
3.4 番茄紅素通過上調HO-1在糖尿病腎臟中的表達對腎臟發揮保護作用
與正常的陰性對照小鼠比較,未進行干預的糖尿病模型組小鼠的HO-I水平被顯著抑制。而通過連續的給予番茄紅素干預后,腎臟組織HO-1的mRNA水平得到了有效提升,證實番茄紅素對糖尿病腎損傷的保護主要是通過抗氧化的機制來實現修復了(圖4)。
4 討論
糖尿病是一種具有遺傳特征性的慢性內分泌代謝系統疾病.隨著飲食結構及生活習慣的改變,糖尿病的發病率逐年上升,嚴重危害人們的生活質量。長期血糖控制不佳的糖尿病患者往往伴有多器官組織的并發癥,是糖尿病患者致殘、甚至致死的主要原因。隨著病理生理學研究的不斷深入,發現糖脂代謝異常而導致的氧自由基過剩,以及所引發的氧化應激損傷是糖尿病損傷及其并發癥發生發展的共同通路之一。糖尿病主要表現為高血糖癥,是血液中過量的葡萄糖引起的代謝障礙。當長期出現這種癥狀,血糖應激會導致臟器病理改變,如糖尿病腎損傷研究發現在糖尿病病程發展早期,SOD含量升高,說明腎臟局部存在氧化應激反應及超氧化物的過度產生,進而引發糖尿病腎損傷[5,6]。
氧化應激是體內活性氧產生和抗氧化防御體系之間失衡而導致組織損傷的一種狀態。大量的研究表明,糖尿存在明顯的氧化應激,并且氧化應激與糖尿病各種慢性病并發癥主要發病機制幾乎均有相關性[7]。機體抗氧化損傷防御體系包括酶促和非酶促體系兩部分,通過消除自由基和活性氧,分解過氧化物,除去起催化作用的金屬離子等功能來維護機體健康。SOD,GSH-Px是機體抗氧化酶促系統中主要的兩種酶,SOD能夠提供氫原子配體進而催化還原氧自由基生成過氧化氫,并且在GSH-Px催化作用下進一步還原生成對人體無害的水和氧氣。在臨床檢測中,尿蛋白含量能夠反映腎功能受損傷的程度[9]。本研究結果也證實,糖尿病腎損傷的小鼠體內SOD和GSH-Px含量減少,而用抗氧化效果明顯的番茄紅素治療后,SOD、GSH-Px的含量顯著增多。在我們的實驗中,STZ誘導的糖尿病小鼠尿液中蛋白含量增加,番茄紅素的抗氧化治療能有效的控制并減少尿蛋白含量。番茄紅素的抗氧化能力可以通過增加SOD,GSH-Px的活力,從而提高機體抗氧化系統能力,降低對毒物的敏感性[10]。此外,HO-1作為一種重要的血紅素分解代謝酶,能催化血紅素生成膽綠素。并能夠異化游離血紅素為CO,正常水平的CO能通過調節IL-10/1R通路介導抗炎的特性[11,12],而STZ誘導的糖尿病小鼠模型伴有內源性的腎氧化應激使得HO-1的mRNA維持在較低水平。但番茄紅素有效的改善了腎臟的抗氧化活性,我們推測HO-1的表達與增強機體的抗氧化能力具有潛在的相關性,通過HO-1的表達維持腎臟代謝的穩定性。
參考文獻
[1] Gueut in V,Gauthier M,CazenaveM, et al. Diabetic nephropathy:emerging treatments. NephrolTher, 2014,10 (04): 210-5.
[2] Fraser ML, Lee AH, Binns CW.Lycopene and prostate cancer:emerging evidence. Expert RevAnticancer
The r. 2005;5 (05): 847- 54。
[3]Li W,Wang G,Lu X,et al. Lycopeneameliorates renal functionin rats with streptozotocin-induceddiabetes. Int J Clin ExpPathol. 2014;7 (08): 5008-15.
[4]K.Wu, T. Liang,X.Duan,e tal.Antidiabetic effectsof puerarin, isolated fromPueraria lobata (Willd.),onstreptozotocin-diabetogenicmice through promoting insulinexpression and amelioratingMetabolic function,Food Chem.Toxicol, 2013, 60, 341-347.
[5]P. Bjorns tad,D. Cherney,D.M.Maahs,Early diabetic nephropathy intype l diabetes: new insights,Curr. Opin. Endocrinol. , DiabetesObes., 2014, 21, 279-286.
[6] Anbar HS, Shehatou GS, Suddek GM,et al.Comparison of the effectsof levocetirizine and losartan ondiabetic nephropathy and vasculardysfunction in streptozotocin-induced diabeticrats. Eur JPharmacol. 2016; 780: 82-92.
[7] Brownlee M. The pathobiologyof diabetic complications: aunifying mechanism. Diabetes,2005Jun; 54 (06):1615-25.
[8] A. Djordjevic, S. Spasic, A.Jovanovic-Galovic, et al. Oxidativestress in diabetic pregnancy:SOD,CAT and GSH-Px activity and lipidperoxida tion
produc t s, J. Ma tern. -Fetal Neona t. Med. , 2004, 16, 367-372.
[9] J. Y. Guh,Proteinuria versusalbuminuria in chronic kidney disease, Nephrology, 2 01 0, 15, 5 3-56.
[10] Rodriguez MP, Emond ZM, WangZ, et al. Role of Metabolicenvironment on nitric oxidemediated inhibition of neointimalhyperplasia in type l and type 2diabetes. Nitric Oxide. 2014 Jan30, 36: 67-75.
[11] R. Gozzelino, V. Jeney, M.P. Soares,Mechanisms of cellprotection by heme oxygenase-1, Annu. Rev. Pharmacol.Toxicol., 2010, 50, 323-354.
[12] P. Mandal, M. T. Pritchard, L. E.Nagy,Antiinflammatory pathwaysand alcoholic liver disease: roleof an adiponectin/interleukin-10/heme oxygenase-l pathway, World J.Ga s troenterol. , 2010, 16, 1330-1 336.

