老年肺癌晚期酪氨酸激酶抑制劑治療后循環腫瘤細胞與T細胞亞群的相關性
涂長玲 江 波 金從國 何文杰 朱 穎
(昆明醫科大學第三附屬醫院 云南省腫瘤醫院干部醫療科,云南 昆明 650118)
肺癌是我國發病率最高的惡性腫瘤之一,約有 50%的患者年齡在 65 歲以上〔1〕。含鉑雙藥化療在晚期非小細胞肺癌(NSCLC)一線治療領域中的標準地位已經確立,同時也達到了其療效平臺〔2,3〕。對于>65歲或體力狀態(PS)評分>2分的老年NSCLC患者,化療往往會引起嚴重的毒副反應,不能耐受。化療在殺傷腫瘤細胞同時,也對機體正常細胞造成破壞和殺傷,使得患者的免疫功能受到損傷〔4〕,對療效產生不利的影響。表皮生長因子受體(EGFR)突變型患者對EGFR-酪氨酸激酶抑制劑(TKI)類藥物的有效率可達65%~83%,且副作用輕耐受性好,EGFR-TKI類藥物已成為老年EGFR突變晚期NSCLC的一線治療藥物。目前利用外周血循環腫瘤細胞(CTC)檢測EGFR突變已成為肺癌領域研究的熱點〔5,6〕。經過TKI治療后患者細胞免疫抑制狀態及細胞免疫調節功能得以改善〔7〕,但外周血CTC與細胞免疫功能相關性尚未明確。本研究以晚期老年NSCLC為研究對象,以外周血CTC為載體,旨在探討CTC表達與T細胞亞群、自然殺傷(NK)細胞及預后的相關性。
1 資料與方法
1.1臨床資料 云南省腫瘤醫院2012年9月至2014年5月收治且經病理組織學診斷的晚期NSCLC患者66例,其中男40例,女26例,年齡65~78歲,中位年齡68歲,病理類型:腺癌58例,鱗癌8例。TNM分期:ⅢB期4例,Ⅳ期62例,ECOG標準PS評分0~3分。治療前后均行胸腹部CT、彩超、顱腦磁共振成像(MRI)、心電圖,血常規、血生化及腫瘤標志物檢查,預計生存在3 個月以上,心、肝、腎功能基本正常,無免疫系統疾病。
1.2治療方法 隨機從以下3種EGFR-TKI類藥物中任選一種。吉非替尼片(阿斯利康公司生產)使用劑量為每次250 mg,口服,1次/d;厄洛替尼片(美國羅氏公司生產)使用劑量為每次150 mg,口服,1次/d;鹽酸埃可替尼片(浙江貝達藥業公司生產)使用劑量為每次125 mg,口服,3次/d。無論選擇何種藥物均至少服用1個月。
1.3標本采集 所有患者在治療前先從肘正中靜脈中抽血5 ml,加入肝素抗凝混勻,并在采集后2 h內進行檢測。
1.4抗體及試劑 CD45-PC5、CK18-FITC、EGFR-PE、NH4Cl溶血素,均購于美國Beckman coulter公司。流式細胞儀EPICS XL(美國Beckman coulter公司)。
1.5分選CD45-CK18+細胞 將外周血20 ml分成20份加入5 ml的無菌試管中,每管1 ml;每管均加入CD45-PC5、CK18-FITC各200 μl(按標準100 μl外周血加入20 μl的試劑量),避光保存30 min;加入NH4Cl溶血素4 ml,反復溶血,直到液體透亮,離心后加入培養液待分選;消毒ALTRA流式室,調節室內溫度到8℃左右,開機,換上偏振板,進入SORT界面,調整Freq、Drive參數,上Flow-Check,找到分選時的Delay,打開檢測CD45-CK18+的方案中以FS PEAK為閾值,在SORT功能,按Receive,接受上面的分選參數,確定檢測后,設置SORT的左右收集細胞群,一般左邊為CD45-CK18+細胞,右邊為非CD45-CK18+細胞,收集數目根據要求設置,同時在樣本收集處安裝收集試管,上分選試管,開始收集細胞,收集過程中需要全程振蕩,同時每30 min需要觀察。分選CD45-CK18+細胞近1 000個就可以結束。
1.6流式細胞測定 各采集TKI治療前1 d及治療1個月后1 d清晨外周血5 ml,T細胞亞群檢測:肝素抗凝的全血100 μl,加入10 μl CD45-FITC/CD4-RD/CD8-ECO/CD3-P15;NK細胞檢測:肝素抗凝的全血100 μl,加入20 μl CD45-PC5/CD3/CD16+56-PE。上述標本室溫避光靜置30 min后上機檢測,所有抗體購于美國Beckman coulter公司,采用流式細胞儀EPICS XL檢測,檢測方法按照說明書執行。
1.7療效評價 療效按RECIST1.1實體瘤評價標準分為:完全緩解(CR)、部分緩解(PR)、疾病穩定(SD),疾病進展(PD),CR+PR為有效,CR+PR+SD為控制。無進展生存期(PFS)指自治療首日至病變進展日;總生存期(OS)為自治療首日至死亡日或失訪日,均以月計算。隨訪截止時間:2015年6月。
1.8統計學方法 應用SPSS13.0統計軟件包進行t檢驗和生存分析Kaplan-Meier法,Log rank法檢驗。
2 結 果
2.1CTC水平與T細胞亞群及NK細胞的關系 本試驗CTC水平在92~382,以其中位數198為分界點分為CTC高表達組和CTC低表達組。高表達組CD3+、CD4+顯著低于低表達組、CD8+顯著高于低表達組,CD4+/CD8+倒置,細胞免疫功能顯著低于CTC低表達組(P<0.001);NK細胞顯著高于低表達組(P<0.001)。見表1。
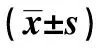
表1 CTC表達水平與T細胞亞群及NK細胞的關系
2.2TKI治療前后CTC表達水平與T細胞亞群及NK細胞變化的關系 CTC高表達組治療前后T細胞亞群及NK細胞差異無統計學意義(P>0.05),CTC低表達組CD3+、CD4+、CD4+/ CD8+顯著升高,CD8+、NK水平顯著下降(P<0.05),見表2。
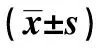
表2 CTC高、低表達組治療前后T細胞亞群的變化
與治療前比較:1)P<0.05
2.3CD4+/CD8+與OS、PFS的關系 本組病例中位OS為15個月,1年生存率為60.6%,2年生存率為33.3%,3年生存率為12.1%。CD4+/CD8+比值<1為低表達組,≥1為高表達組。兩組OS差異有統計學意義(χ2=5.012,P=0.025),見表3、圖1。本組病例PFS為6個月。CD4+/CD8+低表達和高表達組中位PFS差異有統計學意義(χ2=8.863,P=0.013),見表4、圖1。
2.4NK細胞與OS、PFS的關系 NK細胞≥15.7%為高表達組,<15.7%為低表達組。NK細胞高表達和低表達組中位OS差異有統計學意義(χ2=17.958,P=0.000),見表5、圖2。NK細胞高表達和低表達組中位PFS差異有統計學意義(χ2=15.401,P=0.000),見表6、圖2。

表3 CD4+/CD8+不同表達組OS比較
與高表達組比較:1)P<0.05;表4同

表4 CD4+/CD8+不同表達組PFS比較

圖1 CD4+/CD8+表達水平與晚期NSCLC患者OS、PFS關系


圖2 NK表達水平與晚期NSCLC患者OS、PFS的關系

表5 NK不同表達組OS比較
與高表達組比較:1)P=0.000;表6同

表6 NK不同表達組PFS比較
3 討 論
CTC是一種從原發灶或轉移灶中脫落的腫瘤細胞,這些細胞可能經周圍的血管進入血液循環〔8〕,大部分因宿主的免疫系統、血流剪切力或自身凋亡而死亡。CTC存在于晚期肺癌患者外周血中,患者的細胞免疫功能受到嚴重抑制,無法及時清除循環系統中腫瘤細胞,少數有高度活力、高度轉移潛能的細胞存活下來〔9〕,穿過血管及淋巴管,與血管內皮黏附,定植于次級或遠處器官,實現腫瘤的轉移〔10〕。
肺癌患者外周血 T 細胞亞群和NK細胞活性的變化,是反映患者機體細胞免疫功能狀態和判斷療效的重要指標〔11〕。CD3+T 細胞通常代表機體總T 細胞數量,CD4+T細胞代表T 輔助細胞,是人體抗腫瘤免疫的重要組成部分,可以通過干擾素(INF)-γ介導的機制直接殺傷腫瘤細胞〔12,13〕,對細胞免疫起正調節作用。CD8+T 細胞則代表T 抑制細胞,抑制機體免疫應答,也對靶細胞有一定殺傷作用,起負調節作用。CD4+/CD8+比值可以反映機體細胞免疫功能狀態,比值降低表明機體細胞免疫功能降低,抗腫瘤能力減弱。研究顯示,經過TKI治療后NSCLC患者細胞免疫抑制狀態得到明顯改善,靶向治療改善了NSCLC患者細胞免疫調節功能〔7〕。老年晚期NSCLC患者體質差,病情復雜,多伴有并發癥,免疫功能低,特別是細胞免疫功能常處于低水平。
NK細胞是細胞免疫中非特異性成分,不依賴抗體和補體,不需預先活化即可直接殺傷腫瘤細胞,并能分泌細胞因子參與免疫調節,而且NK 細胞還具有適應性免疫的特性〔14〕。NK 細胞殺傷靶細胞主要是通過穿孔素和顆粒酶B引起靶細胞的裂解,同時也可被腫瘤壞死因子(TNF) 激活殺傷靶細胞〔15〕,是一類在早期抗腫瘤免疫機制中起重要作用的效應細胞。
綜上,老年NSCLC患者CTC表達水平與細胞免疫功能呈負相關,TKI治療使CTC低表達者免疫功能得到改善,且主要體現在細胞免疫功能上,CD4+/ CD8+低表達、NK細胞高表達患者能有更長的OS及PFS。由于TKI可改善晚期NSCLC患者的細胞免疫功能,且有效可能亦與免疫功能增強有關,對此需要進一步研究TKI改善NSCLC患者細胞免疫功能的機制。分子靶向藥物為老年晚期NSCLC的治療帶來了希望,還需要明確治療的優勢人群、發掘更多的治療靶點及相關的預后和預測標志物。
1姜宏寧,余 敏.吉西他濱單藥治療老年晚期非小細胞肺癌的療效分析〔J〕.臨床肺科雜志,2009;14(2):196-7.
2Jemal A,Siegel R,Ward E,etal.Cancer statistics,2009〔J〕.CA Cancer J Clin,2009;59(4):225-49.
3Azzoli CG,Baker S Jr,Temin S,etal.American Society of Clinical Oncology Clinical Practice Guideline update on chemotherapy for stage Ⅳ non-small-cell lung cancer〔J〕.J Clin Oncol,2009;27(36):6251-66.
4Georgoulias V,Douillard JY,Khayat D,etal.A multicenter randomized phase Ⅱ efficacy study of vx-001,a peptide based cancer vaccine as maintenance treatment in advanced non-small-cell lung cancer:treatment rationale and protocol dynamics〔J〕.Clin Lung Cancer,2013;14(4):461-5.
5Fiorelli A,Accardo M,Carelli E,etal.Circulating tumor cells in diagnosing lung cancer:clinical and morphologic analysis〔J〕.Ann Thorac Surg,2015;99(6):1899-905.
6Punnoose EA,Atwal S,Liu W,etal.Evaluation of circulating tumor cells and circulating tumor DNA in non-small cell lung cancer:association with clinical endpoints in a phase Ⅱ clinial trial of pertuzumab and erlotinib〔J〕.Clin Cancer Res,2012;18:2391-401.
7張金標,鄭 航,尤長宣,等.靶向治療后肺癌患者外周血T淋巴細胞亞群的表達變化及意義〔J〕.山東醫藥,2011;51(18):55-6.
8Elshimali YI,Grody WW.The clinical significance of circulating tumor cells in the peripheral blood〔J〕.Diagn Mol Pathol,2006;15(4):187-94.
9喬媛媛.循環腫瘤細胞及其與腫瘤轉移復發的相關性研究〔J〕.現代腫瘤醫學,2011;19(9):1877-80.
10Paget JA,Restall IJ,Daneshmand M,etal.Repression of cancer cell senescence by PKCiota〔J〕.Oncogene,2012;31(31):3584-96.
11Heidemann F,Schildt A,Schmid K,etal.Selectins mediate small cell lung cancer systemic metastasis〔J〕.PLoS One,2014;9(4):923-7.
12Zhang S,Bernard D,Khan WI,etal.CD4+T-cell-mediated antiturnor immunity can be uncoupled from autoimmunity via the STAT4/STAT6 signaling axis〔J〕.Eur J Immunol,2010;39(5):1252-9.
13Hu Z,Lin D,Yuan J,etal.Overexpression of osteopontin is 11880-eiated with more aggressive phenotypes in human non-small cell lung cancer〔J〕.Clin Cancer Res,2005;11(13):4646-52.
14Sun JC,Beilke JN,Lanier LL.Adaptive immune features of natural killer cells〔J〕.Nature,2009;457(7229):557-61.
15Fietta P,Delsante G.Focus on human natural killer cells〔J〕.Riv Biol,2009;102(2):219-35.

