分銀渣中鉛、銀和銻一步浸出機理及工藝
鄒祥宇,羅清威,徐 峰,艾桃桃,劉 艷,孟凡瑩(陜西理工大學 材料科學與工程學院,陜西 漢中 723000)
分銀渣是銅陽極泥經過處理后所留下的尾渣.其成分復雜,貴金屬含量低,處理困難.傳統處理工藝是對分銀渣中單一元素進行回收,這不但會造成資源浪費,也會嚴重污染環境[1].分銀渣處理工藝根據其金屬元素種類和含量的不同而多種多樣.陸鳳英等[2]采用先一次分離,再逐個提取的工藝對分銀渣中各金屬進行回收利用.孫文達[3]采用火法熔煉和濕法浸出相結合的工藝富集貴溪冶煉廠分銀渣中金和銀.劉勇等[4]采用還原熔煉法還原電路板銅陽極泥分銀渣中金屬鉛和錫以鉛錫合金.申勇峰等[5]研究分銀渣中的鈷、鎳金屬回收機理.李義兵等[6]以鉛銻含量較高的分銀渣為研究對象,研究在NaCl-HCl體系中同時提取鉛銻工藝.
本實驗采用NaCl-CaCl2-HCl體系一步浸出工藝,富集回收分銀渣中的鉛、銀、銻金屬,加入NaCl可以提高鉛、銀、銻等金屬氯化物的溶解度,同時還能提高溶液的沸點,從而可允許在更高的溫度下浸出.新工藝對實現分銀渣資源循環利用和環境保護都具有重要意義.
1 實驗
1.1 原料
實驗原料為國內某大型銅冶煉廠提供的分銀渣,其ICP全元素分析結果如表1所示.
由表1可知,分銀渣含鋇、鉛、錫、銀、銻等元素較多,具有較高的綜合回收價值.

表1 分銀渣成分(質量分數)Table1 Contents of silver separated residue (mass fraction ) %
1.2 實驗方法
實驗在集熱式恒溫磁力攪拌水浴鍋中進行,控溫精度為±1 ℃.當水浴鍋溫度達到實驗溫度時,向配好的NaCl-CaCl2-HCl體系中加入50 g分銀渣,啟動磁力攪拌,待攪拌充分后開始計時.實驗結束后,取出燒杯過濾,然后用70 ℃的去離子水洗滌浸出渣三次,浸出渣烘干后送樣分析渣中鉛和銀的含量.浸出液用流動的冷水冷卻至產生足夠的沉淀后過濾,濾餅烘干備用.
2 NaCl-CaCl2-HCl體系浸出原理
2.1 NaCl-CaCl2-HCl體系浸鉛熱力學分析
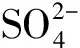
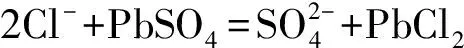
(1)
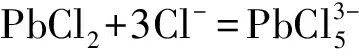
(2)
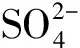
Na2SO4+CaCl2=CaSO4↓+2NaCl
(3)
PbSO4在高濃度Cl-溶液中轉化為PbCl2繼續與Cl-結合形成鉛氯配合物,其反應如下:
(4)
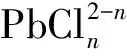
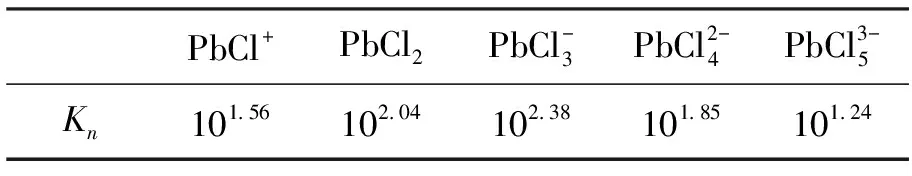
表2 鉛氯配合物的穩定常數Table 2 Stability constant of complexes of lead and chloride ion
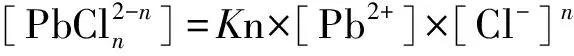
(5)
[Pb]T=[Pb2+]+[PbCl+]+[PbCl2]+
(6)
則Pb2+占溶液中鉛離子總量的百分數可由下式求出:
Pb2+%=1/(1+∑[10Kn×[Cl-]n])×100%
(7)
同理求得鉛的其它形態所占比例,得出Pb(II)形態分布與Cl-濃度的關系,結果如圖1所示.
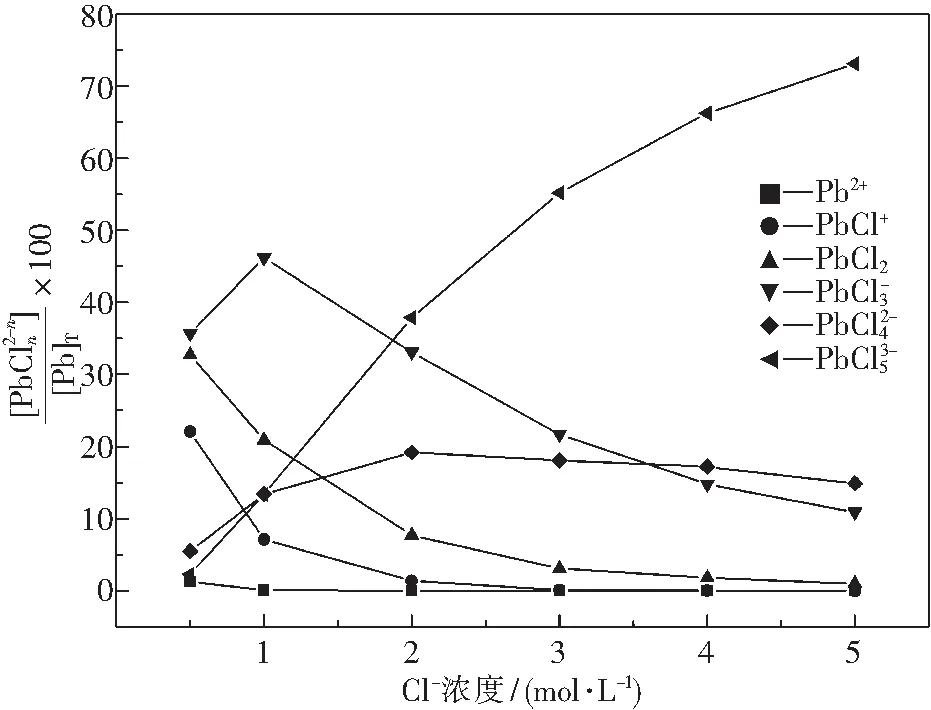
圖1 氯離子濃度對Pb(II)離子形態分布的影響Fig.1 Effect of concentration of chloric ion on species of Pb(II)
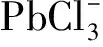
2.2 NaCl-CaCl2-HCl體系浸銀熱力學分析
在銅陽極泥濕法提銀后,分銀渣中的銀主要以AgCl和Ag2SO4形態存在,在高濃度的NaCl-CaCl2-HCl混合溶液中,渣中的AgCl和Ag2SO4與反應,形成可溶性的銀氯配合物而進入溶液,從而達到分離銀的目的.主要反應如下[9]:
Ag++Cl-=AgClK1=103.04
(8)
(9)
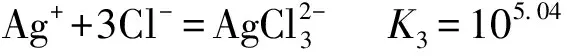
(10)
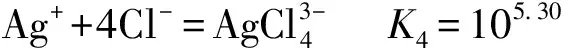
(11)
由以上四個反應可得:
(n=1, 2, 3, 4)
(12)
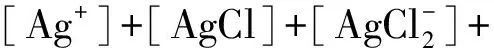

(13)
則Ag+占溶液中銀總量百分數可由下式求出:
Ag+%=1/(1+∑[10Kn×[Cl-]n])×100%
(14)

圖2 氯離子濃度對Ag(I)離子形態分布的影響Fig.2 Effect of concentration of chloric ion on species of Ag(I)
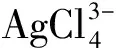
2.3 NaCl-CaCl2-HCl體系浸銻熱力學分析
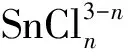
(n=1, 2, 3, 4, 5, 6)
(15)
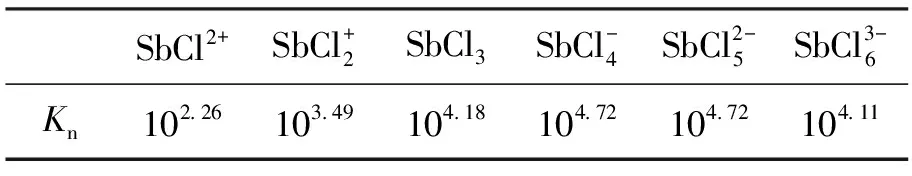
表3 銻氯配合物的穩定常數Table3 Stability constant of antimony and chloride ion complexes
(16)
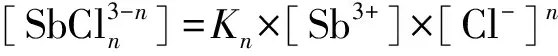
(17)
則Sb3+占溶液中銻總量百分數可由下式求出:
Sb3+%=1/(1+∑[10Kn×[Cl-]n])×100%
(18)
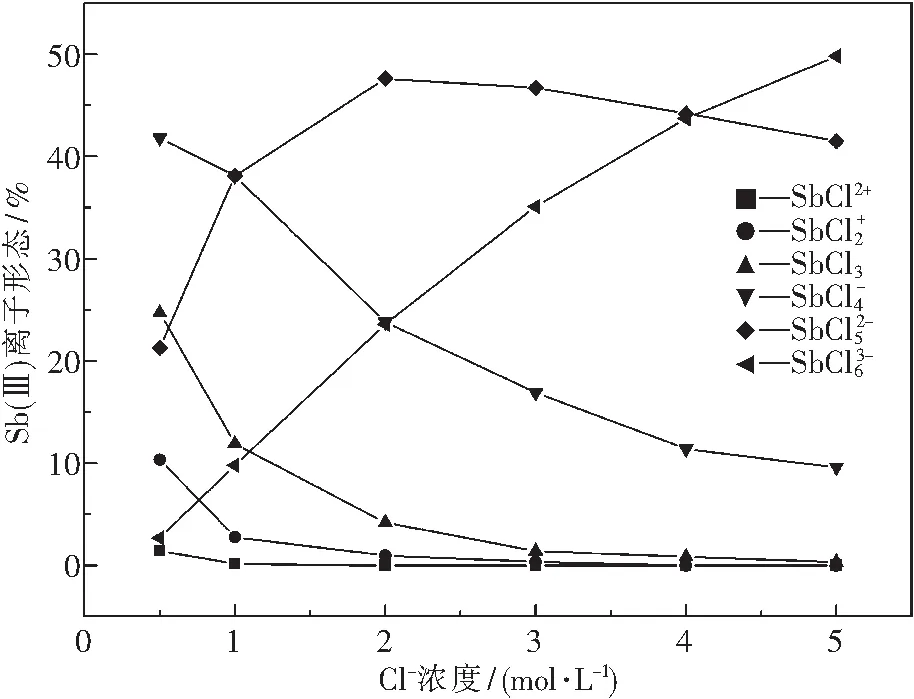
圖3 氯離子濃度對Sb(Ⅲ)離子形態分布的影響Fig.3 Effect of concentration of chloric ion on species of Sb(Ⅲ)
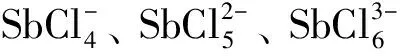
3 結果與討論
3.1 HCl濃度對浸出率的影響
圖4為在NaCl的質量濃度為300 g·L-1,液固質量比L/S=9∶1,溫度85 ℃條件下,不同HCl濃度的浸出液同分銀渣反應1 h后得到的浸出率曲線圖.

圖4 HCl濃度對浸出率的影響Fig.4 Effect of hydrochloric acid concentration on leaching rate
由圖4可知,隨著HCl濃度的增加,Pb、Ag、Sb的浸出率也增大.HCl濃度達到2.0 mol·L-1時,Pb、Ag、Sb的浸出率分別為98.36%、97.11%、83.41%.當HCl濃度為2.5 mol·L-1時,Pb和Sb的浸出率基本保持不變,銀的浸出率僅增大0.39%.
3.2 NaCl的質量濃度對浸出率的影響
在HCl濃度為2.0 mol·L-1,液固質量比L/S=9:1,溫度85 ℃,反應時間1 h,不同NaCl質量濃度對浸出率影響如圖5所示.
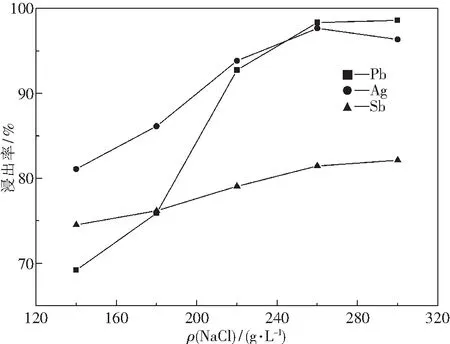
圖5 NaCl質量濃度與鉛、銻浸出率的關系Fig.5 Effect of NaCl concentration on leaching rate
從圖5可以看出,隨著NaCl質量濃度ρ(NaCl)的增大,Pb和Ag浸出率快速增大,但Sb浸出率曲線增速緩慢.當NaCl濃度達300 g·L-1時,Sb浸出率僅為82.14%,可能是Pb2+和Ag+相對于Sb3+具有更強的形成配合物傾向,所以溶液中Pb、Ag對Sb的浸出有一定的抑制作用.
3.3 溫度對浸出率的影響
圖6為在NaCl質量濃度為300 g·L-1,HCl濃度為2.0 mol·L-1,液固質量比L/S=9∶1,不同溫度條件下,分銀渣反應1 h后得到的溫度與浸出率關系圖.
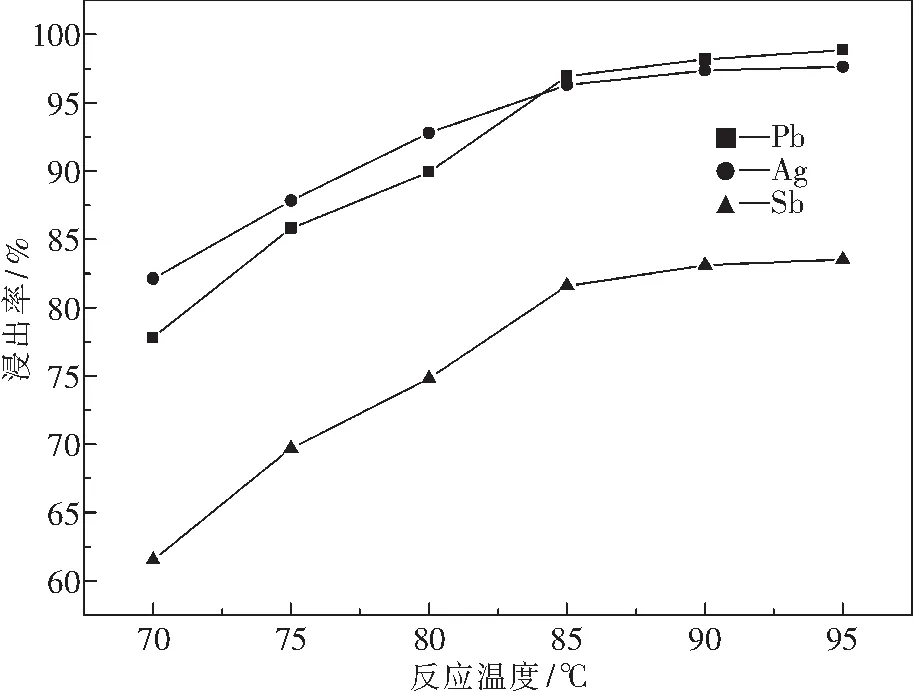
圖6 反應溫度對浸出率的影響Fig.6 Effect of reaction temperature on leaching rate
由圖6可知,隨著溫度的升高,浸出速度加快,三種金屬的浸出率也逐漸增大,尤其對提高Pb和Ag的浸出率有明顯作用.但溫度超過85 ℃后,三種金屬浸出率提高不大,并且溫度過高HCl揮發,使Pb、Ag、Sb水解,造成浸出率下降;同時揮發的HCl與水蒸氣形成酸霧,對環境和設備造成嚴重危害.所以溫度不宜過高,合適的反應溫度為85 ℃.
在HCl-NaCl體系中,Pb、Ag和Sb浸出動力學可以根據Arrhenius公式,研究反應溫度對各金屬浸出的影響.
lnk=lnk0-Ea/RT
(19)
式中:k為反應速率常數;k0為反應頻率因子;Ea為反應活化能.
依據圖6中的實驗數據,通過線性回歸和數學運算分別得到Pb、Ag和Sb的lnk-1/T關系,如圖7所示.
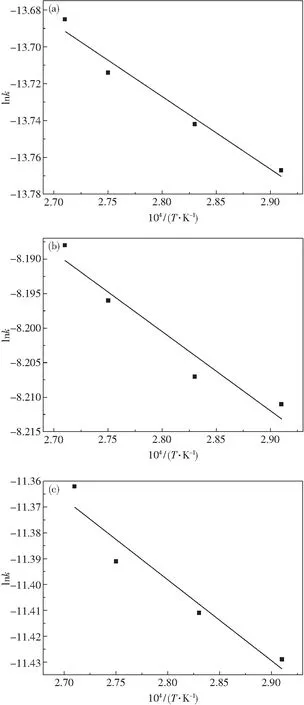
圖7 不同金屬lnk-1/T關系Fig.7 The lnk-1/T of different metals(a)—Pb; (b)—Ag; (c)—Sb
由圖7可得在該體系中Pb、Ag和Sb浸出反應活化能Ea分別為 2.13 kJ·mol-1、 0.58 kJ·mol-1、 1.94 kJ·mol-1.由此可知,反應溫度對Pb的浸出影響最大,Ag對反應溫度的敏感性最低.
3.4 液固質量比對浸出率的影響
在NaCl質量濃度為300 g·L-1,HCl濃度為2.0 mol·L-1,反應溫度為85 ℃,反應時間為1 h,液固質量比對浸出率影響如圖8所示.
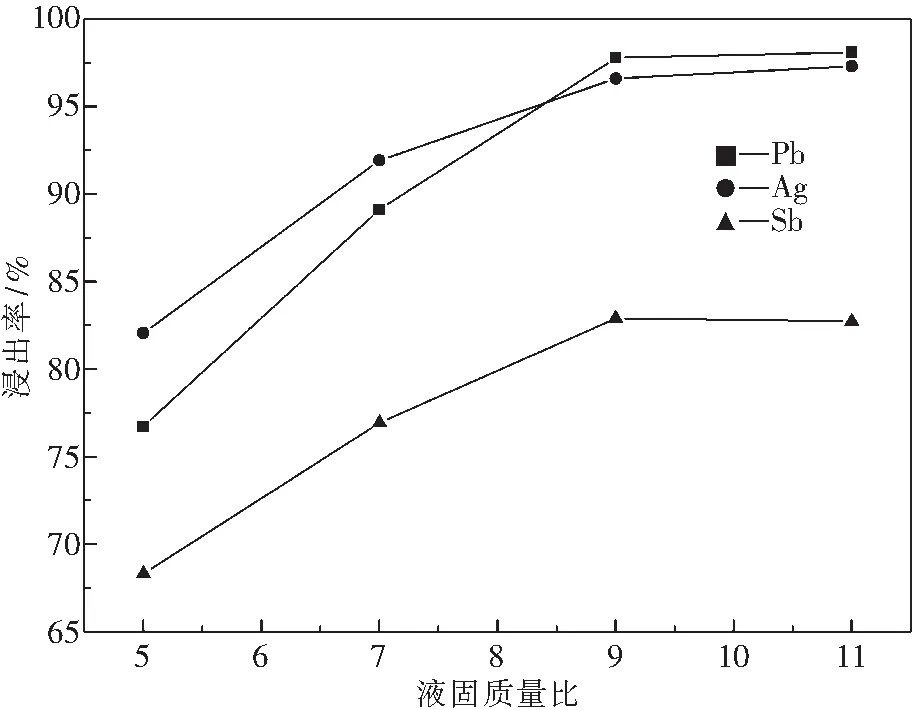
圖8 液固質量比對浸出率的影響Fig.8 Effect of ratio of liquid to solid on leaching rate
由圖8可知,隨著液固質量比增大,Pb、Ag和Sb浸出率均上升,當液固質量比由5∶1上升到9∶1時,三種金屬的浸出率提升明顯;液固質量比再提高到11∶1時,三條曲線均趨向平緩,分銀渣中其他元素也會同溶液中的HCl反應,提高液固質量比使其他元素浸出率增加,但對Pb、Ag、Sb浸出率影響不大.因此,適宜液固比質量為9∶1.
3.5 反應時間對浸出率的影響
圖9為在NaCl質量濃度為300 g·L-1,HCl濃度為2.0 mol·L-1,反應溫度為85 ℃,液固質量比L/S為9∶1條件下,不同反應時間與浸出率關系圖.
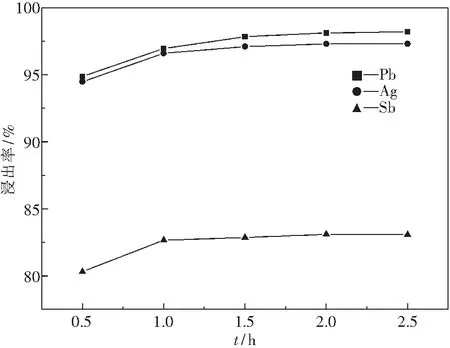
圖9 反應時間對浸出率的影響Fig.9 Effect of reaction time on leaching rate
由圖9可知,反應時間在0.5~1 h時,與Cl-反應后的Pb、Ag、Sb在溶液中充分溶解,使浸出率上升;反應時間從1 h至2.5 h,三條浸出率曲線均平緩上升,浸出率變化不大.繼續延長反應時間,HCl揮發增加,造成原料和能源的浪費,降低生產效率.因此,適宜反應時間為1 h.
在NaCl質量濃度300 g·L-1,HCl濃度為2.0 mol·L-1,反應溫度85 ℃,液固質量比9∶1,浸出時間1 h條件下浸出后得到的富金屬浸出液中的鉛、銀和銻分別以PbCl2、AgCl、SbCl3的形式沉淀下來,經過濾、烘干分別得到含鉛銀銻沉淀物和濾液.沉淀物和濾液中Pb、Ag、Sb成分分析如表4所示.經計算,Pb、Ag、Sb的浸出率分別為98.12%、97.31%和83.1%.

表4 浸出液、沉淀物和濾液中Pb、Ag、Sb含量Table 4 Contents of Pb, Ag, Sb in leachate precipitate and filtrate
4 結 論
在NaCl-CaCl2-HCl體系下,綜合以上各條件參數,得到最優工藝條件:NaCl質量濃度 300 g·L-1,HCl濃度 2.0 mol·L-1,反應溫度 85 ℃,液固質量比9∶1,浸出時間1 h.熱力學理論計算結果與實驗得到的最優條件參數相符合.在最佳實驗工藝條件下,Pb、Ag、Sb的浸出率分別為98.12%、97.31%和83.1%.
[1] 程利振, 李翔翔, 張三佩, 等. 我國銅陽極泥分銀渣綜合回收利用研究進展[J]. 金屬材料與冶金工程, 2011, 4(39):40-43.
(Cheng Lizheng, Li Xiangxiang, Zhang Sanpei,etal. The research progress of the technology for the recovery of valuable metals in silver separating residue[J]. Metal Materials and Metallurgy Engineering, 2011, 4(39): 40-43.)
[2] 陸鳳英, 魏庭賢, 沈雅君, 等. 分銀渣綜合利用新工藝擴大試驗[J]. 云南冶金, 2001, 30(3): 28-29.
(Lu Fengying, Wei Tingxian, Shen Yajun,etal. Enlarged experimentation new technology for complex utilization of silver separating residue[J]. Yunnan Metallurgy, 2001, 30(3): 28-29.)
[3] 孫文達. 分銀渣中貴金屬的回收[J]. 資源再生, 2009, 4: 46-47.
(Sun Dawen. Precious metals recovery in silver separating residue[J]. Resource Recycling, 2009, 4: 46-47.)
[4] 劉勇, 劉珍珍, 劉牡丹. 電路板銅陽極泥分銀渣的還原熔煉[J]. 有色金屬(冶煉部分), 2011, 12: 31-34.
(Liu Yong, Liu Zhenzhen, Liu Mudan. Reduction smelting of silver separating residue from circuit board copper anode slime[J]. Nonferrous Metals (Extractive Metallurgy), 2011, 12: 31-34.)
[5] Shen Yongfeng, Xue Wenying, Niu Wenyong. Recovery of Co(Ⅱ) and Ni(Ⅱ) from hydrochloric acid solution of alloy scrap [J]. Transaction of Nonferrous Metals Society of China, 2008, 5(18): 1262-1268.
[6] 李義兵, 陳白珍, 龔竹青. 分銀渣中貴金屬的提取研究[J]. 有色金屬(冶煉部分), 2002, 6: 32-34.
(Li Yibing, Chen Baizhen, Gong Zhuqing. Extracting study on precious metal in silver separating residue[J]. Nonferrous Metals (Extractive Metallurgy), 2002, 6: 32-34.)
[7] Ho Y S, McKay G. Batch lead (II) removal from aqueous solution by peat: equilibrium and kinetics [J]. Process Safety and Environmental Protection, 1999, 77(3): 165-173.
[8] 孫召明. 銅陽極泥中碲的回收與提純及其基礎理論研究[D]. 長沙: 中南大學, 2012.
(Sun Zhaoming. Study on recovery and purification of tellurium from copper anode slime and relative fundamental theory[D]. Changsha: Central South University, 2012。)
[9] Despic A R, Bockris J O M. Kinetics of the deposition and dissolution of silver [J]. The Journal of Chemical Physics, 2004, 32(2): 389-402.
[10] Amer A M. Processing of copper anode-slimes for extraction of metal values [J]. Physicochemical Problems of Mineral Processing, 2002, 36: 123-134.

