急性失代償性心力衰竭患者血清堿性磷酸酶與腎功能惡化的相關性研究
李文安,劉凱,江帆,仝珊,周曉莉,候曉曉,韓坤元
慢性穩定性心力衰竭突然發生惡化稱為急性失代償性心力衰竭(ADHF),是一種預后極差的系統綜合征[1]。ADHF患者中,心腎功能相互影響,腎功能惡化(WRF)已被確認為不良預后的獨立危險因素[2]。ADHF發生后由于心臟泵衰竭或心源性休克,導致腎臟灌注明顯減少,引起腎功能快速惡化[2],但也有研究指出腎靜脈淤血在腎功能惡化的進程中比腎臟灌注減少發揮更重要的作用[3]。ADHF發生后由于靜脈淤血引起肝功能不全較常見,血清堿性磷酸酶(ALP)是肝功能不全的檢測指標之一[4]。然而ALP與ADHF患者WRF發生是否直接相關的研究較為缺乏,本研究旨在探討兩者間的關系。
1 對象與方法
1.1 研究對象 選取2013年6月—2016年6月于海南省人民醫院心血管內科和老年病科就診的ADHF患者972例為研究對象。納入標準:(1)符合ADHF的診斷標準,診斷標準參照中國心力衰竭診斷和治療指南2014版[1];(2)有入院時的血清ALP數據。排除標準:(1)年齡<18歲;(2)有原發性肝病病史;(3)入院時估算腎小球濾過率(eGFR)<15 ml·min-1·(1.73 m2)-1;(4)正在行血液透析或腹膜透析者。根據有無WRF分為無WRF組840例和WRF組132例。WRF定義為住院期間血肌酐在入院初次檢測的水平上增加超過0.3 mg/dl(26.5 μmol/L)或慢性腎臟病患者的 eGFR<60 ml·min-1·(1.73 m2)-1[1]。本研究經海南省人民醫院倫理委員會審批通過,所有患者均已簽署知情同意書。
1.2 研究方法
1.2.1 一般資料的收集 收集所有患者的性別、年齡、收縮壓、舒張壓、心率、既往史、藥物治療情況等一般資料。
1.2.2 實驗室指標的檢測 所有入選患者入院空腹12 h后于次日清晨采集血樣并送至檢驗科進行檢測。(1)生化指標的檢測:采用德國西門子ADVIA 2400全自動生化分析儀和上海西門子醫學診斷產品有限公司生產的試劑盒檢測相關生化指標。血漿腦鈉肽(BNP)水平采用微粒子捕捉免疫發光技術(MEIA)檢測,BNP參考范圍為0~100 ng/L;血肌酐采用肌氨酸氧化酶法;血紅蛋白采用十二烷基硫酸鈉(SLS)血紅蛋白檢測法;血清清蛋白采用溴甲酚綠法;血鈉采用離子選擇性電極間接法;低密度脂蛋白膽固醇(LDL-C)、高密度脂蛋白膽固醇(HDL-C)、三酰甘油采用酶法;乳酸脫氫酶采用速率法;總膽紅素(T-Bil)采用氧化酶法;ALP采用AMP緩沖液法;谷氨酰轉移酶(GGT)、AST、ALT采用國際臨床化學聯合會(IFCC)法,并計算eGFR。(2)心臟彩超檢查:所有患者取左側臥位姿勢,選用飛利浦A50超聲診斷儀進行檢測,探頭頻率為2.5~6.0 MHz,對患者的胸骨左側進行詳細掃描,同時對患者左心室大小、室壁厚度及心臟內部各腔室的結構進行檢測,統一記錄射血分數(EF)、左心室舒張末期內徑(LVDd)、左心房內徑(LAD)、右房室瓣反流(TR)、右房室瓣反流壓力差(TRPG)、舒張早期左房室瓣血流峰值速度(E)、舒張早期左房室瓣瓣環峰值速度(E')。
1.3 統計學方法 采用SPSS 21.0統計軟件進行統計分析。符合正態分布的計量資料以(x ±s)表示,組間比較采用t檢驗;不符合正態分布的計量資料以中位數(四分位數間距)〔M(QR)〕表示,組間比較采用Wilcoxon秩和檢驗;計數資料以相對數表示,組間比較采用χ2檢驗;有序分組資料的線性趨勢檢驗采用趨勢χ2檢驗;WRF的影響因素采用Logistic回歸進行分析。以P<0.05為差異有統計學意義。
2 結果
2.1 兩組患者一般資料和實驗室檢查結果的比較 兩組患者性別、糖尿病病史、慢性腎臟病病史、呋塞米注射液使用情況、去甲腎上腺素使用情況、血管緊張素轉化酶抑制劑(ACEI)或血管緊張素Ⅱ受體阻滯劑(ARB)類使用情況、口服呋塞米片情況、血肌酐、eGFR、血紅蛋白、血清清蛋白、T-Bill、ALP、ALT的比較,差異有統計學意義(P<0.05);年齡、收縮壓、舒張壓、心率、高血壓病史、高血脂病史、多巴胺使用情況、β-受體阻滯劑使用情況、BNP、血鈉、LDL-C、HDL-C、三酰甘油、糖化血紅蛋白、乳酸脫氫酶、GGT、AST、EF、LVDd、LAD、TR、TRPG、E/E'的比較,差異無統計學意義(P>0.05,見表1)。
2.2 不同ALP水平患者WRF發生率比較 將ALP的水平分為三等份:低ALP水平(ALP<203 U/L)325例,發生WRF 29例(8.9%);中間ALP水平(203 U/L≤ALP≤278 U/L)323例,發生WRF 49例(15.2%);高ALP水平(ALP>278 U/L)324例,發生WRF 54例(16.7%)。ALP水平越高WRF發生率越高,差異有統計學意義(χ2趨勢=8.827,P=0.004)。
2.3 ADHF發生WRF影響因素的Logistic回歸分析以ADHF患者是否出現WRF為因變量(賦值:無WRF=0,WRF=1),以單因素分析有統計學意義的因素為自變量進行Logistic回歸分析(α入=0.05,α出=0.10)。最終留在模型中的自變量為慢性腎臟病、血清清蛋白、糖尿病、ALP。結果顯示,糖尿病、慢性腎臟病、血清清蛋白、ALP為ADHF患者發生WRF的影響因素(P<0.05,見表2)。
3 討論
急性失代償性心力衰竭發生后,腎臟極易受到體循環淤血和低灌注的影響,住院患者中約有10%~30%的會出現腎功能惡化[5]。本研究972例患者中132例出現WRF,發病率為13.6%。最近的一項薈萃分析顯示,腎功能、年齡、高血壓、糖尿病與WRF的發生有關[6]。本研究結果顯示,年齡與ADHF發生WRF無關,血清清蛋白與ADHF發生WRF有關。SUDHARSHAN等[7]研究也顯示,與年齡有關的全身性改變與WRF的進展注:注:ACEI=血管緊張素轉化酶抑制劑,ARB=血管緊張素Ⅱ受體阻滯劑,BNP=腦鈉肽,eGRF=估算腎小球濾過率,LDL-C=低密度脂蛋白膽固醇,HDL-C=高密度脂蛋白膽固醇,T-Bil=總膽紅素,ALP=堿性磷酸酶,GGT=谷氨酰轉移酶, EF=射血分數,LVDd=左心室舒張末期內徑,LAD=左心房內徑,TR=右房室瓣反流,TRPG=右房室瓣反流壓力差,E/E'=舒張早期左房室瓣血流峰值速度與舒張早期左房室瓣瓣環峰值速度比值,WRF=腎功能衰竭;檢驗統計量值中,a為t值,b為u值,其余為χ2值;1 mm Hg=0.133 kPa并沒有明顯相關性。血清清蛋白是影響膠體滲透壓的關鍵因素,血液滲透壓降低會導致有效循環血容量滲漏到組織間隙,從而降低腎灌注,可能導致WRF[8]。
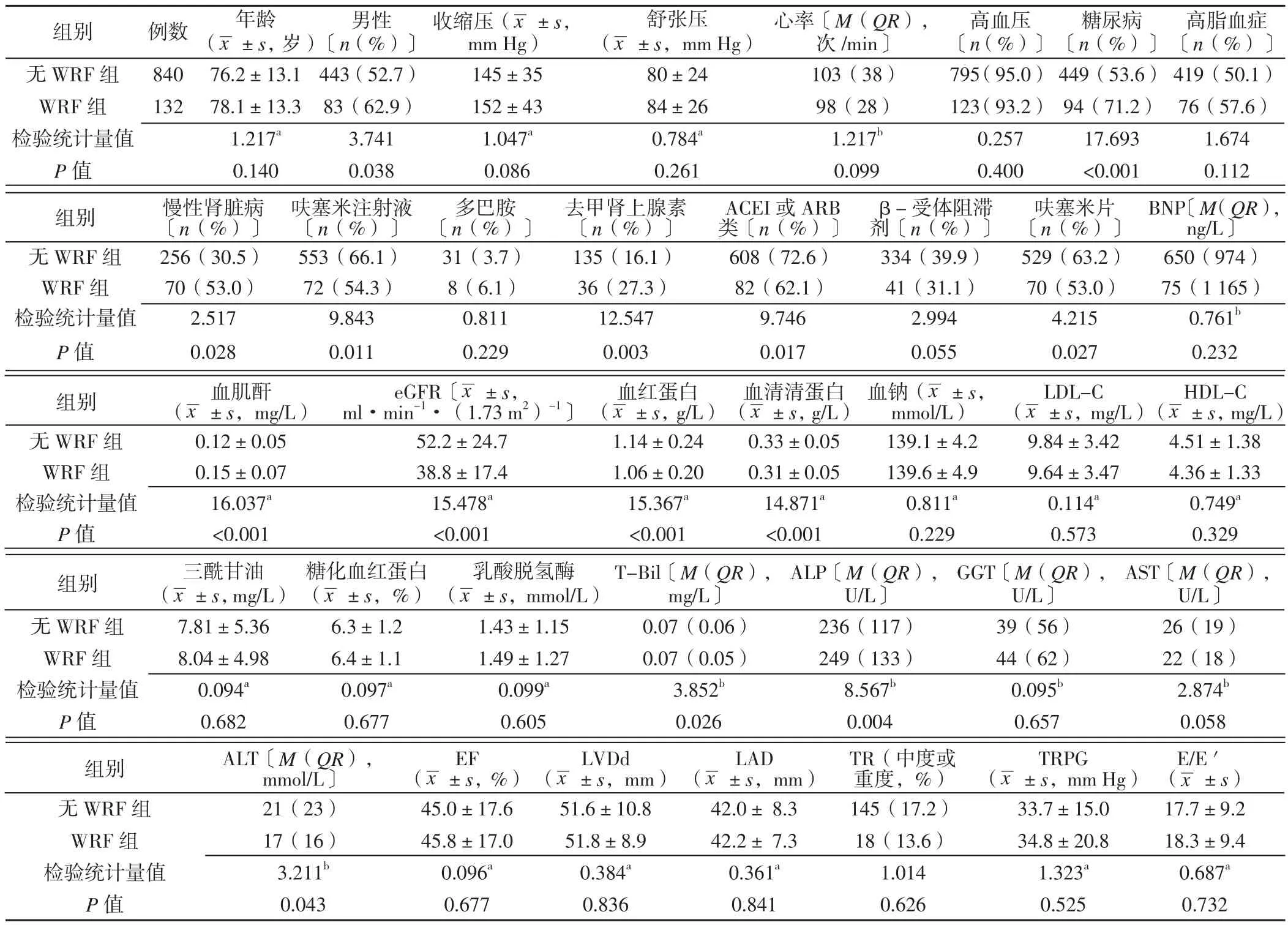
表1 兩組患者一般資料和實驗室檢查結果的比較Table 1 Baseline characteristics of WRF group and non-WRF group
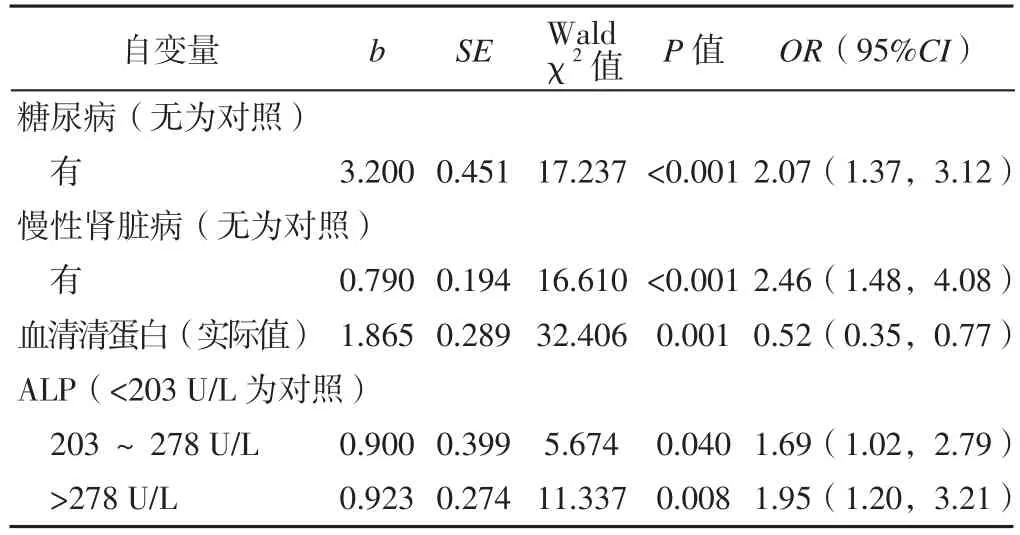
表2 ADHF發生WRF影響因素的Logistic回歸分析Table 2 Multivariate Logistic regression analysis of the associated factors for WRF in ADHF patients
本研究在控制了慢性腎臟病、血清清蛋白、糖尿病后,ALP仍是ADHF發生WRF的影響因素。雖然ALP水平已被認為是在其他條件下腎功能不全的標志物,但關于ALP與ADHF患者發生WRF關系的研究仍比較缺乏。ALP是一個眾所周知的肝膽疾病和骨骼疾病的標志物[9]。兩種生理或病理機制可以解釋ALP水平與ADHF患者發生WRF的關系。第一,ALP可能是肝臟和腎臟淤血的標志物。有研究顯示心力衰竭患者中,血清ALP水平與右心充盈壓相關[10]。TR的嚴重程度和TRPG與ALP水平密切相關。有研究發現ALP水平差異可能反映右心衰竭和右心充盈壓的嚴重程度[11],而右心充盈壓的升高導致腹腔臟器淤血,這是ADHF患者的肝、腎功能障礙的主要病理生理機制[12]。ISHIZUKA等[13]研究發現肝功能檢查中,ALP是反映肝臟充血的標志物,而AST和ALT是缺血性肝炎的標志物。ALP可能是肝和腎淤血的生物標志物之一,ADHF患者中由于肝淤血導致的ALP升高可以預測WRF。有研究顯示靜脈淤血是ADHF患者WRF發展的一個重要因素[3],這與本研究的結果一致。第二,血清ALP水平可以預測亞臨床腎損害。PETERS等[14],在對比劑腎病的研究中,提出血清ALP可能與亞臨床腎損害有關。有研究指出ALP在2型糖尿病腎病的診斷中有潛在的價值,而且與尿血清清蛋白水平密切相關[15]。從生理的角度來看,血清ALP是催化水解有機焦磷酸鹽的胞外酶,并通過此途徑調節血管鈣化[16]。通過ALP的生理功能,認為血管鈣化可能會導致蛋白尿,從而導致亞臨床腎損害。這也許可以從另外一個方面解釋ALP水平與ADHF患者發生WRF獨立相關。
本研究存在一定的局限,為回顧性、單中心研究,出院后腎功能數據缺乏。同時未能直接測量eGFR,沒有檢測腎小管損傷標志物,也沒有收集24 h尿排泄數據。此外,本研究排除了嚴重腎功能不全的患者〔eGFR <15 ml·min-1·(1.73 m2)-1〕,沒有侵入性插管測量肺動脈的血流動力學參數。因此,需要進一步研究ADHF患者中血清ALP與靜脈淤血和右心充盈壓之間的關系。
作者貢獻:李文安負責文章構思與設計,整理數據并負責統計學分析,撰寫論文;劉凱、江帆負責數據收集和整理;仝珊、周曉莉、候曉曉負責結果的分析與解釋;韓坤元負責研究實施與可行性分析、文章英文修訂、質量控制及審校,并對文章負責。
本文無利益沖突。
[1]中華醫學會心血管病學分會,中華心血管病雜志編輯委員會.中國心力衰竭診斷和治療指南2014[J].中華心血管病雜志,2014,42(2):98-116.DOI:10.3760/cma.j.issn.0253-3758.2014.02.004.
Chinese Medical Association Cardivasular Branch,Editorial Board of Chinese Journal of Cardiology.Chinese guidelines for the diagnosis and treatment of heart failure 2014[J].Chinese Journal of Cardiology,2014,42(2):98-116.DOI:10.3760/cma.j.issn.0253-3758.2014.02.004.
[2]ROMANO S,MANSOUR N,KANSAL M,et al.Left ventricular global longitudinal strain predicts heart failure readmission in acutedecompensated heart failure[J].Cardiovasc Ultrasound,2017,15(1):6.DOI:10.1186/s12947-017-0098-3.
[3]GIST K M,KWIATKOWSKI M,COOPER S.Acute kidney injury in congenital heart disease[J].Curr Opin Cardiol,2018,33(1):101-107.DOI:10.1097/HCO.0000000000000473.
[4]MARTINS M J,AZEVEDO I.Let's think in alkaline phosphatase at heart function[J].International Journal of Cardiology,2010,144(2):333-334.DOI:10.1016/j.ijcard.
[5]YANDRAPALLI S,TARIQ S,ARONOW W S.Advances in chemical pharmacotherapy for managing acute decompensated heart failure[J].Expert Opinion on Pharmacotherapy,2017,5(1):1-15.DOI:10.1080/14656566.2017.1299708.
[6]STRENG K W,TERMAATEN J M,CLELAND J G,et al.Associations of body mass index with laboratory and biomarkers in patients with acute heart failure[J].Circulation-Heart Failure,2017,10(1):e003350.DOI:10.1161/CIRCHEARTFAILURE.116.003350.
[7]SUDHARSHAN S,NOVAK E,HOCK K,et al.Use of biomarkers to predict readmission for congestive heart failure[J].The American Journal of Cardiology,2017,119(3):445-451.DOI:10.1016/j.amjcard.2016.10.022.
[8]ALPERT M A.Severe obesity and acute decompensated heart failure:new insights into prevalence and prognosis[J].JACC Heart Fail,2016,4(12):932-934.DOI:10.1016/j.jchf.2016.10.008.
[9]KWOK C S,WONG C W,RUSHTON C A,et al.Ultrafiltration for acute decompensated cardiac failure:a systematic review and metaanalysis[J].International Journal of Cardiology,2017,228(5):122-128.DOI:10.1016/j.ijcard.2016.11.136.
[10]HAYASHI T,HASEGAWA T,KANZAKI H,et al.Subclinical hypothyroidism is an independent predictor of adverse cardiovascular outcomes in patients with acute decompensated heart failure[J].ESC Heart Fail,2016,3(3):168-176.DOI:10.1002/ehf2.12084.
[11]VADER J M,LARUE S J,STEVENS S R,et al.Timing and causes of readmission after acute heart failure hospitalization-insights from theheart failure network trials[J].Journal of Cardiac Failure,2016,22(11):875-883.DOI:10.1016/j.cardfail.2016.04.014.
[12]BOULOGNE M,SADOUNE M,LAUNAY J M,et al.Inflammation versus mechanical stretch biomarkers over time in acutely decompensated heart failure with reduced ejection fraction[J].International Journal of Cardiology,2017,226(2):53-59.DOI:10.1016/j.ijcard.2016.10.038.
[13]ISHIZUKA M,YAMADA S,MAEMURA S,et al.Axillofemoral bypass markedly improved acute decompensated heart failure and kidney injury in a patient with severely calcified stenosis of thoracoabdominal aorta(atypical aortic coarctation)[J].International Heart Journal,2017,58(5):820-823.DOI:10.1536/ihj.16-463.
[14]PETERS E,ERGIN B,KANDIL A,et al.Effect of a human recombinant alkaline phosphatase on renal hemodynamics,oxygenation and inflammation in two models of acute kidney injury[J].Toxicology and Applied Pharmacology,2016,313(15):88-96.DOI:10.1016/j.taap.2016.10.015.
[15]MALO M S.A high level of intestinal alkaline phosphatase is protective against type 2 diabetes mellitus irrespective of obesity[J].Ebio Medicine,2015,2(12):2016-2023.DOI:10.1016/j.ebiom.2015.11.027.
[16]HYOJU S K,MORRISON S,GUL S.Intestinal alkaline phosphatase decreases intraperitoneal adhesion formation[J].Journal of Surgical Research,2017,208(14):84-92.DOI:10.1016/j.jss.2016.09.006.

