PEG模擬干旱脅迫處理對青稞幼苗生長和生理特性的影響
王玉林,徐齊君,原紅軍,曾興權,尼瑪扎西*
(1.西藏自治區農牧科學院農業研究所,西藏拉薩850002;2.省部共建青稞和牦牛種質資源與遺傳改良國家重點實驗室,西藏拉薩850002)
干旱是造成干旱地區和半干旱地區農業生產減產的主要因素之一,對植物的生長發育、代謝以及植株的生長分布和存活均有重要影響[1]。全球每年因為干旱而造成糧食減產的損失是不可估量的。在農業生產中,除了發展節水灌溉和提高耕作技術外,選擇或者培育具有抗旱性能強的農作物,是克服水資源稀缺而干旱減產的有效措施之一。目前,在作物抗旱性的研究上,對小麥、玉米、棉花和水稻等作物研究甚多,而關于青稞的研究則相對較少[2-3]。因此,篩選培育優良的抗旱青稞是擴大青稞種植面積,增加藏區經濟收入和糧食產量的有效措施之一。
青稞(Hordeum vulgareL.var.nudumHook.f),屬于禾本科大麥屬大麥的一個變種,其籽粒成熟時外稃與穎果分離,籽粒裸露,故又稱為裸大麥[4]。青稞通常生長在海拔4 200~4 500 m的高寒地區,主要分布在我國西藏、青海、甘肅以及云南等地,具有極強的高原環境耐受性[5]。青稞作為藏族人民主要的糧食作物,不僅營養豐富,而且具有深厚的文化底蘊,也是西藏四寶之首糌粑的主要原料[6-7]。青稞的生長環境獨特,如高原缺氧、低溫、高日照、降水少等,在種子萌發和生長初期極易受到干旱等因素的影響,導致作物產量的降低。此外,有研究表明,種子萌發階段的抗旱性可以間接反映該植株的抗旱程度,也可以采用種子萌發和幼苗生長初期的生長情況來評價植物某生育時期的抗逆性[8-9]。在環境脅迫過程中,種子在吸水膨脹、發芽生根及長成植株的過程中,幼苗的根系以及株高在一定程度上也可以反映該植株對干旱的敏感性[10-11],如Bouslama等(1983年)曾提出用種子的發芽勢、發芽率以及萌發指數作為滲透脅迫下的種子萌發指標[12]。
本試驗以819份青稞種質資源品種為試驗對象,采用PEG模擬干旱脅迫環境,系統地觀察和分析青稞對干旱的耐受性。在PEG 6000模擬干旱試驗條件下,對青稞的株高變化量和地上生物量的鮮質量及干質量等形態指標進行測定和分析,以篩選出耐旱和敏感型的青稞品種,并對青稞在抗旱基礎研究和遺傳改良起到促進作用。
1 材料與方法
1.1 供試材料
參試的819份青稞品種均來自西藏自治區農牧科學院農業研究所收集的青稞資源。
1.2 試驗方法
種子預處理:選擇大小一致、籽粒飽滿的青稞種子,用0.15%高錳酸鉀處理種子15 min,然后用蒸餾水漂洗干凈,將洗凈的種子均勻平鋪在培養皿中,培養皿底部用濾紙鋪墊保持水分,并設置對照組(H2O)和試驗組(添加質量分數20%的PEG 6000溶液),在25℃的環境下培養24 h。
種子萌發:將預處理的種子取出,將每個處理的種子均勻鋪灑在直徑10 cm、鋪有3層潤濕的濾紙上,置于光照培養箱中培養 [25℃,2 000 μmol/(m2·s),光 14 h/暗 10 h],每天給試驗組和對照組培養皿分別添加質量分數為20%的PEG 6000溶液和H2O,并保持濾紙濕潤。從種子置床之日起,每天觀察種子出芽生根情況,以胚根、胚芽與種粒等長度作為標準,統計發芽生根標準。
以相對發芽率作為抗旱性評價標準,見表1。
幼苗培養方法:正式試驗過程中,根據上述種子處理的方式,對材料進行催芽處理,選擇發芽較為一致的種子播種到育苗盤(V細草炭∶V蛭石=1∶1)中,待大部分植株具有2~3片葉時(消耗自身胚乳的營養),將植株根部洗干凈后,移植到質量分數為20%的PEG 6000的霍格蘭培養液中進行干旱脅迫處理,處理48 h后統一收取植株葉片材料并進行生理指標測定。

表1 抗旱性評價標準
1.3 測定項目
1.3.1 植株高度。處理前和處理后,用卷尺分別測量株高(主莖的垂直高度)。
1.3.2 地上生物量的測定(鮮質量和干質量)。處理后,將地上生物量分別取樣,先在120℃下殺青20 min,然后在80℃下烘干至恒質量[13]。
1.3.3 生理特性。選取在干旱脅迫過程中篩選的耐干旱材料和干旱敏感型材料各15份,分別隨機取各處理組青稞葉片,3次重復,測定丙二醛(MDA)、過氧化氫酶(CAT)、過氧化物酶(POD)活性等生理指標。MDA、POD、CAT活性均采用試劑盒(購自南京建成生物工程研究所)并按相關說明進行測定。
1.4 數據處理
所有數據采用Microsoft Excel 2010軟件進行處理分析。
2 結果與分析
2.1 不同濃度梯度PEG模擬干旱脅迫對青稞種子發芽率的影響
大量研究表明,隨著PEG質量分數的增加,種子的萌發率、活力指數等指標呈現逐漸下降的趨勢,且與植物種子對干旱敏感性有一定的相關性[14-15]。根據相關文獻報道及實際種植經驗,選取具有抗旱性的材料喜拉10號、藏青320及對干旱敏感的材料WDM03681和WDM02185,共4個青稞品種,在質量分數分別為 0、5%、10%、15%、20%、25%、30%的PEG 6000濃度梯度下,模擬干旱脅迫環境對預選材料種子發芽率的影響,結果見表2。結果表明,當PEG濃度達到20%時,對干旱具有抗性的材料種子的發芽率開始顯著降低,而敏感型材料的發芽率則降低80%以上;當PEG濃度達到25%時,抗性材料的發芽率影響也達到50%以上;而當濃度達到30%時,應試材料幾乎都不會發芽。根據本結果,選取質量分數為20%的PEG溶液進行后續青稞種質資源抗旱性的篩選。

表2 不同質量分數PEG 6000處理的青稞種子發芽率 %
2.2 青稞種質材料的抗旱性篩選
2.2.1 干旱脅迫對青稞生長生物量的影響。對819份材料的發芽生根情況,按表1的標準進行評估,并初步篩選得到180份耐干旱材料和44份干旱敏感型材料。
從篩選得到的224份青稞材料中,選擇其中具有代表性的41份材料作具體分析,見表3。其中,喜拉 16、ZDM4372、ZDM4412、WDM01467、ZDM4568、ZDM4572、ZDM4267、ZDM4530 的試驗組和對照組在地上、地下部鮮干質量以及生長量上的差值均為正值,表明這些品種在干旱脅迫處理過程中,其苗期的植株生長勢穩定增加,間接說明這些品種對干旱具有較強的耐受性。相反,WDM04621、ZDM4509、ZDM4493、ZDM4536、加拿大 369、ZDM4576、WDM 00787、ZDM4595、藏 0976、ZDM4583、2010 區 04、ZDM4440、ZDM4504、WDM04080、ZDM4401、迪慶黑元桂、藏 1312、ZDM4381、ZDM4397、ZDM4409、ZDM4445的試驗組和對照組在地上、地下部鮮干質量以及生長量上的差值均為負值,表明這些品種在干旱脅迫過程中,植株的生長受到了一定程度的抑制,表現為負增長,間接說明這些品種對干旱脅迫較敏感。2.2.2 干旱脅迫對青稞MDA、POD和CAT等生物酶酶活性的影響。結果表明(圖1),抗旱材料的MDA含量,在試驗組和對照組中的差異并不是很顯著,但是在旱敏感材料中,試驗組的MDA含量明顯要高于對照組,說明MDA在敏感材料的細胞內有大量積累。相比MDA變化情況,POD在試驗組材料的細胞內含量始終要高于對照組,而CAT的含量在抗旱材料和敏感材料中呈現截然相反的趨勢,在抗旱材料中相對對照組材料具有較高的積累,而在敏感材料中CAT含量有大幅下降。
綜上所述,本研究通過PEG模擬干旱脅迫環境的方式,根據PEG脅迫下植株生長和部分生理指標的測定結果,篩選得到對干旱具有不同響應的青稞材料。其中具有強抗旱性的材料有喜拉16、ZDM4372、ZDM4581、ZDM4312、ZDM4412、ZDM4521、ZDM4516、喜拉3號、ZDM4456、WDM01467、ZDM4568、ZDM4572、ZDM4267、ZDM4530、藏 0559;對干旱敏感的材料有ZDM4279、ZDM4505、WDM04080、ZDM4401、迪慶黑元桂、藏 1312、ZDM4367、ZDM4381、ZDM4397、ZDM4409、ZDM4445、北青 1 號、WDM00787、藏 0976、2010區04。
3 結論與討論
氣候的變化直接影響到人類生存和經濟社會的發展,尤其是對農業生產有著重要影響。在近10年,西藏的主要農產區生產力變化不顯著,其中半干旱和干旱地區的農作物生產力變化不明顯,但是在半濕潤地區的青稞、小麥等農作物的產量逐年下降[16]。本研究基于此背景下,著力于青稞在抗旱機制中的基礎研究,為培育耐旱品種作鋪墊性工作。
生物都具有趨利避害的共性,而植物相對其他生物來說需要承受更多的外界影響。植物在面對外界逆境環境,如病蟲害、干旱、低溫等環境影響時,自身會產生一定的免疫力來抵御外界的影響。不同植物在響應外界環境的同時,其自身的遺傳差異也會在其生長過程中得到體現[17]。在一定的干旱脅迫影響范圍內,植物體內與抗旱相關基因的表達,導致植株在生理和形態結構上發生顯著變化。大量研究表明,植物的地上部生長量、地下部生長量、地上部的鮮干質量、地下部的鮮干質量是衡量植物生產性能和抗性的重要生長指標[18]。本試驗篩選得到的
耐旱材料(15份)和旱敏感材料(15份)在抗旱脅迫處理過程中,在生物形態上表現出顯著的差異,具有耐旱性的材料的生長量要顯著高于旱敏感材料,如耐旱材料喜拉16號的所有指標均表現為正值,而旱敏感材料如迪慶黑元桂則均表現為負值。

表3 PEG模擬干旱脅迫對植物生長量指標的影響

續表3
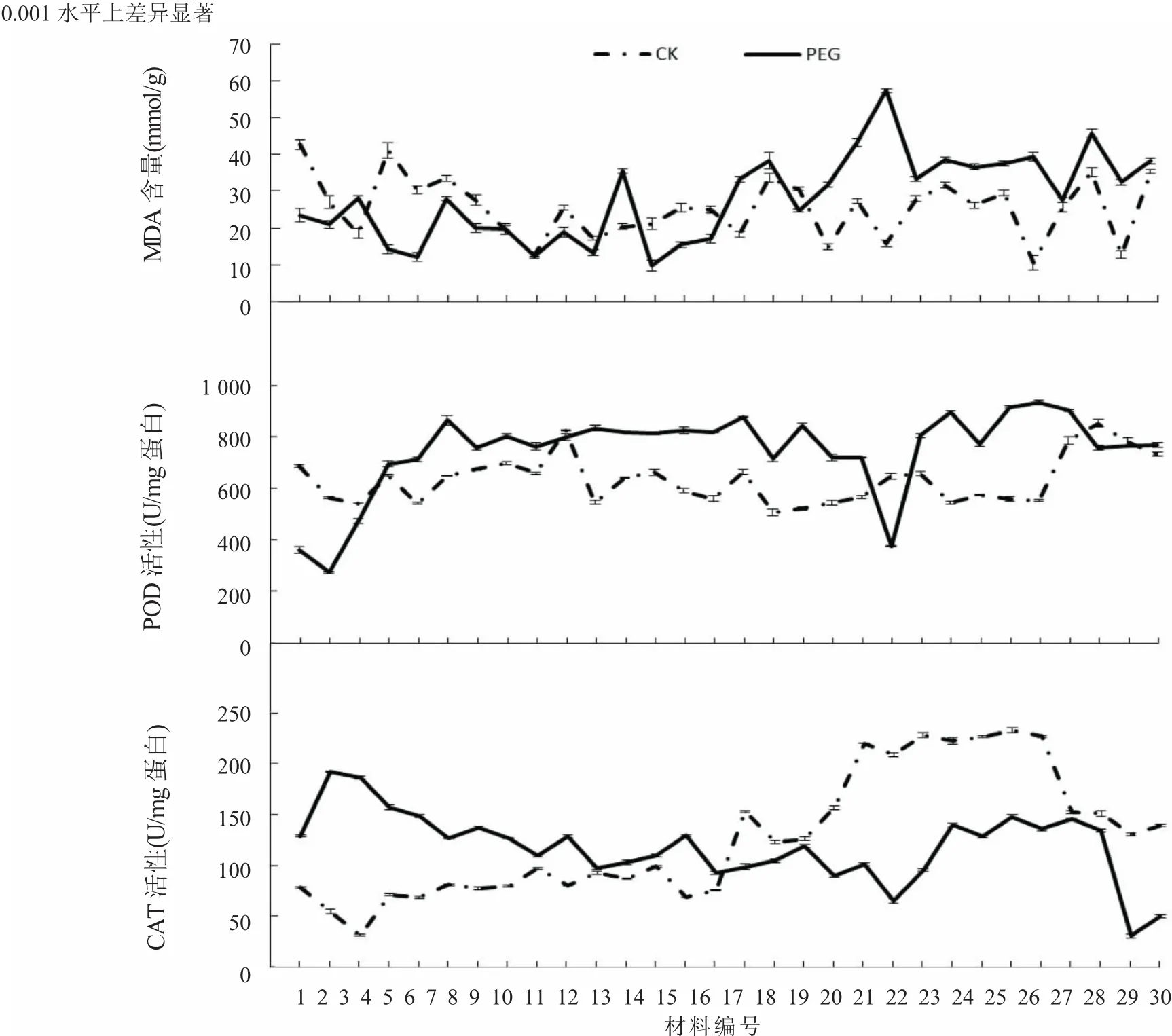
圖1 干旱脅迫處理下的青稞葉片MDA含量與POD、CAT酶活性
植物的生長發育是由遺傳物質和環境因素共同決定的,基因的表達、營養物質的供應、植物激素的合成等因素共同調節細胞的生長和代謝[19-20]。當植物受到逆境環境的脅迫影響時,植物為保證其代謝機能的正常運作,會對自身產生的活性氧(ROS)傷害具有適應和調節作用,其主要特征是降低和破壞抗氧化酶活性或抗氧化物含量,使活性氧代謝失衡。在正常情況下,植物體內的ROS的生成和清除處于一個動態平衡的狀態,且維持在一個很低的濃度水平上,但是對植物施以逆境脅迫處理,其體內的這種活性氧平衡會被打亂,植物抗氧化系統清除ROS的能力下降,造成植物細胞內大量積累ROS,從而對植物造成傷害[21-22]。這種傷害一方面促使活性氧的產生,另一方面也破壞了機體內以SOD為主的抗氧化系統,導致ROS的進一步積累。植物針對這種現象,會應激地產生有效的抗氧化酶和抗氧化物質[23]。植物在逆境條件下,細胞膜的主要組成成分不飽和脂肪酸發生氧化反應,其中主要的產物丙二醛(MDA)的生成和積累會對生物的細胞膜造成嚴重傷害,MDA含量的高低可以反映出植物受到逆境傷害的程度[24]。同時,植物細胞內的保護酶SOD和CAT等,也在植物的抗逆過程中發揮重要的作用[25]。因此,植物在逆境環境下清除ROS能力的強弱,可以通過檢測植物體內抗氧化酶的含量和活性來間接評價植物對逆境環境的耐受性。本試驗結果表明,干旱敏感型材料的MDA含量顯著要高于對照組;相對于對照組而言,與植物抗氧化系統直接相關的POD和CAT含量在植物抗性材料和敏感材料中表現出明顯的差異。這些現象也與前人在干旱脅迫研究中相應生物酶活性變化趨勢結果一致;同時對比測定的形態指標數據,也進一步證實我們篩選得到的對旱脅迫響應表型具有顯著差異材料的準確性,如其中抗旱性較好的喜拉16、ZDM4312、ZDM4412、ZDM4572以及旱敏感材料迪慶黑元桂、藏 1312、ZDM4445、藏 0976 等。
在前人的研究中,干旱導致的膜脂過氧化是造成植物細胞膜受損害的關鍵因素,從而導致植物組織受損,植株衰老[22]。為了抵御活性氧分子對細胞的傷害,植物在長期進化過程中形成了一套精密的抗氧化酶保護系統,如SOD、CAT、POD等,以維持植物體內活性氧代謝的平衡。研究表明,當植物受到逆境環境的脅迫影響后,植物體內的POD活性和含量會升高,從而對植株起到保護生物膜的作用[26-27]。同樣,CAT也是植物體內重要的抗氧化保護酶,在植物失水脅迫下,會誘導植物產生CAT,加速體內H2O2的分解,進而避免因體內活性氧自由基的積累而對植株造成傷害。MDA是細胞膜脂過氧化作用的主要產物之一,在植物受到脅迫后,產生的氧化自由基會加劇植物細胞膜的過氧化,并產生MDA。已有大量研究表明,干旱誘導的膜脂過氧化是造成植物細胞膜受到損傷的關鍵因素[22,28]。MDA的含量會隨著干旱脅迫時間的增加,在植物體內也會逐漸增大。在抗旱過程中,植物體內的MDA含量越高,表明該物種的抗旱性越弱[29]。對比幾種生物酶在植物受PEG干旱脅迫處理和空白對照組植株體內的含量情況,本試驗測定結果與前人所研究的結果具有一致性;同時,這些植株在形態表現上的差異性也具有一定的相關性。
干旱對農作物的生產造成的影響僅次于病蟲害。隨著全球淡水資源的日漸匱乏,我們所面臨的干旱造成的影響也越來越嚴重。因此,深入了解干旱脅迫對植物造成傷害的機理,以及植物在面臨干旱脅迫環境下的應答機制,將有助于我們對耐干旱作物的選育和研究。隨著下一代測序技術的發展,植物在抗旱生理層面上的研究有望取得較大成果[30]。許多與抗旱相關的基因以及調控因子的發現并被克隆分離,也將有助于人們對植物抗旱機理的認識。基于本次試驗篩選得到的材料,可為后續青稞在干旱分子調控機制方面的研究提供良好基礎。
[1]MOORE P D.The ecology of plants[M].2nd ed.Sunderland,MA:Sinauer Associates Inc,2006.
[2]FAROOQ M,KOBAYASHI N,ITO O,et al.Broader leaves result in better performance of indica rice under drought stress[J].Journal ofPlant Physiology,2010,167(13):1066-1075.
[3]趙 慧,張 瑋,王 靜,等.外源基因導入改良小麥抗旱性的研究進展[J].中國生態農業學報,2013,21(3):267-273.
[4]郭本兆.青海經濟植物志[M].西寧:青海人民出版社,1987.
[5]ZENGX,LONGH,WANGZ,etal.ThedraftgenomeofTibetan hulless barley reveals adaptive patterns to the high stressful Tibetan Plateau[J].Proceedingofthe National AcademyofScience ofthe United States ofAmerica,2015,112(4):1095-1100.
[6]ZANG J W,KAN J Q,CHEN ZD,et al.Applications ofbarley and study on its components[J].China Food Additives,2004,4:43-46.
[7]FU D,RUAN R,DAI X,et al.A study on ancient barley,wheat and millet discovered at Changguo of Tibet[J].Acta Agronomica Sinica,2000,26(4):392-398.
[8]SACK L,GRUBB P J,MARANON T.The functional morphology of juvenile plants tolerant of strong summer drought in shaded forest under stories in southern Spain[J].Plant Ecology,2003,168(1):139-163.
[9]宋麗華,劉雯雯,陳淑芬.PEG處理對臭椿種子萌發的影響[J].農業科學研究,2005,26(4):25-29.
[10]馬 闖,張文輝,劉新成.等滲的鹽分和水分脅迫對杠柳種子萌發的影響[J].植物研究,2008,28(4):465-470.
[11]張 霞,謝小玉.PEG脅迫下甘藍型油菜種子萌發期抗旱鑒定指標的研究[J].西北農業學報,2012,21(2):72-77.
[12]BOUSLAMA M,SCHAPAUGH W T.Stress tolerance in soybeans.I.Evaluation of three screening techniques for heat and drought tolerance[J].Crop Science,1984,24(5):933-937.
[13]張蕓香,韓有志,郭晉平,等.華北落葉松二年生苗年生長格局對光照變化的響應[J].山西農業大學學報(自然科學版),2007,27(2):113-115.
[14]鄭淮兵,董 麗,鄭彩霞.低溫和PEG“滲控”預處理促進石楠種子萌發的研究[J].林業科學,2005,41(3):54-57.
[15]AZARNIVAND H,SOURI M,ETEMAD V.Effect of water stress on seed germination ofArtemisia spicigera&Artemisia fragrans[J].Desert,2007,12:17-21.
[16]尼瑪扎西,楊 勇,禹代林,等.全球氣候變化與西藏農牧業發展[J].西藏科技,2010(3):22-27.
[17]楊京平,姜 寧,陳 杰.水稻吸氮量和干物質積累的模擬試驗研究[J].植物營養與肥料學報,2002,8(3):318-324.
[18]武自念.苜蓿在我國江淮地區的生長特性及適應性研究[D].蘭州:甘肅農業大學,2010.
[19]YU L P,HAO Z,LI F D,et al.Effect of isoflavone in red clover on the growth and immune functions,and in the antioxidant indices in ovariectomized rats[J].Acta Pratacultuae Sinica,2015,21(6):137-144.
[20]齊 健,宋鳳斌,劉勝群.苗期玉米根葉對干旱脅迫的生理響應[J].生態環境,2006,15(6):1264-1268.
[21]MEHDY MC.Active oxygen species in plant defense against pathogens[J].Plant Physiology,1994,105(2):467-472.
[22]PAUK K P,THOMPSON J E.In vitro simulation of senescence-related membrane damage byozone-induced lipid peroxidation[J].Nature,1980,283:504-506.
[23]聶石輝.大麥抗旱的生理生化機理研究及種質資源抗旱性評價[D].石河子:石河子大學,2011.
[24]曹 晶,姜衛兵,翁忙玲,等.夏秋季旱澇脅迫對紅葉石楠光合和特性的影響[J].園藝學報,2007,34(1):163-172.
[25]張 怡,羅曉芳,沈應柏.土壤逐漸干旱過程中刺槐新品種苗木抗氧化系統的動態變化[J].浙江林學院學報,2005,22(2):166-169.
[26]許桂芳,吳鐵明,向佐湘.干旱脅迫對兩種過路黃抗性生理生化指標的影響[J].作物研究,2006(2):138-140.
[27]趙雅靜,翁伯琦,王義祥,等.植物對干旱脅迫的生理生態響應及其研究進展[J].福建稻麥科技,2009,27(2):45-50.
[28]CUTLER J M.Influence of water deficits and osmotic adjustment on leafelongation in rice[J].Crop Science,1980,20:314-318.
[29]FU J,HUANG B.Involvement of antioxidants and lipid peroxidation in the adaptation of two cool-season grasses to localized drought stress[J].Environment&Experiment Botany,2001,45(2):105-114.
[30]SHEN Y J,JIA W L,ZHANG Y Q,et a1.Improvement of droughttolerance in transgenic tobacco plants by a dehydrin-like gene transfer [J].JournalofIntegrative Agriculture,2004,3(8):575-583.

