腦血管病伴糖尿病患者介入治療后對比劑對腎功能的影響
呂在剛, 王琳娜, 陳曉輝, 張立功, 鐘孟飛, 李海停, 楊志杰, 李 敏,唐天萍, 高宗恩
神經介入術在大血管閉塞性腦卒中急性期動脈溶栓、動脈取栓挽救缺血半暗帶及動脈瘤栓塞治療中發揮出不可替代的作用。但接受神經介入術患者多為老年人,常伴發糖尿病、腎功能不全等慢性病,若患者選擇不當,對比劑應用后可能引發對比劑腎病(CIN)。有研究表明醫源性急性腎損害中血管內介入治療引發CIN,已成為急性腎衰竭第3大原因[1]。研究證實,腎功能不全及糖尿病腎病為CIN重要危險因素[2],但單純2型糖尿病是否為CIN高危因素,目前仍有爭議。本研究通過對比神經介入術前及術后24 h血清肌酐(sCr)、血清胱抑素(Cys)C、腎小球濾過率估計值(eGFR)指標差異,觀察對比劑對腦血管病伴2型糖尿病患者術后腎功能的影響,探討2型糖尿病患者神經介入術安全性。
1 材料與方法
1.1 研究對象
連續納入2013年3月至2016年3月在勝利油田中心醫院因可疑腦血管重度狹窄、腦動脈瘤、主動脈夾層等接受全腦DSA造影或介入治療的腦血管病伴2型糖尿病患者共108例。其中男58例,女 50 例;年齡 48~78 歲,平均(65.4±8.4)歲。 納入標準:年齡18~80歲,介入術中對比劑用量<250 mL,既往有2型糖尿病病史(口服二甲雙胍患者術前48 h停用,術后48 h再繼續服用),術前sCr<123 μmol/L。排除標準:術前 sCr>123 μmol/L,近期接受過可能造成急性腎功能損傷藥物(鏈霉素等),既往有腎功能不全病史。
1.2 研究方法
介入術前及術后24 h,采用堿性苦味酸法試劑盒(湖南永和陽光生物科技公司)檢測sCr,參考值:0.6~1.5 mg/dL(1 mg/dL=88.4 μmol/L);免疫比濁法試劑盒(寧波瑞源生物科技有公司)檢測血清Cys C,參考值:0~1.16 mg/L。
CIN診斷標準:以sCr為參考,術后72 h內sCr較基線值升高 25%,或≥0.5 mg/dL[3];以 Cys C 為參考,術后72 h內血清Cys C較基線值升高10%[4]。
根據腎臟疾病膳食改良(MDRD)公式[175×sCr(mg/dl)-1.154×年齡(歲)-0.203×(0.742 女性)]及Larsson 公式[77.24×Cys C(mg/L)-1.2623]分別計算eGFR。依據2002年歐洲腎臟病協會慢性腎臟病分級標準、所測eGFR將患者腎功能分為1~5級,比較患者術前及術后腎功能分級分布。
神經介入操作過程中,所有患者均接受非離子型對比劑碘佛醇(碘含量320 mg/mL,國藥準字H20067896,江蘇恒瑞醫藥公司),水化處理為預防CIN基本措施[5],術前及術后6 h內均靜脈滴注0.9%NaCl溶液(1 mL·kg-1·h-1)[6]。
1.3 統計學分析
采用SPSS 17.0軟件對收集整理后數據進行統計學分析。計量資料比較用t檢驗,以均數±標準差(±s)表示;計數資料比較用 χ2檢驗,以頻數及百分率表示;資料不滿足正態分布,則用秩和檢驗。P<0.05為差異有統計學意義。
2 結果
2.1 sCr、血清 CysC、eGFR 變化
與術前相比,神經介入術后24 h sCr、血清Cys C水平均增高,差異均有統計學意義(P<0.000 1,P=0.015);根據sCr、血清Cys C計算的eGFR降低,差異均有統計學意義(MDRD公式 P<0.000 1,Larsson 公式 P=0.021)(表 1)。
2.2 術后CIN發生率
依據CIN診斷標準及術后sCr、血清Cys C變化,分別有6例、20例患者提示為CIN,發生率分別為 5.6%(6/108)、18.5%(20/108)。然而,所有患者均未出現需要治療的腎損害,如蛋白尿、水腫表現等。
表1 108例患者神經介入術前后腎功能變化 ±s

表1 108例患者神經介入術前后腎功能變化 ±s
?
2.3 基于eGFR的腎功能分級分布
依據2002年歐洲腎臟病協會慢性腎臟病分級標準、所測eGFR,手術前后患者腎功能分級分布見表2。其中MDRD公式計算顯示術后患者腎功能2~5級分布百分比較術前增高,差異有統計學意義(P=0.019)。
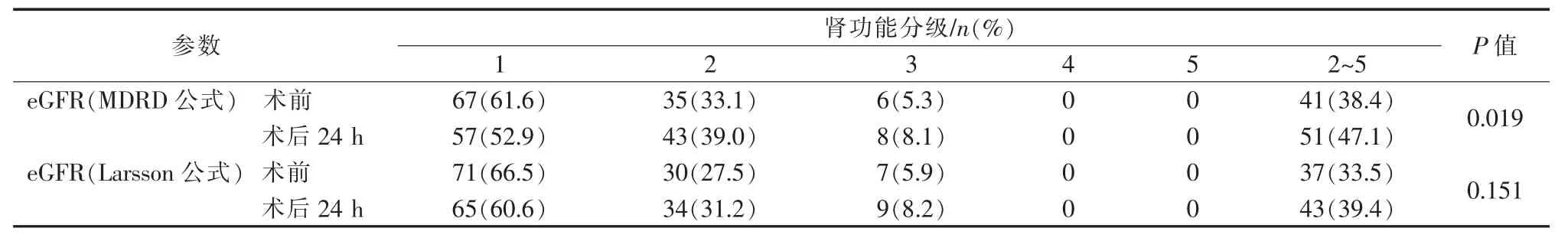
表2 108例患者神經介入術前后腎功能分級分布
3 討論
隨著神經介入手術開展,對比劑引起CIN愈發受到重視。與患者無糖尿病相比,2型糖尿病是否為CIN獨立危險因素目前仍存爭議。臨床上有必要了解對比劑對2型糖尿病患者腎功能的影響,以預防術后CIN發生。接受神經介入術治療的腦血管病患者伴發2型糖尿病較為常見。有研究提示糖尿病是 CIN危險因素,糖尿病腎病患者風險更高[7]。Manske等[8]研究發現糖尿病患者冠狀動脈介入術后sCr較術前平均升高5.9 mg/dL,發展為CIN風險較高,嚴重患者甚至需透析治療。Khamaisi等[9]研究認為,相同基礎腎功能情況下,對比劑應用后糖尿病患者較非糖尿病患者出現急性腎損害風險加倍。但也有一些學者認為,單純糖尿病并非為CIN危險因素。Morabito等[10]在一項冠狀動脈介入術前瞻性研究中發現,術后隨訪數月,保留完整腎功能的糖尿病患者CIN發生率為5.1%,與無糖尿病患者CIN發生率相比,差異無統計學意義。臨床上糖尿病患者血管介入術后發生CIN,多因伴有潛在慢性腎臟疾病[11]。本組患者神經介入術后eGFR較術前有所下降,但未出現需要臨床治療的腎損害,這與上述Morabito 等[10]研究結果基本一致。
sCr值是臨床評價腎功能的常用指標,僅在腎功能損傷導致eGFR下降>50%時才會下降,因此并不能作為早期腎損害敏感指標。血清Cys C與sCr相比,可在腎小管中自由過濾、重吸收和代謝,腎小管自身分泌對其無影響,具有穩定的生產率且無明顯變異,可在24 h內及早發現eGFR下降[12]。介入術前、術后24 h聯合檢測2型糖尿病患者sCr、血清CysC,評估腎功能,是監測術后CIN的重要措施。本組腦血管病伴2型糖尿病患者術后24 h sCr及Cys C水平均較術前明顯增高(P<0.000 1,P=0.015),且eGFR較術前明顯降低(MDRD公式P<0.000 1,Larsson公式 P=0.021),提示 2型糖尿病患者神經介入術后腎功能較術前明顯下降;根據MDRD公式,術后腎功能2~5級分布百分率較術前明顯增高(P=0.019),提示2型糖尿病患者接受神經介入術對腎功能有影響;sCr計算所示CIN發生率為5.6%,CysC計算所示CIN發生率為18.6%,提示血清Cys C可更早期發現CIN,與Kato等[13]結論一致;術后腎功能雖有一定程度下降,但未發生須規范治療的腎病,提示2型糖尿病患者神經介入術前只要 sCr<123 μmol/L,eGFR 在腎功能分級中≤3級,術中應用常規劑量對比劑是安全的。
CIN發病機制目前還未完全清楚,可能涉及腎臟血流動力學改變、血管內皮活性介質表達、自由基產生,或對比劑直接對腎小管毒性所致腎功能損害[14]。一般人群中 CIN 發病率約為 2%[15],但在高危患者中可達90%[16]。高危患者通常存在腎損害危險因素,如伴發腎損傷的慢性基礎疾病(如糖尿病)、大劑量應用對比劑或長期服用導致腎損傷藥物[17]。因此,本研究在選擇研究對象時,將有腎功能不全患者排除在外。
臨床上有些2型糖尿病患者神經介入術前sCr、血清Cys C指標均在正常范圍,但仍可能存在eGFR偏低,增加術后發生CIN風險,故需綜合評估患者腎功能。Davenport等[18]回顧性分析10年期20 242例腎功能穩定患者,其中10 121例注射對比劑,10 121例未注射對比劑,結果提示eGFR<30 mL·min-1·1.73 m-2患者易發生 CIN, 30~44 mL·min-1·1.73 m-2時呈 CIN 趨勢,≥45 mL·min-1·1.73 m-2患者注射對比劑后未發現對比劑腎毒性,從而得出sCr>1.5 mg/dL 或 eGFR<45 mL·min-1·1.73 m-2患者,可能易發生腎功能損害。本組6例患者術前eGFR(MDRD 公式)為 30~59 mL·min-1·1.73 m-2,其中4例術后24 h eGFR不同程度(1~7 mL·min-1·1.73 m-2)下降,最低達 31 mL·min-1·1.73 m-2,但均未出現有臨床癥狀的腎損害,可能與圍手術期給予靜脈水化處理有關。2型糖尿病患者多為老年人,長期糖尿病病史對腎功能損傷可能早期難以發現,神經介入術前可根據患者sCr及Cys C計算eGFR,評估腎功能。只要eGFR>45 mL·min-1·1.73 m-2,神經介入術可能是安全的。
本研究尚存在一些不足,如所有患者均來自同一醫療中心,樣本量相對較少;對術后sCr、CysC檢測僅限術后24 h。進一步延長術后兩項指標檢測可能更有意義,這也是以后進一步研究方向。
[1] Darwish T.An evidence-based approach to minimise contrastinduced nephropathy[J].N Z Med J, 2009, 122: 39-41.
[2] Andreucci M, Solomon R, Tasanarong A.Side effects of radiographic contrast media: pathogenesis, risk factors, and prevention[J].Biomed Res Int, 2014, 2014: 741018.
[3] Stacul F, van der Molen AJ, Reimer P, et al.Contrast induced nephropathy:updated ESUR Contrast Media Safety Committee guidelines[J].Eur Radiol, 2011, 21: 2527-2541.
[4] Briguori C, Visconti G, Rivera NV, et al.Cystatin C and contrast-induced acute kidney injury[J].Circulation, 2010, 121:2117-2122.
[5]譚中寶,狄鎮海.對比劑腎病的預防——介入治療圍手術期處理[J].介入放射學雜志, 2012, 21: 261-264.
[6] 丁 力,莊國紅,丁 飚.靜脈水化和口服水化預防心功能不全患者對比劑腎病臨床應用[J].介入放射學雜志,2016,25:15-18.
[7] Heyman SN, Rosenberger C, Rosen S,et al.Why is diabetes mellitus a risk factor for contrast-induced nephropathy?[J].Biomed Res Int, 2013, 2013: 123589.
[8] Manske CL,Sprafka JM,Strony JT,et al.Contrast nephropathy in azotemic diabetic patients undergoing coronary angiography[J].Am J Med, 1990, 89: 615-620.
[9] Khamaisi M,Raz I,Shilo V,et al.Diabetes and radio contrast media increase endothelin converting enzyme1 in the kidney[J].Kidney Int, 2008, 74: 91-100.
[10] Morabito S, Pistolesi V, Benedetti G, et al.Incidence of contrast-induced acute kidney injury associated with diagnostic or interventional coronary angiography[J].J Nephrol, 2012, 25:1098-1107.
[11]Pisani A,Riccio E,Andreucci M,et al.Role of reactive oxygen species in pathogenesis of radiocontrast-induced nephropathy[J].Biomed Res Int, 2013, 2013: 868321.
[12] Moore E, Bellomo R, Nichol A.Biomarkers of acute kidney injury in anesthesia, intensive care and major surgery: from the bench to clinical research to clinical practice[J].Minerva Anestesiol, 2010, 76: 425-440.
[13] Kato K, Sato N, Yamamoto T, et al.Valuable markers for contrast-induced nephropathy in patients undergoing cardiac catheterization[J].Circ J, 2008, 72: 1499-1505.
[14]Pisani A,Sabbatini M,Riccio E,et al.Effect of a recombinant manganese superoxide dismutase on prevention of contrastinduced acute kidney injury[J].Clin Exp Nephrol, 2014, 18:424-431.
[15] Berg KJ.Nephrotoxicity related to contrast media[J].Scand J Urol Nephrol, 2000, 34: 317-322.
[16] Gleeson TG, Bulugahapitiya S.Contrast-induced nephropathy[J].AJR Am J Roentgenol, 2004, 183: 1673-1689.
[17] Itoh Y, Yano T, Sendo T, et al.Critical review clinical and experimental evidence for prevention of acute renal failure induced by radiographic contrast media[J].J Pharmacol Sci,2005,488:473-488.
[18] Davenport MS, Khalatbari S, Cohan RH, et al.Contrast materialinduced nephrotoxicity and intravenous low-osmolality iodinated contrast material:risk stratification by using estimated glomerular filtration rate[J].Radiology, 2013, 267: 94-105.

