p-MTOR在結腸癌中的表達及與患者病理學特征的關系
孫紅蘭,劉慧峰,姜國丹
首都醫科大學附屬北京潞河醫院普外科,北京1011000
隨著人們飲食結構的改變,結腸癌的發病率呈逐年上升的趨勢,現已成為臨床上影響患者生活質量甚至危及生命的嚴重疾病之一[1‐3]。目前結腸癌的腫瘤標志物較多,磷酸化雷帕霉素靶蛋白(phosphor‐ylated mechanistic target of rapamycin,p‐MTOR)就是其中之一[4‐5]。p‐MTOR 是 AKT/MTOR 信號通路中的重要中心調控蛋白,主要調控細胞的生存、增殖以及凋亡,通過磷酸化下游多種蛋白的方式來調控基因的翻譯和轉錄,進而可調控蛋白質合成和血管內皮細胞增殖,因此有望成為腫瘤治療的新靶點,從而開發新的治療措施和治療藥物[6‐8]。本文通過研究p‐MTOR在結腸癌組織中表達的變化以及對預后的影響,為臨床應用提供理論依據。
1 資料與方法
1.1 一般資料
選取首都醫科大學附屬北京潞河醫院收集的結腸癌患者的結腸癌組織標本110例及其對應的癌旁正常組織110例。納入標準:①結腸癌的診斷主要依據腸鏡活組織病理學、術后病理學結果;②結腸癌癌旁組織來源于距離腫瘤邊緣3 cm的結腸組織;③患者術前未接受放化療、免疫治療;④全身各系統無嚴重疾病;⑤患者的各項資料完整。排除標準:①合并其他部位腫瘤疾病;②既往具有放化療病史;③伴其他系統嚴重疾病;④資料不完整難以納入統計。所有患者中,男62例,女48例;年齡37~79歲,平均(58.3±12.6)歲;TNM分期:Ⅰ期20例,Ⅱ期29例,Ⅲ期48例,Ⅳ期13例;組織學分級:高分化31例,中分化49例,低分化30例;伴有淋巴結轉移41例;腫瘤部位:乙狀結腸38例,升結腸21例,橫結腸29例,降結腸22例。
1.2 免疫組化檢測方法
所有石蠟標本采用4 μm連續切片,逐級脫蠟至水,用H2O(23%)封閉內源性過氧化物酶10 min,后高溫高壓熱修復,牛血清(2%)封閉20 min,滴加羊抗人濃縮型多克隆抗體MTOR和一抗(p‐MTOR、HⅠF‐1α單抗的稀釋濃度分別為1∶100、1∶50),放入濕盒內,冰箱(4℃)孵育過夜,然后滴加生物素標記,保持室溫20 min,滴加辣根酶標記的鏈霉親和素,二氨基聯苯胺(diaminobenzidine,DAB)顯色,后進行脫水、透明及封片。
1.3 判斷標準
p‐MTOR蛋白主要表達于細胞質,陽性著色表達于細胞質和細胞膜,呈黃色、棕黃色、褐色表達,免疫組化結果判定:①根據著色強度,0分為無色,1分為淡黃色,2分為棕黃色,3分為褐色、黑色;②根據陽性細胞比例,陽性細胞所占比例≤10%為1分,陽性細胞所占比例11%~50%為2分,陽性細胞所占比例51%~75%為3分,陽性細胞所占比例>75%為4分。兩種積分相乘總分<3分為陰性,≥3分為陽性;總分<3分為“-”,總分3~5分為“+”,總分6~9分為“++”,總分>9分為“+++”。
1.4 統計學方法
采用SPSS 16.0統計-軟件進行數據分析,計量資料以均數±標準差(±s)進行統計描述,計數資料以例數及率(%)表示,組間比較采用χ2檢驗;生存分析采用Kaplan‐Meier法,生存時間比較采用Log‐rank法;多因素分析采用Cox比例風險回歸模型;以P<0.05為差異有統計學意義。
2 結果
2.1 p-MTOR蛋白表達水平
結腸癌組織中p‐MTOR蛋白陽性表達率為54.55%(60/110),明顯高于癌旁組織的10.00%(11/110),差異有統計學意義(χ2=49.931,P<0.01)。(表1、圖1)
2.2 結腸癌組織中p-MTOR蛋白陽性表達與患者臨床病理特征的關系
110例結腸癌癌組織中,p‐MTOR蛋白陽性60例(54.55%),陰性50例(45.45%);不同TNM分期、浸潤深度及是否有淋巴結轉移患者結腸癌組織中p‐MTOR蛋白陽性表達率比較,差異有統計學意義(P<0.01)。(表2)

表1 兩種組織標本中的p‐MTOR蛋白表達水平

圖1 p‐MTOR蛋白陽性表達的病理結果圖(免疫組化染色,×100)
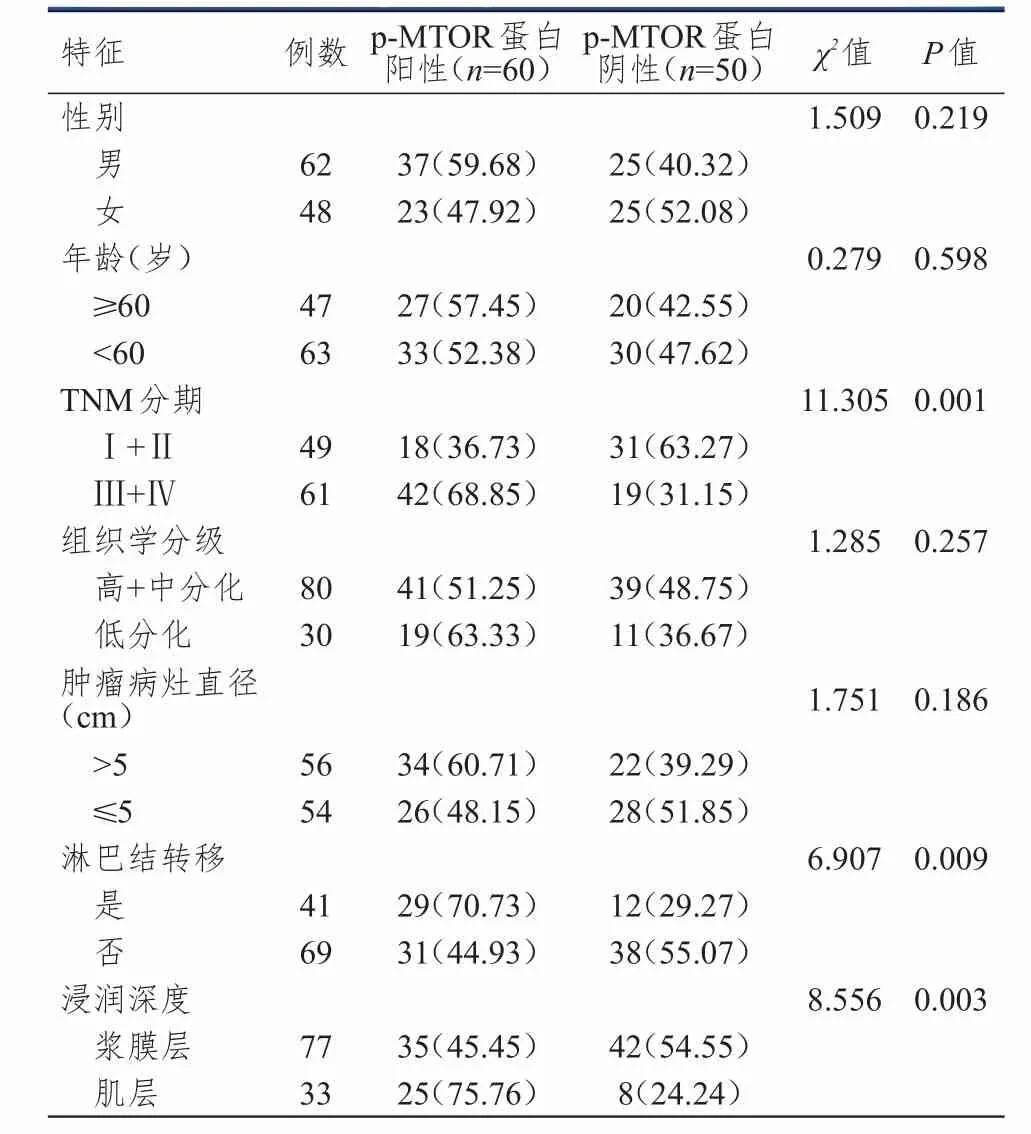
表2 結腸癌組織中p‐MTOR蛋白陽性表達與患者臨床病理特征的關系[ n(%)]
2.3 結腸癌組織中p-MTOR蛋白陽性表達與患者預后的關系
結腸癌組織中p‐MTOR蛋白陽性表達患者的3年生存率(28.33%)明顯低于p‐MTOR蛋白陰性表達患者(55.00%),差異有統計學意義(χ2=8.364,P=0.004),詳見圖2;采用Cox比例風險回歸模型進行分析結果顯示,TNMⅢ+Ⅳ期、發生淋巴結轉移、浸潤肌層、p‐MTOR蛋白陽性表達是結腸癌患者不良預后的獨立危險因素(P<0.05),詳見表3。
3 討論
結腸癌是臨床上高發的消化道惡性腫瘤之一,隨著其發病率的逐年增加,其病死率也躍居中國惡性腫瘤第5位,嚴重威脅著人們的生命健康,因此結腸癌的治療一直是臨床上的熱點問題。由于近年來對腫瘤細胞和分子水平研究的深入,提出了腫瘤干細胞的假說,即腫瘤細胞起始于一群具有增殖能力的細胞,進而維持腫瘤的不斷更新及分化,從而形成異質細胞群體,因此在此假說基礎上的治療,可以通過抑制該類細胞的增殖分化,以達到治療的目的[9‐10]。據報道,多種惡性腫瘤的發生與PⅠ3K/AKT/MTOR信號通路活化密切相關,該通路可以加速細胞周期、降低細胞凋亡并促進腫瘤細胞的遷移,因此可以通過控制該通路的活化,從而抑制腫瘤細胞的生長[11‐12]。生長因子等物質可經過PⅠ3K/AKT/MTOR信號通路磷酸化MTOR的Ser2448位點,從而激活 MTOR,即為 p‐MTOR,p‐MTOR有助于維持細胞未分化的狀態,進而促進癌細胞去分化[13]。p‐MTOR可以改變S6k1和4E‐BP1的磷酸化狀態啟動翻譯過程,從而啟動HⅠF‐1的翻譯,提高HⅠF‐1的表達。被活化的p‐MTOR可通過抑制腫瘤細胞凋亡、加速血管生成、促進腫瘤浸潤與轉移和促進藥物抵抗等方面來加速腫瘤的病情發展,因此p‐MTOR作為該過程的核心蛋白,具有作為結腸癌治療新靶點的希望,在臨床上可以通過藥物等治療手段以抑制p‐MTOR的活性或活化過程,從而控制癌細胞的增殖、分化及轉移,從而抑制腫瘤的生長,達到治療的目的[14‐15]。
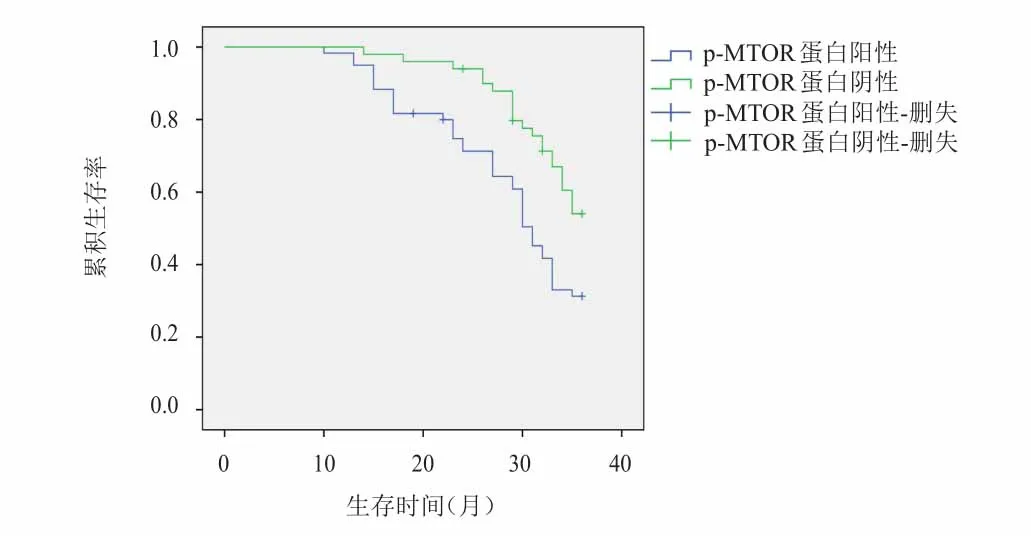
圖2 兩組患者的生存曲線圖
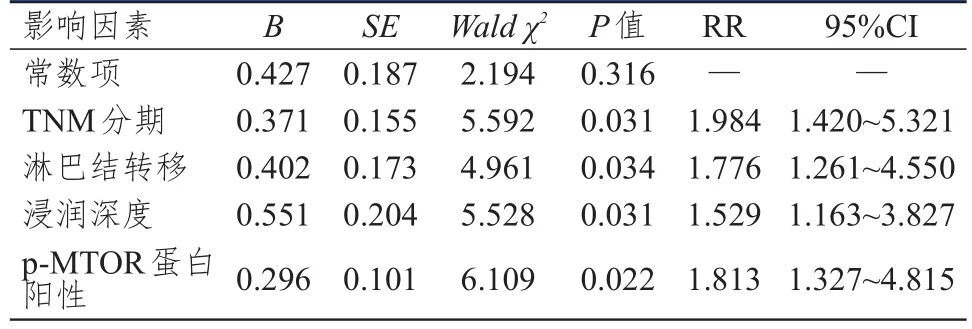
表3 結腸癌組織中p‐MTOR蛋白陽性表達與患者預后的關系
3.1 兩種組織標本中p-MTOR蛋白表達水平的比較
p‐MTOR是結腸癌的重要腫瘤標志物,是結腸癌癌細胞增殖、分化和轉移的關鍵蛋白酶,因此其水平可隨著結腸癌的發生而明顯升高,因此本文對比考察了結腸癌組織和癌旁組織的p‐MTOR陽性表達,發現結腸癌組織中p‐MTOR蛋白陽性表達率明顯高于癌旁組織,差異有統計學意義,這表明p‐MTOR可以作為結腸癌特異性的腫瘤標志物,p‐MTOR的表達水平和結腸癌的發生有關。
3.2 結腸癌組織中p-MTOR蛋白陽性表達與患者臨床病理特征的關系
臨床上常用TNM分期、淋巴結轉移和浸潤深度等臨床病理特征來評估結腸癌的發展程度,而結腸癌組織中p‐MTOR會參與到癌細胞增殖、分化、浸潤和轉移的全過程。本研究發現結腸癌組織中p‐MTOR蛋白陽性表達率與患者的TNM分期、淋巴結轉移、浸潤深度有關,因此證明p‐MTOR蛋白陽性表達與TNM分期、淋巴結轉移和浸潤深度具有對應關系,p‐MTOR蛋白表達水平可以在一定程度上反映結腸癌病情發展的程度。
3.3 結腸癌組織中p-MTOR蛋白陽性表達與患者預后的關系
結腸癌癌細胞容易脫落擴散轉移,因此治療后患者易復發或在其他部位出現轉移癌,由于p‐MTOR在癌細胞增殖、分化、擴散、轉移的過程中均起到了重要作用,因此可以用其蛋白陽性表達情況來預測結腸癌的預后。本研究討論了p‐MTOR蛋白陽性表達與患者預后的關系,發現p‐MTOR蛋白陽性表達患者的3年生存率低于p‐MTOR蛋白陰性表達患者;采用Cox比例風險回歸模型進行分析結果顯示,TNM分期增高、發生淋巴結轉移、浸潤肌層、p‐MTOR蛋白陽性表達是結腸癌患者不良預后的獨立危險因素,這表明p‐MTOR蛋白陽性表達可以促進癌癥的復發和擴散,嚴重降低患者生活質量,導致不良預后的發生,而p‐MTOR蛋白陽性表達與TNM分期增高、發生淋巴結轉移以及浸潤肌層等病理特征一樣,可作為癌癥發生發展的促進因素之一,因此臨床可以通過控制p‐MTOR蛋白陽性表達來治療結腸癌。
綜上所述,本文通過研究p‐MTOR陽性表達水平與結腸癌組織、臨床病理特征以及患者預后的關系,發現p‐MTOR陽性表達水平與結腸癌的發生發展關系密切,可在一定程度上反映結腸癌病情發展的程度并是結腸癌發生的獨立危險因素,因此臨床上可以通過抑制p‐MTOR陽性表達,從而控制結腸癌的發生發展及不良預后的發生。
[1]張芬,石振旺,王志紅.結直腸癌篩查技術的研究進展[J].國際消化病雜志,2016,36(6):343‐346.
[2]金鮮珍,陳瑾,廖春艷,等.持續性護理對結腸癌患者術后生活質量的影響[J].山西醫藥雜志,2015,44(21):2584‐2586.
[3]Wynder EL,Reddy BS.Colon cancer prevention:today’s challenge to biomedical scientists and clinical investigators[J].Cancer,1977,40(5 Suppl):2565‐2571.
[4]許星宇,陳博,熊茂明.p‐mTOR在胃癌組織中的表達與臨床病理及預后的關系[J].中華普通外科雜志,2016,31(2):145‐148.
[5]馬志恒,蔣海存,陳建新,等.mTOR信號通路與胃癌的相關性研究[J].國際消化病雜志,2016,36(4):256‐258.
[6]張春,李清漪,董海影,等.PⅠ3K/AKT/mTOR信號通路在誘導膠質瘤細胞凋亡中的作用[J].中國新藥雜志,2016,25(16):1909‐1912.
[7]Zhang X,Shi H,Tang H,et al.miR‐218 inhibits the inva‐sion and migration of colon cancer cells by targeting the PⅠ3K/Akt/mTOR signaling pathway[J].Ⅰnt J Mol Med,2015,35(5):1301‐1308.
[8]Chen J,Shao R,Li F,et al.PⅠ3K/Akt/mTOR pathway dual inhibitor BEZ235 suppresses the stemness of colon cancer stem cells[J].Clin Exp Pharmacol Physiol,2015,42(12):1317‐1326.
[9]李姍姍,邊育紅,王麗.基于腫瘤干細胞的西黃丸抗結腸癌作用研究[J].天津中醫藥,2017,34(3):181‐185.
[10]曲澤,侯明星,王峰.結腸癌腫瘤干細胞相關因子研究進展[J].中國腫瘤臨床與康復,2017,24(3):376‐380.
[11]郭琳,王強.PⅠ3K/Akt/mTOR信號傳導通路與惡性腫瘤浸潤和轉移的研究進展[J].現代腫瘤醫學,2009,17(8):1585‐1589.
[12]Manfredi GⅠ,Dicitore A,Gaudenzi G,et al.PⅠ3K/Akt/mTOR signaling in medullary thyroid cancer:a promising molecular target for cancer therapy[J].Endocrine,2015,48(2):363‐370.
[13]劉田田,畢經旺.PⅠ3K/Akt/mTOR信號通路與結直腸惡性腫瘤[J].實用醫藥雜志,2016,33(4):367‐370;374.
[14]王茜,時延龍,畢經旺.p‐mTOR與HⅠF‐1α在結直腸癌組織中的表達及其臨床意義[J].中國腫瘤生物治療雜志,2015,22(6):779‐784.
[15]張少華,畢經旺.結直腸癌組織中S6K1及4EBP1蛋白的表達及其與臨床病理特征的關系[J].中國腫瘤生物治療雜志,2015,22(6):747‐753.

