雞白痢沙門氏菌陽性血清國家標準品制備用菌株的篩選
張 媛,魏財文,李 建,王秀麗,彭國瑞,張一幟,辛凌翔,蔣玉文
(中國獸醫藥品監察所,北京 100081)
雞沙門氏菌病包括雞白痢、雞傷寒以及雞副傷寒,是影響養雞業的細菌性傳染病,嚴重影響雛雞成活率,也是成年雞減產的重要隱患之一,而且會造成其肉蛋產品的污染,進而帶來或引起食品安全問題[1]。水平傳播和垂直傳播在雞白痢的流行過程中均發揮著重要作用[2]。感染雞白痢沙門氏菌和雞傷寒沙門氏菌的種雞所產的蛋帶菌率高達33%[3]。雞沙門氏菌病普遍存于我國雞養殖業中,對養雞業危害極大[4-6]。
目前國內對于雞沙門氏菌病,尤其是對雞白痢和雞傷寒還無有效的疫苗可用。控制雞白痢、雞傷寒最有效的措施是參照中華人民共和國農業行業標準《NY/T 536-2017雞傷寒和雞白痢診斷技術》[7]對雞群進行雞白痢-雞傷寒抗體檢測,淘汰陽性雞只。雞白痢雞傷寒診斷試劑質量直接影響檢測結果的準確性,需要使用標準物質對試劑質量進行評價與控制。中國獸醫藥品監察所是我國獸用標準物質研制、供應的法定單位,已有多年制備雞白痢抗原和陽性血清的經驗,但還需繼續對陽性血清進行系統標準化研究。
英國國家生物標準與檢定所(National Institute for Biological Standards and Control, NIBSC),是世界衛生組織WHO的一個國際標準品供應中心,研制和供應雞白痢沙門氏菌陽性血清標準型及變異型標準品。雞白痢陽性血清國際標準品由于制備過程復雜、需組織國際協作標定、費用較高、供應量少等原因,而難于被廣泛用于雞白痢雞傷寒診斷結果的確認、診斷技術的驗證。因此,亟需研制相應國家標準品。
雞白痢沙門氏菌是研究、制備雞白痢沙門氏菌陽性血清國家標準品的基礎,篩選出抗原性及免疫原性良好的制備用菌株是標準物質建立的關鍵和重要前提,對標準物質的質量具有很大影響。本課題組從10株來源背景清晰的雞白痢沙門氏菌菌株中篩選出分別符合標準型菌株特性及變異型菌株特性且抗原效價較為理想的CVCC79201株菌株及CVCC79207株菌株,兩株菌均具備較好的免疫原性,可分別用于制備標準型雞白痢沙門氏菌陽性血清國家標準品及變異型雞白痢沙門氏菌陽性血清國家標準品。
1 材料與方法
1.1菌株備選雞白痢沙門氏菌菌株,共10株,均為CVCC保藏[8]。各菌株來源歷史如表1所示。
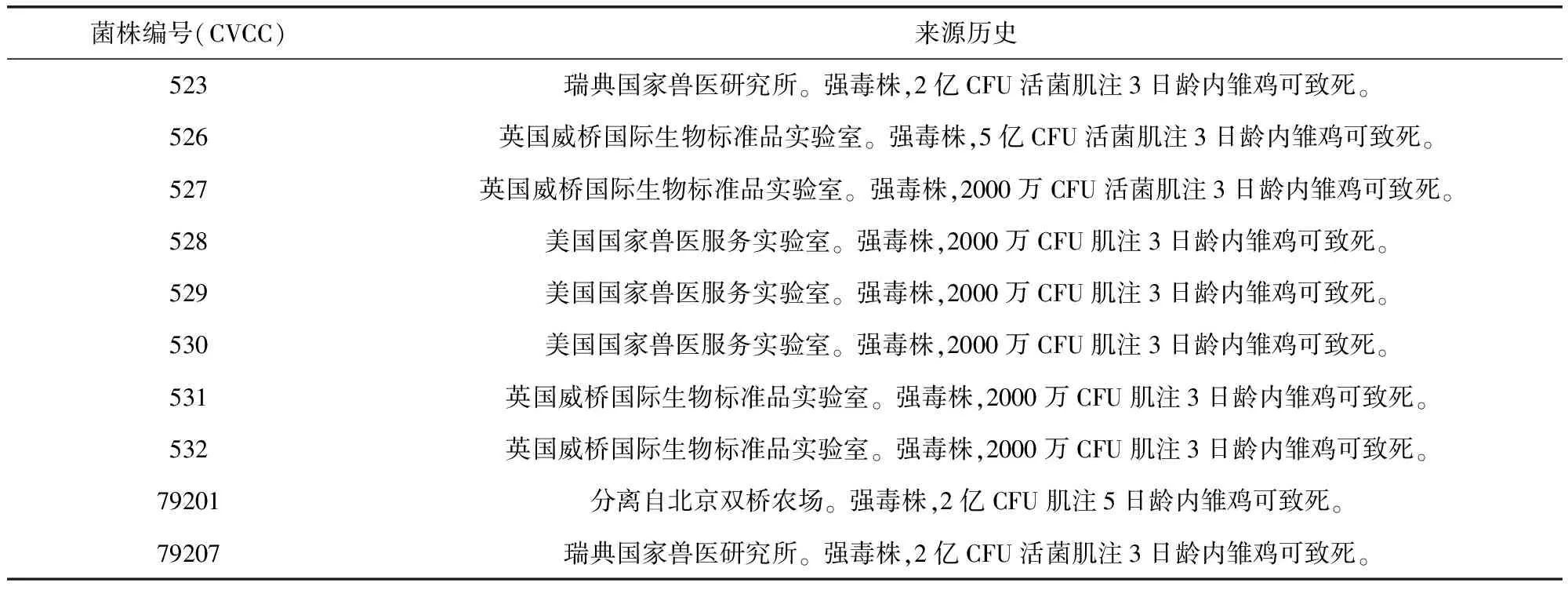
表1 實驗所用菌株Tab 1 Strains in the test
1.2培養基及試劑普通肉湯、普通瓊脂、硫代硫酸鈉瓊脂、磷酸鹽緩沖鹽水(0.07 mol/L,pH7.0~7.2)均購自北京中海動物保健科技公司。革蘭氏染色液、沙門氏菌生化鑒定管均購自青島高科技工業園海博生物技術有限公司。國際標準品Anti-S.Pullorum Serum(S)、 Anti-S.Pullorum Serum(V)購自英國國家生物標準與檢定所。沙門氏菌O9定型血清購自丹麥國家血清研究院。Premix Taq購自TaRaKa公司。MarkerⅡ購自Biomed公司。瓊脂糖購自寶生物工程(大連)有限公司。染料Goldview購自Biotium公司。細菌比濁標準管購自中國食品藥品檢定研究院。沙門氏菌O122、O123定型血清、1∶500吖啶黃溶液、PCR陰性對照品(大腸桿菌PCR產物)、雞白痢雞傷寒多價染色平板抗原參考品均由中國獸醫藥品監察所細菌制品檢測室提供。
1.3PCR引物選取沙門氏菌invA基因合成引物,上游引物為5'-TGTTCGTCATTCCATTACCT-3',下游引物為5'-ATCGGCATCAATACTCATCT-3',引物均由上海Invitrogen公司合成。
1.4實驗動物1.5~2.0 kg健康家兔購自北京維通利華實驗動物技術有限公司。
1.5形態取菌種培養物進行革蘭氏染色,鏡檢。
1.6生化特性參照試劑的使用說明書進行檢定。
1.7培養特性菌種接種普通肉湯和普通瓊脂平板,37 ℃培養24 h,觀察細菌生長特性。
1.8變異檢查將菌種的普通瓊脂新鮮培養物,與1∶500吖啶黃溶液及生理鹽水分別進行平板凝集反應。
1.9PCR檢測無菌操作取1.0 mL滅菌生理鹽水于1.5 mL EP管中,用接種環挑取不同菌種的菌落純培養物置于滅菌生理鹽水中,沸水浴5 min,放置低溫迅速冷卻,備用。PCR體系:Premix Taq 12.5 μL,上游引物和下游引物各0.5 μL,模板溶液2 μL,三蒸水10.5 μL。PCR反應條件:95 ℃ 5 min;95 ℃ 45 s,53 ℃ 45 s,72 ℃ 45 s,共32個循環;最后72 ℃ 5 min,20 ℃ 5 min。PCR產物電泳鑒定:配制2.0 %瓊脂糖溶液,按50 μL /L加Goldview制膠,取7 μL PCR產物點樣,以Marker Ⅱ作對照,120 V電泳20 min取出凝膠,在凝膠成像儀上觀察結果。
1.10血清學特性參照試劑的使用說明書進行檢定。
1.11抗原性鑒定用菌種接種硫代硫酸鈉瓊脂扁瓶培養基,收集菌苔后,調整菌液濃度為2.0×1010CFU/mL,滅活后制備成平板凝集反應抗原。將WHO標準實驗室提供的Anti-S.Pullorum Serum(S)及Anti-S.Pullorum Serum(V)國際標準品進行稀釋,使其終濃度分別為500 IU/mL (強陽性血清)及10 IU/mL (弱陽性血清)。取稀釋好的強陽性血清與弱陽性血清分別與反應抗原進行平板凝集試驗,2 min內記錄結果。
1.12免疫原性
1.12.1免疫抗原的制備根據抗原性鑒定結果,分別選擇抗原效價最好的標準型雞白痢沙門氏菌及變異型雞白痢沙門氏菌各1株制備免疫抗原。接種硫代硫酸鈉瓊脂扁瓶,置37 ℃培養48 h,取純粹生長的扁瓶,吸棄凝集水,用含2 %甲醛溶液的磷酸鹽緩沖鹽水(0.07 mol/L,pH7.0~7.2)將培養物洗下,收集于帶玻璃珠的中性玻璃瓶中,振蕩打碎菌塊,置37 ℃滅活48 h,經無菌檢驗合格后,無水乙醇沉淀濃縮,以細菌比濁標準管為標準確定其濃度。保存于2~8 ℃備用。
1.12.2免疫程序家兔靜脈注射免疫原6次,免疫劑量分別為1.0×109、2.0×109、4.0×109、8.0×109、1.6×1010、3.2×1010CFU/只,每次間隔7日,末次注射7日后試血。如血清效價不夠,再用最后免疫劑量注射1次,當血清效價達到1∶2560以上,方可采血。
1.12.3血清制造以常規方法采血,提取血清,按血清總量的0.02%加入硫柳汞。
1.12.4血清效價測定用菌種接種硫代硫酸鈉瓊脂扁瓶培養基,收集菌苔后,調整菌液濃度為1.0×109CFU/mL,滅活后制備成試管凝集反應抗原。將血清稀釋成1∶400、1∶800、1∶1600……1∶12800等稀釋度;同法稀釋Anti-S.Pullorum Serum(S)及Anti-S.Pullorum Serum(V)國際標準品。吸取每個稀釋度的血清加入試管中,每管1.0 mL,每管加入試管凝集反應抗原1.0 mL。抗原對照為含0.5 %苯酚生理鹽水1.0 mL與試管凝集反應抗原1.0 mL混合,觀察是否有自凝現象。振搖混勻后,置37 ℃反應20 h,然后置室溫2 h,記錄結果。
2 結 果
2.1形態經染色觀察,10株菌均為革蘭氏陰性小桿菌。
2.2生化特性10株菌的生化特性均符合沙門氏菌的特性。
2.3培養特性10株菌在普通肉湯中的生長均為一致混濁,在普通瓊脂平板上均生長為光滑濕潤、微隆起、半透明的圓整菌落。
2.4變異檢查經平板凝集試驗,10株菌與1∶500吖啶黃溶液和生理鹽水均不發生凝集。
2.5PCR檢測用根據沙門氏菌invA基因合成的引物進行PCR擴增,10株菌均可擴增出395 bp的特異性條帶,擴增結果見圖1。
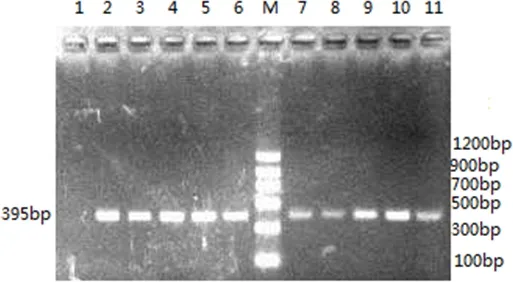
M:Marker Ⅱ;1:陰性對照:大腸桿菌;2:79207株;3:79201株;4:532株;5:531株;6:530株;7:529株;8:528株;9:527株;10:526株;11:523株M: Marker Ⅱ; 1: Negative control: E.coli; 2: CVCC79207 strain; 3: CVCC79201 strain; 4: CVCC532 strain; 5:CVCC531 strain; 6: CVCC530 strain; 7: CVCC529 strain; 8: CVCC528 strain; 9: CVCC527 strain; 10: CVCC526 strain; 11: CVCC523 strain圖1 10株菌invA PCR產物的電泳Fig 1 Electrophoresis of invA PCR products from 10 strains
2.6血清學特性經平板凝集試驗,CVCC523、526、527、528、79201株菌的血清型為沙門氏菌O9、O123,為標準型雞白痢沙門氏菌;CVCC529、530、531、532、79207株菌的血清型為沙門氏菌O9、O122,為變異型雞白痢沙門氏菌。
2.7抗原性鑒定經抗原性鑒定,CVCC523、526、527、528、529、530、531、532、79201、79207株菌制備的抗原與WHO標準實驗室提供的Anti-S.Pullorum Serum(S)及Anti-S.Pullorum Serum(V)國際標準品的強陽性血清和弱陽性血清均能發生不同程度的凝集反應,但標準型菌株中的CVCC79201株及變異型菌株中的CVCC79207株制備的抗原與國際標準品Anti-S.Pullorum Serum(S)及Anti-S.Pullorum Serum(V)的凝集效價均高于其它抗原,效價測定結果見表2。平板凝集反應判定標準:++++表示出現明顯的顆粒狀或片狀凝集,液體完全透明,即100%凝集;+++表示出現明顯的顆粒狀或片狀凝集,但液體微現混濁,即75%凝集;++表示出現均勻一致的凝集顆粒,液體中等混濁,即50%凝集;+表示出現細微顆粒,液體混濁不透明,即25%凝集;-表示未出現凝集,液體完全混濁不透明,即無凝集。當50 μL抗原與50 μL含0.5%苯酚生理鹽水無凝集(-)時試驗成立。

表2 10株菌的抗原性鑒定結果Tab 2 Antigenic characteristics of 10 strains
經形態、生化特性、培養特性、變異檢查、PCR檢測結果表明,CVCC523、526、527、528、529、530、531、532、79201、79207均為沙門氏菌。根據血清學特性、抗原性鑒定結果,CVCC79201株及CVCC79207株分別符合雞白痢沙門氏菌標準型菌株及變異型菌株的特性,且抗原效價最為理想。
2.8免疫原性免疫CVCC79201株制備的標準型抗原的6只家兔血清試管凝集效價均高于Anti-S.Pullorum Serum(S)國際標準品血清效價,免疫CVCC79207株制備的變異型抗原的6只家兔血清試管凝集效價均高于Anti-S.Pullorum Serum(V)國際標準品血清效價,見表3、表4。試管凝集反應判定標準:++++表示抗原呈堅實凝塊或呈細沙粒樣均勻鋪于孔底,且孔底不可見抗原沉積,即100%凝集;+++表示抗原均勻鋪于孔底,邊緣可有卷曲,且孔底可見微量抗原沉積,即75%凝集;++表示抗原沉積于孔底,可形成扣狀或環狀,孔底沉積的抗原明顯少于生理鹽水對照,且沉積的抗原四周有明顯凝集顆粒,即50%凝集;+表示抗原沉積于孔底,可形成扣狀或環狀,孔底沉積的抗原略小于生理鹽水對照,且沉積的抗原的四周有少量凝集顆粒,即25%凝集;-表示抗原沉積于孔底,邊緣光滑整齊,且不可見凝集顆粒者,即無凝集。判定時應按血清最終稀釋度計算,如第一管中血清稀釋倍數為1∶400,其加入等量抗原后最終稀釋度為1∶800。當抗原對照無凝集(-)時試驗成立,以出現不低于"++"凝集的最高血清最終稀釋度判定為血清效價。
可見,CVCC79201株及CVCC79207株均具備較好的免疫原性,故選用標準型雞白痢沙門氏菌CVCC79201株作為制備雞白痢沙門氏菌陽性血清國家標準品(標準型)的生產菌株,選用變異型雞白痢沙門氏菌CVCC79207株作為制備雞白痢沙門氏菌陽性血清國家標準品(變異型)的生產菌株。
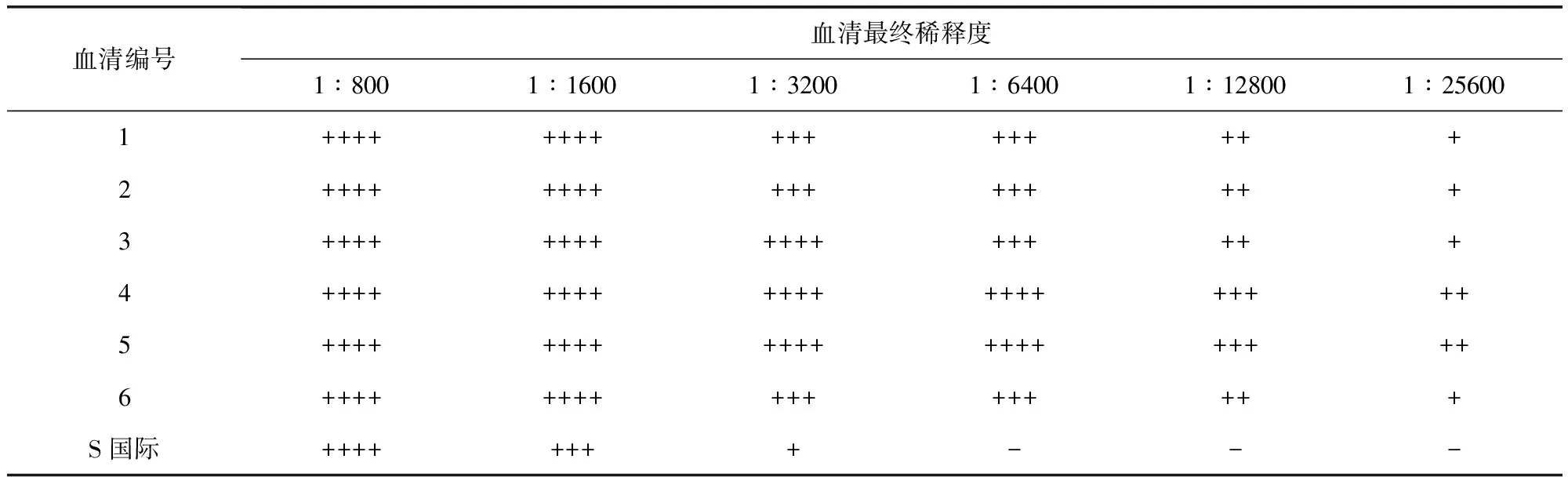
表3 抗雞白痢沙門氏菌血清(標準型)效價測定結果Tab 3 Potency of Anti-S.Pullorum Serum(S)
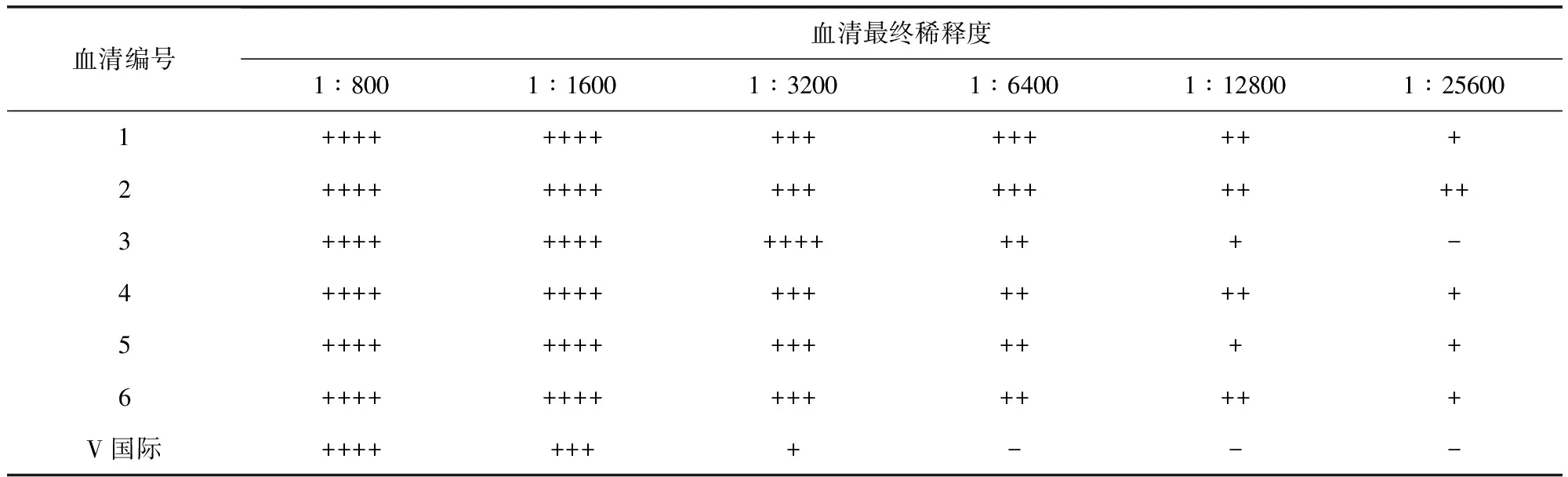
表4 抗雞白痢沙門氏菌血清(變異型)效價測定結果Tab 4 Potency of Anti-S.Pullorum Serum(V)
3 討 論
根據《中華人民共和國獸藥典》二〇一五年版[9]規定,雞白痢、雞傷寒多價染色平板凝集試驗陽性血清診斷試劑制備方法中要求使用雞白痢沙門氏菌陽性血清國家標準品進行標定。但是,雞白痢沙門氏菌陽性血清國家標準品尚未形成統一的標準化的制備規程。課題組按照《中華人民共和國獸藥典》二〇一五年版及《獸用生物制品規程》二〇〇〇年版相關要求,開展雞白痢沙門氏菌陽性血清國家標準品的研制工作。生產用菌株是制備標準物質最主要的原材料,菌株自身的特性直接關系到標準物質的質量,因此選定生產用菌種是研制雞白痢沙門氏菌陽性血清國家標準品的首要工作。
英國威橋國際生物標準品實驗室(NIBSC)是WHO的一個國際標準品供應中心實驗室。美國國家獸醫服務實驗室(NVSL)和瑞典國家獸醫研究所(SVA)是分別隸屬于美國農業部和瑞典農業部領導的動物疫病診斷官方權威機構,均是國家獸醫參考實驗室。10株備選菌株多數是中國獸醫微生物菌種保藏管理中心從此三個實驗室引進的標準菌株,背景清晰、毒力強、免疫原性穩定,適宜用作制備陽性血清國家標準品的候選菌株。
CVCC79201株及CVCC79207株菌完全符合雞白痢沙門氏菌的特性,而且具備良好的抗原性及免疫原性,可以作為制備雞白痢沙門氏菌陽性血清國家標準品(標準型)及雞白痢沙門氏菌陽性血清國家標準品(變異型)的生產用菌株。標準型雞白痢沙門氏菌CVCC79201株抗原制備的抗血清效價均不低于1∶12800,變異型雞白痢沙門氏菌CVCC79207株抗原制備的抗血清效價均不低于1∶6400,均高于標準型及變異型雞白痢沙門氏菌陽性血清國際標準品1∶1600的血清效價,這不僅保證了用此兩株菌制備的國家標準血清含有不低于國際標準血清的活性物質,而且可獲得較高的產量。制備出的雞白痢沙門氏菌陽性血清國家標準品將作為實物標尺用于雞白痢沙門氏菌抗原參考品、診斷試劑以及雞白痢沙門氏菌陽性血清診斷試劑的效價標定,減少不同廠家及同一廠家不同批次產品間差異,使種雞場雞白痢抗體檢測結果更準確,從而促進雞白痢凈化工作的開展。
參考文獻:
[1]謝懋英, 賴 婧, 馬立才, 等. 肉雞產業鏈中沙門菌流行情況及其耐藥性[J]. 中國獸醫學報, 2014, 34(11): 1790-1794.
Xie M Y, Lai J, Ma L C, et al. Prevalence and antimicrobial resistance of Salmonella in a broiler meat production chain from farm level to retail[J]. Chinese Journal of Veterinary Science,2014,34(11):1790-1794.
[2]殷俊磊, 李求春, 耿士忠, 等. 雞白痢沙門菌研究進展[J]. 中國獸醫學報, 2016, 36(9): 1624-1629.
Yin J L, Li Q C, Geng S Z, et al. Advances inSalmonellapullorum[J]. Chinese Journal of Veterinary Science, 2016, 36(9): 1624-1629.
[3]張永第. 雞白痢沙門氏菌的分離鑒定及微量平板凝集抗原的制備[D]. 陜西:西北農林科技大學, 2010.
Zhang Y D. Isolation and identification ofSalmonellapullorumand preparation of micro plate agglutination antigen[D]. Shaanxi: Northwest Agriculture and Forestry University,2010.
[4]王 亮. 山東省部分種雞場雞白痢和滑液囊支原體病的流行病學調查[D]. 山東:山東農業大學, 2015.
Wang L. The epidemiology investigation of pullorosis andMycoplasmasynovial on partial breeding chicken farms, Shandong[D]. Shandong Agricultural University,2015.
[5]方 翟. 湖北省雞源沙門氏菌的分離鑒定和耐藥性分析[D]. 湖北:華中農業大學, 2014.
Fang D. Isolation, identification and antibiotic resistance study ofSalmonellafrom chickens in Hubei province[D]. Huazhong Agricultural University,2014.
[6]錢明珠, 王申峰, 許蘭菊, 等. 河南雞源沙門菌的分離鑒定及其耐藥性分析[J]. 畜牧與獸醫, 2012, 44(8):29-33.
Qian M J, Wang S F, Xu L J, et al. Isolation and identification ofSalmonellafrom chickens in Henan and drug resistance[J]. Animal Husbandry & Veterinary Medicine, 2012, 44(8): 29-33.
[7]NY/T 536-2017. 雞傷寒和雞白痢診斷技術[S].
NY/T 536-2017. Diagnostic techniques for fowl typhoid and pullorum disease[S].
[8]中國獸醫藥品監察所.中國獸醫菌種目錄[M]. 2版. 北京:中國農業科學技術出版社, 2002: 94 -95.
China Institute of Veterinary Drugs Control. China veterinary species catalogue [M]. 2nd ed. Beijing: Chinese Agricultural Science and Technology Press, 2002: 94-95.
[9]中華人民共和國獸藥典二〇一五年版三部[S].
Veterinary Pharmacopoeia of People's Republic of China (Volume Ⅲ, 2015) [S].

