小鼠骨髓源性樹突細胞和脾源性樹突細胞的形態及生物學性能對比
張蘭蘭,閆軍堂,劉 敏,胡京紅,于 雪,范盎然,紀雯婷,任 虹,孫震宇
(北京中醫藥大學中醫學院,北京 100029)
樹突狀細胞(DCs)是機體最重要的抗原提呈細胞,也是唯一能激活初始T細胞的抗原提呈細胞,是機體免疫的始動者,在免疫抑制和免疫耐受等方面發揮著重要作用。近年來人們已經能在體外應用MCM培養基誘導生成高純度的DCs并已應用于腫瘤和過敏性疾病的治療[1],目前基于DCs的免疫治療也被認為是最具前景的治療方式[2]。一般來說DCs在體內分布較廣,外周血、脾臟、臍帶血、骨髓、皮膚等均有分布[3],但大都含量極少且獲得困難,如何獲取純度和性能較好的DCs用于更深入的DCs研究已經成為當前實驗研究的重點[4]。近年來學者們對DCs體外培養進行了大量積極的探索,小則從培養手法、因子濃度等入手,大則結合現代生物技術如磁珠分選、流式分選等對其進行研究,DCs培養技術已日漸趨于成熟。相比于其他來源的DCs,骨髓來源的DCs因其培養方法簡單、來源方便、含量較高等特點,成為應用較多的DCs研究來源,但1只小鼠的骨髓前體細胞經常規誘導后僅可生成(1~2)×107個DCs細胞,經分選后僅可獲得前者數量的1/10[5],遠遠不能滿足當前實驗對DCs的大量需求,故有必要對DCs進行更深入的探索。一直以來,脾源性DCs因其培養周期長、產量低等特點而較少應用于實驗研究[6],其確切的純度、產量和性能目前尚不明確,基于目前DCs缺乏的現狀,本課題組對脾源性DCs展開了研究。本研究通過在體外獲得骨髓前體細胞和脾細胞,用GM-CSF和IL-4誘導生成DCs,結合流式細胞術(FCM)和酶聯免疫吸附測定(ELISA)技術從兩者的形態、細胞表面特異性分子表達、相關因子分泌等方面進行對比,以期明確脾源性DCs的性狀和性能,為后期的實驗研究篩選合適的細胞。
1 實驗資料
1.1材料
1.1.1實驗動物C57BL/6雌性小鼠,SPF級5周齡,購于北京維通利華實驗動物技術有限公司,合格證號為SCXK(京)2012-0001。實驗小鼠均飼養在清潔級環境中統一喂養,取材時遵守人道主義原則,確保小鼠安樂死。
1.1.2主要試劑重組GM-CSF購于R&D(批號:404-ML-010),重組IL-4因子購于R&D(批號:404-ML-010),RPMI-1640購自美國Hy-clone公司(批號:11330032),紅細胞裂解液購于康為世紀,澳洲來源胎牛血清(FBS,批號:10099141),雙抗(批號:15140122),PE標記的抗小鼠CD83單克隆抗體(貨號:558205)及其同型對照(貨號:554685)、APC標記的抗小鼠CD11c單克隆抗體(貨號:554686)及其同型對照(貨號:557400)均購于BD公司,LPS購于Sigma公司,IL-12 ELISA試劑盒(批號: LOT20170321002)購于武漢六合生物有限公司。
1.1.3主要儀器INCO2/108型CO2培養箱,Leica-DM2500 型顯微圖像系統,ePPendorf離心機(型號:5810),Tecan酶標儀(型號:Safire2),BD流式細胞儀。
1.2方法
1.2.1小鼠骨髓源性DCs的分離與培養處理C57BL/6小鼠脫頸椎處死,無菌條件下分離股骨與脛骨,用無菌紗布將組織剔除干凈后用注射器將骨髓沖至培養皿中,收集到離心管中經離心后加入預溫37 ℃的紅細胞裂解液5 mL,靜置5 min后加RPMI-1640 5 mL終止裂解,離心2次后計數,用完全培養基(含10 ng/mL 重組IL-4、20 ng/mL 重組GM-CSF、10%滅活的FBS及1%雙抗)調整細胞濃度至1×106mL-1,將細胞種于6孔板,每孔2 mL于37 ℃、 5% CO2溫箱中培養,3 h后棄去上清,加入相同因子濃度的完全培養基繼續培養,48 h和96 h分別進行半換液處理,第8天部分細胞添加10 μg/mL LPS刺激DCs成熟。
1.2.2小鼠脾源性DCs的分離與培養處理C57BL/6小鼠脫頸椎處死,無菌條件下迅速取脾,研磨于1640培養基中,收集至離心管中經離心后加入預溫37 ℃的紅細胞裂解液5 mL,靜置5 min后加RPMI-1640 5 mL終止裂解,離心2次后計數,用完全培養基(含10 ng/mL 重組IL-4、20 ng/mL 重組GM-CSF、10%滅活的FBS及1%雙抗)調整細胞濃度至1×108mL-1,將細胞種于6孔板,每孔2 mL于37 ℃、 5% CO2溫箱中培養,3 h后棄去上清,加入相同因子濃度的完全培養基繼續培養,48 h和96 h分別進行半換液處理,第8天部分細胞添加10 μg/mL LPS刺激DCs成熟。
1.2.3倒置顯微鏡下細胞形態觀察取培養第5,7,8天骨髓源性DCs和脾源性DCs于倒置顯微鏡下觀察。
1.2.4掃面電鏡下細胞形態觀察收集培養第8天骨髓源性DCs和脾源性DCs,用3%戊二醛固定,用70%,90%,100%的乙醇進行梯度洗脫,乙酸異戊脂置換后,CO2臨界點干燥,掃描電鏡觀察細胞表面結構。
1.2.5FCM檢測收集培養第9天細胞,離心后用PBS重懸計數,取100 μL細胞量約為106的細胞于流式管中,分別加入APC標記的CD11c(小鼠DCs特異性表面標記物)抗體及同型對照抗體,PE-CD83及同型對照,室溫避光孵育20 min,離心后流式細胞儀檢測CD11c+及CD11c+CD83+的比例。
1.2.6ELISA檢測收集細胞上清,按照試劑盒說明書檢測IL-12含量。
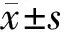
2 結 果
2.1倒置顯微鏡下DCs形態培養第5天時,骨髓源性DCs和脾源性DCs均有明顯的毛刺狀突起,懸浮于培養基中,不同的是脾源性DCs開始出現輕微聚集狀態,而骨髓源性DCs大多呈散在狀態,且底壁有明顯的枝狀巨噬細胞,見圖1和圖2。培養第7天時,骨髓源性DCs呈聚集狀態,散在細胞較少,毛刺較之前變大,DCs纏繞在一起,見圖3;脾源性DCs如葡萄狀懸浮于培養基中,其集落大于骨髓源性DCs的集落,見圖4。培養第8天時,骨髓源性DCs聚集狀態變大,呈葡萄狀懸浮于培養基中,細胞周邊可見明顯的毛刺狀突起,見圖5;脾源性DCs成簇狀懸浮于培養基中,其集落較之前明顯變大,而且明顯大于骨髓源性DCs的集落,見圖6。

圖1 培養第5天時骨髓源性DCs形態(×200)

圖2 培養第5天時脾源性DCs形態(×200)

圖3培養第7天時骨髓源性DCs形態(×200)

圖4 培養第7天時脾源性DCs形態(×200)
2.2掃描電鏡下DCs形態培養第8天,骨髓源性DCs表面呈云霧狀,周邊可見明顯的毛刺狀突起,兩個細胞緊緊聚集在一起,見圖7;脾源性DCs表面呈薄紗狀,周邊可見絲狀不定向突起或薄紗狀圓球形突起,5個細胞緊緊纏繞在一起,其集落明顯大于骨髓源性DCs集落,見圖8。

圖5 培養第8天時骨髓源性DCs形態(×200)

圖6 培養第8天時脾源性DCs形態(×200)

圖7 培養第8天時掃面電鏡下骨髓源性DCs形態(×10 000)

圖8 培養第8天時掃面電鏡下脾源性DCs形態(×10 000)
2.3DCs純度收集培養第8天的DCs流式鑒定其純度,先圈出目標細胞,通過同型對照可得骨髓源性DCs純度為(81.567±2.902)%,脾源性DCs 純度為(87.227±4.463)%,脾源性DCs純度高于骨髓源性DCs(t=1.841,P<0.05)。
2.4LPS刺激前后骨髓源性DCs和脾源性DCs CD11c+CD83+表達情況LPS刺激前,骨髓源性DCs CD11c+CD83+表達比例明顯高于脾源性DCs CD11c+CD83+表達比例(P<0.05);LPS刺激后,骨髓源性DCs和脾源性DCs CD11c+CD83+表達比例均明顯高于刺激前(P均<0.05),脾源性DCs CD11c+CD83+表達比例與骨髓源性DCs比較差異無統計學意義(P>0.05)。見表1及圖9、圖10。

表1 LPS刺激前后骨髓源性和脾源性DCs CD11c+CD83+表達情況

圖9 骨髓源性DCs LPS刺激前后CD11c+CD83+表達情況

圖10 脾源性DCs LPS刺激前后CD11c+CD83+表達情況
2.5LPS刺激前后骨髓源性DCs和脾源性DCs分泌IL-12情況LPS刺激前,骨髓源性DCs和脾源性DCs分泌IL-12量比較差異無統計學意義(P>0.05);LPS刺激后,骨髓源性DCs和脾源性DCs分泌IL-12量均明顯高于刺激前(P均<0.05),脾源性DCs分泌IL-12量與骨髓源性DCs分泌量比較差異無統計學意義(P>0.05)。見表2。
3 討 論
DCs是Steinman和Cohn于1973年發現的一群外形奇特、具有強大的活化初始T細胞能力的細胞,它是免疫反應的啟動者,具有很強的遷移能力。它起源于機體內的多功能造血干細胞,分為DCs前體細胞、未成熟DCs、成熟DCs 3個成長階段,一般來說未成熟DCs可以通過其TLR直接感知病原體組分(如LPS)而誘導成熟,表現為膜表面共刺激分子上調[7],分泌因子與趨化因子增加[8],抗原提呈能力增強[9],通過JAK/STAT通路使Th1、Th2細胞極化等[10]。研究發現LPS可通過提高iDC表面CD83、CD86的表達,分泌因子能力和刺激T細胞增殖能力的增強等來誘導iDCs的成熟[11],成熟后的DCs可以更有效地發揮免疫調節作用[12],但目前DCs尚無特定的表面分子標志及明確的生物學性能,需要結合細胞形態、生物學性能和表面特異性分子3個方面對DCs進行鑒別。

表2 LPS刺激前后骨髓源性和脾源性DCs分泌IL-12情況
人們已經能在體外用多種因子如GM-CSF、IL-4、IFN-α、Flt3配體、IL-10、IL-6、TPO和IL-13等誘導出純度較高及性能較好的DCs[13],但DCs的產量仍不能滿足當前DCs的實驗需要。面對目前DCs短缺的問題,本課題組對脾源性DCs展開了探索。結果顯示,經LPS誘導DCs成熟后,骨髓和脾臟均可獲得有明顯DCs生物學特性的細胞,純度均為80%以上,且脾源性DCs純度較高,形成的細胞集落也較大。FCM結果顯示LPS刺激前骨髓源性DCs的CD11c+CD83+表達比例明顯高于脾源性DCs 的CD11c+CD83+表達比例,CD83是DCs的表面特異性分子,一般來說低表達于未成熟DCs表面,高表達于成熟DCs表面,LPS是革蘭陰性菌的組成部分,它可以與DCs表面的TLR4結合并通過MyD88依賴性途徑或MyD88非依賴性途徑活化NF-κB分子,繼而介導誘導DCs的成熟[14],結果說明骨髓源性DCs早于后者成熟,與文獻[15]結果一致;LPS刺激后,骨髓源性DCs和脾源性DCs CD11c+CD83+的表達均增加,且脾源性DCs 的CD11c+CD83+表達比例與骨髓源性DCs比較差異無統計學意義,提示兩者經LPS刺激后CD11c+CD83+表達情況相似。ELISA結果顯示,骨髓源性DCs和脾源性DCs IL-12分泌量比較差異無統計學意義,提示兩者分泌IL-12的性能相似;經LPS刺激后,兩者分泌IL-12量均明顯升高,可能是經LPS誘導后DCs的轉錄因子IRF-3和NF-κB被激活[16],繼而分泌更多的IL-12來更好地發揮免疫調節作用,且脾源性DCs 分泌IL-12量與骨髓源性DCs比較差異無統計學意義,兩者DCs生物學特性相似。
實驗過程中發現尚有很多問題有待解決:①在脾源性DCs培養3~5 d時鏡下可見大量的暗色溶出物,筆者推測這部分溶出物可能是在因子選擇下大量的非DCs前體細胞裂解死亡,但未進行深入研究。②關于骨髓前體細胞和脾細胞的種板密度仍需要探討,筆者發現骨髓源性DCs生長后期密度過大,脾源性DCs生長后期密度過小。③由于時間原因,實驗中筆者未對所培養細胞進行MLR(刺激T淋巴細胞增殖實驗)和抗原吞噬能力檢測,關于其特性尚需進一步研究。④脾源性DCs產量僅為骨髓源性DCs的1/7左右,但其純度稍大于骨髓源性DCs,應當在脾源性DCs產量問題上進行深入研究,或許可以采取將脾源性DCs進行體外擴增再繼續誘導培養的方法,但尚不能明確是否可行。
[參考文獻]
[1]趙園園,張淑敏. 樹突狀細胞體外培養各階段作用因子研究進展[J]. 天津醫藥,2017,35(12):956-958
[2]劉俊峰,何志旭,沈冬,等. 小鼠骨髓樹突狀細胞體外擴增與培養[J]. 中華腫瘤防治雜志,2009,16(4):256-258
[3]王宏偉,陸江陽,覃家劍,等. 小鼠骨髓源性樹突狀細胞的體外誘導培養及功能分析[J]. 感染、炎癥、修復,2014,15(4):199-203
[4]翁霞,鄧曉輝,馬靜秋,等. 不同來源樹突狀細胞的培養研究[J]. 上海第二醫科大學學報,2004,24(5):331-333
[5]Ardavin C. Origin precursors and differentiation of mouse dendritic cells[J]. Nat Rev Immunol,2003,3(7):582-590
[6]Barillé-Nion S,Barlogie B,Bataille R,et al. Advances in biology and therapy of multiple myeloma[M]. Hematology Am Soc Hematol Educ Program,2003:248-278
[7]Parlato S,De Ninno A,Molfetta R,et al. 3D Microfluidic model for evaluating immunotherapy efficacy by tracking dendritic cell behaviour toward tumor cells[J]. Sci Rep,2017,7(1):1093
[8]Lyons-Cohen MR,Thomas SY,Cook DN,et al. Precision-cut Mouse Lung Slices to Visualize Live Pulmonary Dendritic Cells[J]. J Vis Exp,2017(122):55465
[9]龔非力,沈關心. 醫學免疫學[M]. 3版. 北京:科學出版社,2009:110-111
[10]ZhaoHM,XuR,HuangXY,etal.CurcuminsuppressedactivationofdendriticcellsviaJAK/STAT/SOCSsignalinmicewithexperimentalcolitis[J].FrontPharmacol,2016,7(455):1-9
[11] Maus RLG,Jakub JW,Nevala WK,et al. Human melanoma-derived extracellular vesicles regulate dendritic cell maturation[J]. Front Immunol,2017,8:358
[12] 王全楚, 馮志華, 周永興,等. 小鼠骨髓樹突狀細胞改良培養及體外生物學特性的比較[J]. 世界華人消化雜志,2003,11(2):219-223
[13] 顧春瑜,王前,鄭磊,等. 小鼠骨髓耐受性樹突狀細胞的體外培養與鑒定[J]. 第一軍醫大學學報,2005,25(8):959-962
[14] 楊洪艷,張義國,董子明,等. 小鼠骨髓和脾來源樹突狀細胞的分離與擴增培養[J]. 河南醫科大學學報,1999,34(1):19-22
[15] 李宗輝,黃軍華,劉俊峰,等. 小鼠脾臟來源樹突狀細胞的體外擴增培養[J]. 疑難病雜志,2009,8(9):520-521
[16] Hirsch I,Janovec V,Stranska R,et al. Cross talk between inhibitory immunereceptor tyrosine-based activation motif-signaling and toll-like receptor pathways in macrophages and dendritic cells[J]. Front Immunol, 2017,8(10):394

