紅托竹蓀腐爛病初探*
盧穎穎,桂 陽,陳婭婭,曾令祥,朱國勝**
(1.貴州省農業科學院貴州省農作物品種資源研究所,貴州 貴陽 550006;2.貴州省農業科學院貴州省現代農業發展研究所,貴州 貴陽 550006)
紅托竹蓀(Dictyophora rubrovolvataM.Zang,et al.)隸屬于擔子菌門(Basidiomycota)腹菌綱(Gasteromycetes) 鬼筆目 (Phallales) 鬼筆科 (Phallaceae) 竹蓀屬(Dictyophora)。紅托竹蓀是竹蓀中的珍品,藥食兩用真菌,具有很好的開發前景[1]。紅托竹蓀在貴州的人工種植面積日益增加,近年來紅托竹蓀腐爛病病害普遍發生,對紅托竹蓀產量造成嚴重的影響。筆者通過對貴州紅托竹蓀的幾個主栽地區發生病害的種植大棚調查發現,其典型癥狀是初期形成水漬狀斑點,后期整個菌蛋腐爛不能正常出菇或形成畸形菇,一旦發病,整個大棚都會發病,減產甚至絕收,給紅托竹蓀生產造成很大的損失。
目前已報道的食用菌腐爛病多數是細菌性病害或真菌性病害,如糙皮側耳褐腐病,據其不同發病類型其病原菌有菌蓋疣孢霉(Mycogone perniciosaMagn.)、銅綠假單胞菌(Pseudomonas aeruginosaMigula)、樹枝狀輪指孢霉 (Dactylium dendroides)和半裸鏈孢霉(Fusarium semitectum);金針菇黑腐病其病原菌為托拉氏假單胞菌(Pseudomonas tolaasii);刺芹側耳軟腐病其病原菌為歐文氏菌屬(Erwiniasp.)[4-6]。針對紅托竹蓀腐爛病國內許多專家進行了許多有價值的研究和探討[1-3],主要集中在研究引起該病的病原菌、蟲害、病害等方面,但尚未明確引起該病的具體原因。為明確紅托竹蓀腐爛病發病原因,筆者在貴州省織金縣和黔西南州安龍縣的紅托竹蓀生產基地,對紅托竹蓀腐爛病的發病程度和發病規律進行調查,同時采集病害樣本,對該病害進行發病原因的初步分析,研究結果如下。
1 材料與方法
1.1 病害情況調查
貴州省織金縣和黔西南州安龍縣皆為我國紅托竹蓀主產區,也是紅托竹蓀的傳統種植區。菌蛋期指竹蓀生長初期未成熟的時期。
病癥:病害一般從菌蛋開始感染,初期菌蛋表面出現黃色至淡紅色的水珠;中期菌蛋基部便出現針眼狀的孔,繼而開始腐爛;后期出現感染其他雜菌的現象,如綠霉等。如果尖頂期菌蛋發病,仍可出菇開傘,畸形或部分腐爛。
1.2 樣本采集
從貴州省農作物品種資源研究所實驗菇房、黔西南布依族苗族自治州安龍縣龍廣鎮小場壩村農望種植農民專業合作社紅托竹蓀種植大棚、織金縣紅托竹蓀種植大棚分別采集了3組帶有水漬斑點的子實體樣本,至實驗室進行病原菌研究。
1.3 疑似病原物的分離和觀察
1.3.1疑似病原物分離培養
(1)病斑處細菌的分離
在采集的3組樣品中每組取3個患病子實體,在病斑處進行細菌分離。用75%的酒精棉球,擦拭菌蛋表面進行消毒,把菌蛋沿病斑邊緣掰開,將表皮組織用滅菌的鑷子和解剖刀移除,然后分別鉤取約6 mm2的病變膠質組織和內部組織(尚未分離開的菌柄和菌蓋組織),置于裝有500μL滅菌水的EP管(離心管)中,用滅菌的玻璃棒將組織研碎混勻,放置10 min,使用滅菌的接種環蘸取混合液在牛肉蛋白胨培養基上劃線接種,25℃恒溫培養。
(2) 病斑處真菌的分離
在采集的3組樣品中每組取3個患病子實體,在病斑處進行細菌分離。用滅過菌的接種鉤,挑取菌蛋病斑處的附生真菌菌絲,置于PDA平板培養基上,25℃培養,觀察菌落的生長情況。
1.3.2顯微鏡觀察
在采集的3組樣品中每組取3個患病子實體,分別取病變組織和未病變組織進行顯微觀察;在顯微鏡100×物鏡視野下觀察組織形態特征;將組織切片放在載玻片上加1滴水,蓋蓋玻片輕按,在顯微鏡40×物鏡下檢查是否有細菌渾濁液;將組織切片移走,渾濁液通過酒精燈火焰固定,革蘭氏染色法觀察。
1.4 分子鑒定
挑取純化后的細菌菌體,離心后置于離心管中,加入裂解液,震蕩后置于65℃中溫浴裂解,提取DNA,使用通用引物SR/SF擴增16S rDNA片段。PCR反應體系為30μL,其中10×PCR緩沖液3μL,dNTP(10mM) 3μL,正向和反向引物(100mmol·L-1)各1.5μL,TapDNA聚合酶1.2μL,模板DNA 3μL。PCR反應程序為94℃預變性300 s;94℃變性30 s,52℃退火 45 s,72℃延伸 60 s,33 個循環;72℃延伸600 s。利用1%瓊脂糖凝膠電泳檢測PCR產物。PCR產物由上海英駿生物技術有限公司測序。利用16S rDNA的通用擴增引物[7](SF:5’-A GAGTTTGATCCTGGCTCAG-3’,SR:5’-GGTTAC CTTGTTACGACTT-3’) 進行PCR擴增。
將測得的序列進行編輯,去掉序列兩端的引物,拼接后獲得16S rDNA序列。利用ClustalX軟件對獲得的16S rDNA序列進行比對,序列相似比在99%以上的菌株分為一組。取每組的16S rDNA序列與NCBI數據庫進行BLAST比對,同源性較高(至少相似比在90%以上)的菌株作為參照對象,利用軟件Mega7鄰接法(Neighbor Joining) 構建系統發育樹。
1.5 疑似病原物致病性檢測
以紅托竹蓀常規栽培種作為樣本,選取疑似病原物的優勢菌株進行致病性檢測。用接種針挑取少許純化的優勢菌株,直接穿刺在直徑4 cm~5 cm健康菌蛋表面接種,每個優勢菌株接種5個竹蓀蛋。培育溫度在28℃~30℃,環境濕度保持在90%以下,常規管理,觀察發病情況。
2 結果與分析
2.1 發病情況
通過研究發現,在安龍縣和織金縣調查的3個菇棚中,腐爛病病害的發病率達到60%~80%。該病害主要發生在7月~9月,發病期菇棚內的溫度在32℃~35℃。病斑產生在菌蛋表面,起初為淡黃色水珠,水珠消失留下水印,后期各種雜菌感染逐漸腐爛。
2.2 發病特征
紅托竹蓀栽培過程中,腐爛病多發生在菌蛋期,發病初期,其癥狀為菌蛋菌皮表面有淡紅色水漬狀斑點,可看到斑點上凝結小水珠,中期水珠消失,水漬狀斑點變大至直徑為0.5 cm~2 cm,斑點顏色變為暗紅色,后期斑點處可看到感染各種雜菌,出現白色或綠色菌斑。球形期的菌蛋發病,最終整個菌蛋腐爛而不能正常出菇,尖頂期發病的菌蛋仍可出菇,但菇體部分腐爛或為畸形菇。如圖1所示。

圖1 紅托竹蓀腐爛病癥狀Fig.1 Typical symptoms of the Dictyophora rubrovolvata rot disease
2.3 顯微鏡觀察結果
顯微鏡觀察病斑組織成絮狀,且菌皮下的發病膠質層組織有解體腐爛的現象。病斑組織切片,在顯微鏡低倍視野下,可以看到有渾濁的細菌液,革蘭氏染色發現,存在革蘭氏陽性和革蘭氏陰性細菌菌體。
2.4 病變組織塊分離結果
分離培養的病變組織為菌蛋的膠狀層,從外觀看病變膠質層組織已經出現組織解體現象,用接種鉤在無菌操作下鉤取病變膠質層組織至PDA培養基上培養,24 h后發現有細菌菌落生長,2 d后仍未發現病變組織萌發。用接種環蘸取少量細菌菌體至LB培養基上,劃線涂布培養獲得單菌落,菌落形態與吸取的病斑上水珠培養的細菌菌落形態及病變菌皮培養獲得細菌菌落形態一致。
2.5 附生菌株初步鑒定
在所采集的3組樣品中,通過培養觀察挑取了13個優勢菌株,利用引物SR/SF擴增16S rDNA片段大約為0.7 kb~1.5 kb。利用軟件MEGA中Align方法對測序序列進行比對分析,采用MEGA軟件對比對結果進行聚類分析見圖2。
圖2 序列比對結果Fig.2 Sequence comparison results
根據聚類結果分別挑選序列1-S、J1、T12、2-B、B11、J21、B12、J11在NCBI網站上進行Blast比對,根據比對結果選擇相似值達到99%以上的模式菌株序列,模式菌株序列號分別為:KT291174、KY681833、KX822678、 KY780237、 LN564012、GQ306158、KY753321和KX131107。利用軟件MegAlign中ClustalW方法對所獲得序列進行比對、聚類分析,利用軟件Mega7.0構建系統發育樹,如圖3所示。
從圖3可看出,所分離的疑似病原菌菌株主要與芽孢桿菌屬 (Bacillussp.,KT291174、KY753321)細菌、腸桿菌屬(Enterobactersp.,KY681833) 細菌和伯克霍爾德菌屬(Burkholderiasp.,GQ306158)細菌相類似,可基本確定所分離出的優勢細菌主要屬于這三類細菌。這三個屬的細菌為自然界土壤、空氣、水等環境中普遍存在的細菌。
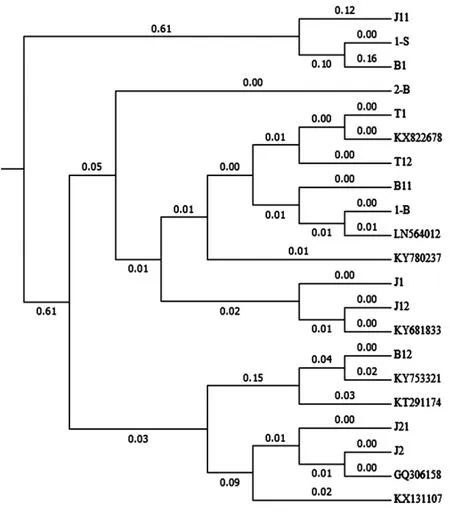
圖3 分離菌株與NCBI數據庫中模式菌株比對結果Fig.3 Comparison results of isolated strainswithmodel strains in NCBIdatabase
通過對所分離出的13個細菌進行革蘭氏染色,發現上述三類細菌的3個代表菌株B11、J2、B1分別屬于革蘭氏陰性菌(腸桿菌屬Enterobactersp.)、革蘭氏陽性菌(芽孢桿菌屬Bacillussp.)和革蘭氏陰性菌(伯克霍爾德菌屬Burkholderiasp.)。
2.6 致病性檢測結果
疑似病原物致病性檢測,通過回接試驗共接種了B1、J2等13個疑似病原菌,觀察均未發現水漬狀斑點。
3 討論
紅托竹蓀腐爛病主要對子實體的外觀和產量造成嚴重影響,導致紅托竹蓀收益損失嚴重。本課題研究主要從安龍縣、織金縣的種植大棚以及貴陽的出菇大棚采集患病菌蛋樣本,通過顯微觀察和分離培養水漬狀病變組織內的細菌,分離到的優勢菌在回接試驗中均未表現出致病性。
紅托竹蓀大棚栽培一般是在7月~9月份出菇,該病害主要發生在出菇期,且為大棚出菇病害,林下或仿野生種植并不發生此病害,大棚種植在夏季易形成高溫、高濕環境,初步推斷紅托竹蓀腐爛病癥狀的發生與出菇時溫度、濕度有關,還需進一步研究驗證。
杏鮑菇細菌性病害,在病斑處產生膿液。平菇和雙孢蘑菇細菌性褐斑病等細菌性病害,在潮濕情況下,子實體的病斑處均有細菌膿液產生,且伴有難聞氣味。在紅托竹蓀腐爛病菌蛋表面的水漬狀斑點形成和發展過程中,斑點表面未發現明顯的細菌性膿液。且取水漬狀斑點表皮組織進行培養,在PDA培養基上可以正常萌發,其菌絲形態與正常子實體組織的菌絲形態無明顯差異,說明水漬狀病變組織未發生壞死。
真菌菌絲細胞壁表面的疏水蛋白(hydrophobin)可利用其疏水作用來維持子實體內的空氣通道(air channels) 和菌絲間空隙[9-13]。文獻報道裂褶菌(Schizophyllum commune) 的疏水蛋白基因sc4被敲除后,可引起裂褶菌子實體的空氣通道充水而呈水漬狀[11];脈孢菌(Neurospora crassa)、構巢曲霉(Aspergillus nidulans) 和稻瘟病菌 (Magnaporthe grisea) 的疏水蛋白基因 Eas[15]、rodA[14]和 Mpg[13]被敲除后,均導致分生孢子囊或氣生菌絲呈現水漬狀[8-15]。紅托竹蓀腐爛病的水漬狀斑點的表征與敲除掉疏水蛋白基因的癥狀類似,該病的發生可能與疏水蛋白基因的調控表達有關。需進一步深入研究紅托竹蓀腐爛病水漬狀斑點的形成與紅托竹蓀子實體疏水蛋白基因表達調控規律的關系。
本研究尚未對該病害進行原生生物和病毒等相關研究,暫不能確定紅托竹蓀腐爛病與原生生物和病毒的關系。
參考文獻:
[1]潘高潮,龍漢武,吳迪,等.貴州省紅托竹蓀菌蛋爛皮病的發生與防治[J].中國食用菌,2015,34(5):72-75.
[2]桑維鈞,張穎,柴儒東,等.竹蓀球大面積腐爛原因分析及防治對策初探[J].食用菌,2000(5):40-41.
[3]桑維鈞,宋寶安,練啟仙,等.竹蓀球腐爛致病真菌種類鑒定與藥劑篩選 [J].西南農業大學學報:自然科學版,2006,28(2):302-304.
[4]支月娥,黃建春,汪毅,等.杏鮑菇細菌性病害病原菌研究[J].食用菌,2009,31(2):23-24.
[5]張瑞穎,胡丹丹,左雪梅,等.平菇和雙孢蘑菇細菌性褐斑病研究進展[J].植物保護學報,2007,34(5):549-554.
[6]張瑞穎,左雪梅,姜瑞波.平菇褐斑病病原菌的分離與鑒定[J].中國食用菌,2007,26(5):58-60.
[7]Stackebrandt E,Goodfellow M.Nucleic acid techniques in bacterial system atics[M].New York:John Wiley and Sons,1991:115-175.
[8]張瑞穎,胡丹丹,左雪梅,等.白靈側耳水漬狀斑點病初探[J].食用菌學報,2012,19(2):106-110.
[9]Lugones LG,Wsten HAB,Birkenkamp KU,et al.Hydrophobins line air channels in fruiting bodies ofSchizophyllum communeandAgaricus bisporus[J].Mycol Res,1999,103(5):635-640.
[10]Lugones LG,Bosscher JS,Schol-tmeyerk,etal.An abundant hydrophobin(ABH1)forms hydrophobic rodlet layers inA-garicus bisporusfruiting bodies[J].Microbiology,1996,142(5):1321-1329.
[11]Van Wetter M-A,Wsten HAB,Wessels JGH.SC3 and SC4 hydrophobins havedistinct roles in formation of aerial structures in dikaryons ofSchizophyllum commune[J].Molecular Microbiol,2000,36(1):201-210.
[12]Banerjee G,Robertson DL,Leonard TJ.Hydrophobins Sc3 and Sc4 gene expression in mounds,fruiting bodies and vegetative hyphae ofSchizophyllum commune[J].Fungal Gen Biol,2008,45(3):171-179.
[13]Talbot NJ,Ebbole DJ,Hamer JE.Identification and characterization of MPG1,a gene involved in pathogenicity from the rice blast fungusMagnaporthe grisea[J].The Plant Cell Online,1993,5(11):1575-1590.
[14]Stringer MA,Dean RA,Sewall TC,et al.Rodletless,a newAspergillusdevelopmentalmutant induced by directed gene inactivation[J].Genes Dev,1991,5(7):1161-1171.
[15]Bell-Pedersen D,Dunlap JC,Loros JJ.The Neurospora circadian clock-comtrolled gene,ccg-2,is allelic to eas and encodes a fungal hydrophobin required for formation of the conidial rodlet layer[J].Genes Dev,1992,6(12):2382-2394.

