RANK-RANKL在2型糖尿病腎病大鼠腎臟表達的研究
劉素芳,劉麗秋,楊鵬鵬
(青島大學附屬醫院 腎內科,山東 青島266003)
如今,糖尿病的發病率伴隨著人們生活水平的改善正日益增高,糖尿病腎病(DK)作為糖尿病嚴重的微血管并發癥,其發病率也逐年攀升,成為糖尿病患者的主要死亡原因之一。NF-κB受體活化因子(RANK)及其配基RANKL是破骨細胞分化發育的關鍵作用因子[1-5],近年來研究發現其在表達于糖尿病和多種腎臟疾病[6,7],而在早期2型糖尿病腎病中的表達研究較少。本研究建立2型糖尿病腎病大鼠模型,觀察腎臟中RANK、RANKL的表達,探討其在糖尿病腎病發病中的作用。
1 材料與方法
1.1動物與試劑
SPF級8周齡雄性Wista大鼠40只,體重(180±20)g,購于山東魯抗實驗動物中心(許可證號SCXK(魯)20130001)。鏈脲佐菌素( Streptozocin,STZ) (美國Sigma 公司)。兔抗鼠RANK、RANKL(美國Santa Cruz 公司);山羊抗兔多克隆抗體(北京中杉金橋);Trizol(日本Takara公司);ACCU-CHEK血糖儀、反轉錄試劑盒、熒光定量PCR試劑盒(上海羅氏),血清胰島素(INS)ELISA試劑盒(武漢博士德)。
1.2模型建立和分組
動物飼養的溫度控制在24-26℃,濕度65%,12 h交替照明。大鼠自由飲水、進食。大鼠適應性喂養5天后隨機分為正常對照組(NC組,n=18)和模型組(DM組,n=22),NC組給予常規飼料喂養。DM組給予高糖高脂飲食(常規飼料66.5%加20%蔗糖、10%豬油、2.5%膽固醇、1%膽酸鹽)喂養8周后,DM組禁食12 h,空腹狀態下STZ 30 mg/kg一次性腹腔注射,NC組僅注射等量枸櫞酸緩沖液。DM組注射STZ一周后,內眥靜脈取血測定空腹血糖(FPG)及空腹胰島素(INS),并計算胰島素敏感指數ISI[ISI=22.5/(FPG×INS),HOMA法]。FPG大于該實驗正常大鼠空腹血糖均值+3個標準差(≥10.0 mmol/L)及胰島素敏感指數≤正常動物均值(即胰島素抵抗),即為T2DM模型建立成功,納入實驗組。STZ注射2周后用代謝籠收集兩組大鼠24小時尿液,檢測24小時尿微量白蛋白。經統計學分析證明DM組大鼠24 h尿微量白蛋白定量較NC組高,說明糖尿病腎病DK動物模型制備成功(共18只)。
1.3觀察指標和檢測方法
1.3.1標本收集 給藥后4、8、12周末分別用代謝籠收集大鼠24 h尿液,測尿量,稱體重,用10%水合氯醛麻醉后腹主動脈取血,4℃離心,取上層血清存于-80℃冰箱中待測生化指標;取左腎,剪成1 mm腎皮質以2.5%戊二醛固定用于電鏡檢測;取部分腎組織放于10%中性甲醛固定用于免疫組化;取右腎稱重后速凍于液氮中,凍透后轉入-80℃冰箱中待行Western-blot檢測。
1.3.2血、尿生化指標檢測 利用日本日立公司的7020生化分析儀檢測空腹血糖(FPG)、血肌酐(Scr)、總膽固醇(TC)、血甘油三酯(TG)、24小時尿白蛋白定量(UAL)。血清胰島素的檢測按照試劑盒說明書操作,采用ELISA法檢測。
1.3.3腎臟病理檢查 光鏡行HE染色放大200倍觀察腎臟病理變化。
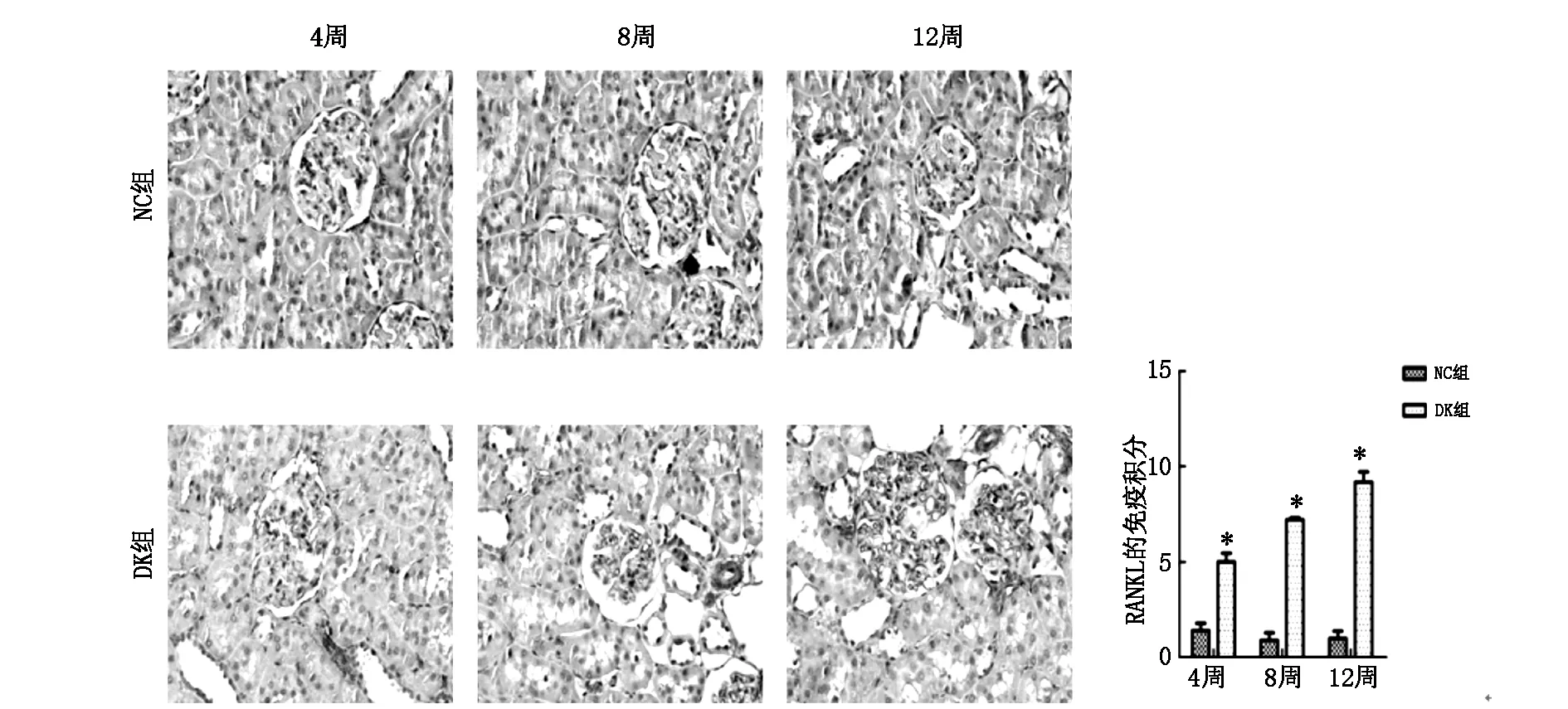
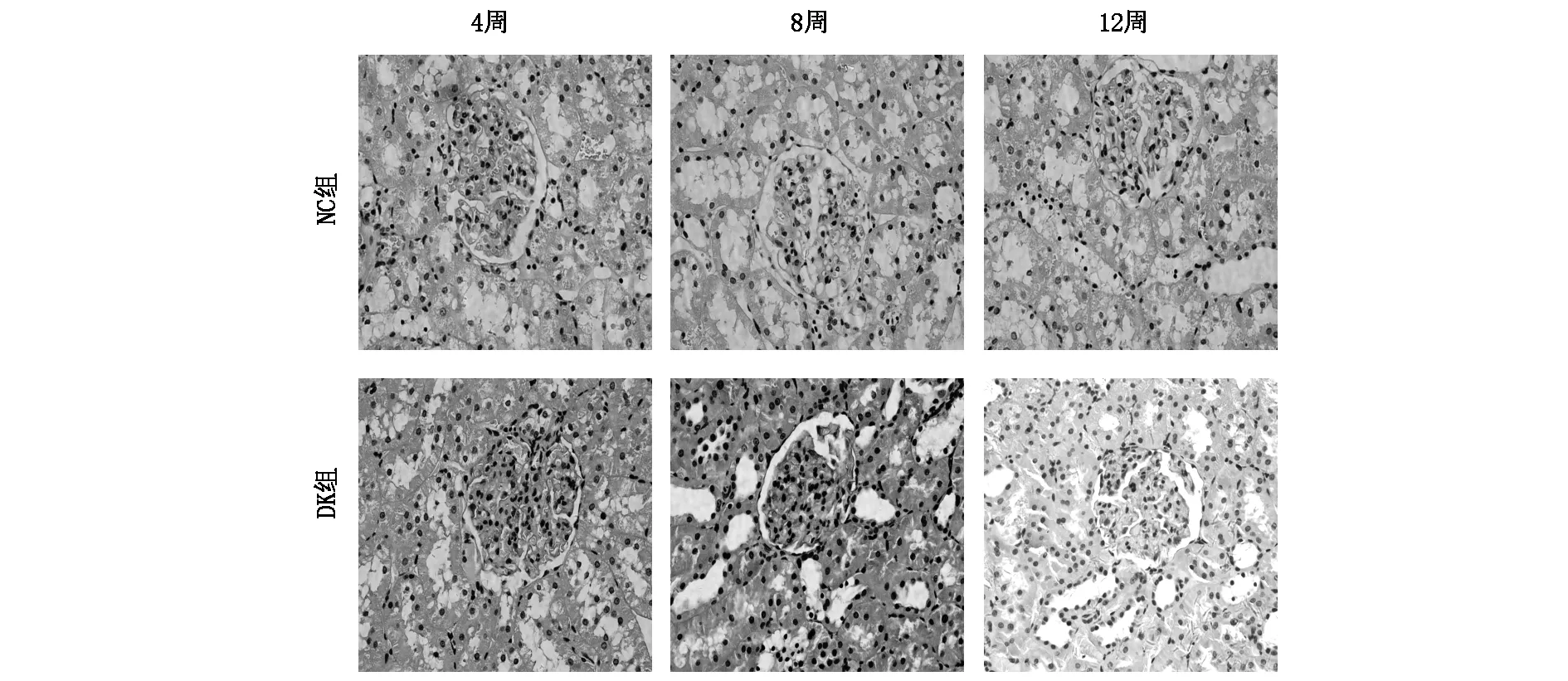
1.3.4免疫組化染色 操作步驟按試劑盒說明書進行。一抗為RANK、RANKL多克隆抗體(均1∶200稀釋比)。實驗結果用Image pro Plus 5.7圖像分析軟件對所選取視野中免疫組織化學陽性信號進行圖像分析,光鏡下每張切片隨機選擇5個視野,計算陽性細胞百分率(R)評分A(R<1%為0分,1%≤R≤10%為1分,10% 1.3.5Western 印跡法測蛋白 取凍存腎皮質約150 mg,用BCA法測蛋白濃度,與5×上樣緩沖液混合煮沸5 rain后電泳。各泳道分別加彩色預染Marker及樣品蛋白進行SDS、PAGE電泳、轉膜、封閉后分別加入待測多克隆抗體,過夜、洗膜,加二抗孵育2 h。用Odyssey雙色紅外激光成像系統掃描,掃描結果用GISl0分析軟件將圖片上每個特異條帶灰度值數據化,進行半定量分析。 2.1各組大鼠一般情況 實驗組大鼠于造模三天后出現多飲、多食、多尿癥狀,常有腹泄,毛發干枯發黃。實驗過程中,隨時間的推移,體重明顯減輕,活動量減少,精神萎靡。正常對照組大鼠皮毛光滑,毛色正常,體重隨周齡增加而增加,血糖值穩定于正常水平,精神佳,飲食、飲水正常,尿淡黃色,大便顆粒狀。 2.2大鼠模型的建立 大鼠高糖高脂喂養8周后,DM組FPG和INS即高于NC組,ISI顯著降低,表明存在胰島素抵抗。STZ注射2周后,DM組FPG升高更加顯著,已達到糖尿病標準,INS仍高于NC組,同時24小時尿微量白蛋白定量升高(P<0.05),表明2型糖尿病腎病動物模型制備成功(見表1)。 表1 不同時間各組大鼠血糖、胰島素的比較表 注:與對照組相比,*P<0.01,aP<0.05 2.3各組大鼠生化指標的比較 與NC組大鼠相比較,DK組大鼠FPG、UAL在造模4W、8W、12W末時均明顯升高 (均P<0.01),而Scr、TG、TG在4W時開始升高(P<0.05),8W、12 W時均顯著升高,差異有統計學意義(均P<0.01);NC組大鼠上述指標在4W、8W、12 W末時無明顯變化(P>0.05),而DK組上述指標在8W、12 W末較4W末存在明顯差異,差異具有統計學意義(均P<0.01)(見表2)。 表2 不同時間各組大鼠指標的比較 注:同時間與對照組比較*P<0.01,#P<0.05;各組內與4周末比較aP<0.01,bP>0.05 2.4各組大鼠腎臟病理形態學觀察 HE染色結果發現,與NC組相比,DK組的腎臟病理變化在4W時不明顯,8W時,DK組腎小球體積增大,系膜區面積增寬,局灶性的系膜基質增加。12周時DK上述變化更加明顯,腎小球基底膜增厚,腎小囊腔明顯狹小,可見輕微腎小球硬化(見圖1)。 圖1 各組大鼠腎組織4周、8周和12周的病理變化 (HE×200) 2.5不同時間各組大鼠腎組織免疫組化和Westen-blot表達的比較 免疫組化可見RANK、RANKL在NC組大鼠腎臟極少表達,與NC組相比,DK組腎小球中RANK、RANKL陽性表達在4W時開始升高,8W、12W時增高更加顯著,且RANK、RANKL主要表達于腎小球足細胞、血管內皮細胞,腎間質存在少量表達;DK組其RANK、RANKL表達在4W、8W、12W逐漸升高(見圖2、3)。Westen-blot結果與免疫組化的變化趨勢一致(見圖4)。 2.6相關分析結果 相關分析結果顯示RANK的免疫組化表達積分與血糖、尿蛋白的表達水平呈明顯正相關,r分別為0.80、0.84,均P<0.01。 隨著糖尿病的發病率逐年提高,其微血管并發癥之一糖尿病腎病(DK)已成為終末期腎病(ESRD)的重要原因,嚴重危害人類健康。DK以持續性蛋白尿為主要臨床表現,隨著病情的進展和尿蛋白量的增加,腎功能逐漸惡化,晚期可發展為腎小球硬化和腎臟纖維化[8,9]。臨床上糖尿病腎病的發病以2型多見,故本實驗采用高糖高脂喂養加STZ注射法建立2型糖尿病腎病動物模型[10,11],實驗中觀察到模型組大鼠高糖高脂喂養8周時血糖開始升高,出現胰島素抵抗。STZ注射2周后,模型組血糖及胰島素水平較對照組明顯升高,并出現蛋白尿。病理可見腎小球系膜基質增多,基底膜較對照組明顯增厚,可見輕微腎小球硬化,證實這些大鼠DN模型已制作成功。 圖2 不同時間各組大鼠腎臟組織RANK的表達(免疫組化×200) 圖3 不同時間各組大鼠腎臟組織RANKL的表達(免疫組化×200) 圖4 不同時間各組大鼠腎組織RANK、RANKL的蛋白表達(Western印記) RANK(NF-κB受體活化因子)及其配基RANKL作為TNF受體超家族成員之一,最初是在破骨細胞研究中被發現的,被證實為破骨細胞分化發育的關鍵作用因子[1-5]。既往的研究主要集中在骨系統疾病,近年來人們研究發現RANK/RANKL廣泛表達于各種組織和細胞,并參與多種疾病的發生發展[12-14]。國外學者研究發現血清可溶性RANKL濃度升高可以反映人類2型糖尿病的發病程度,通過下調小鼠肝細胞RANKL的表達和敲除小鼠RANK基因,可以明顯改善胰島素抵抗及血糖水平[14]。另外有學者研究發現RANK/RANKL在正常足細胞上表達水平較低,在IgA腎病等人類腎小球疾病中表達明顯增加,且主要表達于足細胞[6,7];嘌呤霉素氨基核苷及5/6切除腎鼠均可誘導足細胞產生RANK及RANKL,并誘導足細胞凋亡[15,16]。而RANK/RANKL在糖尿病腎病發病過程中的表達和作用,目前研究較少。 本實驗建立2型糖尿病腎病動物模型,免疫組化和western印跡觀察到對照組大鼠腎組織中RANK、RANKL表達量極少,與對照組相比,模型組大鼠腎臟中RANK及RANKL表達在4周、8周、12周時均顯著升高,隨著時間的推移其陽性表達明顯增多,且主要表達于腎小球足細胞和血管內皮細胞,腎間質存在少許表達。另外觀察到模型組蛋白尿明顯增多,腎小球出現輕微硬化,表明發生了足細胞的損傷。RANK/RANKL基因表達可以增加肝臟胰島素抵抗和升高血糖[14],本研究觀察到模型組腎臟中RANK/RANKL表達明顯增強,血糖和胰島素抵抗較對照組明顯升高,相關分析發現RANK表達與血糖的水平呈明顯正相關,由此我們猜測腎臟中RANK/RANKL表達可能對胰島素抵抗和血糖的升高存在一定作用。相關分析發現RANK表達量與尿蛋白水平呈明顯正相關,提示RANK高表達可能導致蛋白尿的一個重要因素。 本實驗發現糖尿病腎病大鼠腎臟中RANK/RANKL的表達增加,加重了糖尿病腎病蛋白尿的產生和血糖的升高,可能參與了2型糖尿病腎臟早期的發病過程,為糖尿病腎病的發病機制和治療找到了新的方向。 參考文獻: [1]Dougall WC,Glaccum M,Charrier K,et al.RANK is essential for osteoclast and lymph node development[J].Genes,1999,13(18):2412. [2]Kong YY,Yoshida H,Sarosi I,et al.OPGL is a key regulator of osteoclastogenesis,lymphocyte development and lymph-node organogenesis[J].Nature,1999,397(6717):315. [3]Dougall WC,Glaccum M,Charrier K,et al.RANK is essential for osteoclast and lymph node development[J].Genes,1999,13(18):2412. [4]Bucay N,Sarosi I,Dunstan CR,et al.Osteoprotegerin-deficient mice develop early onsetosteoporosis and arterial calcification[J].Genes,1998,12(9):1260. [5]Tat SK,Pelletier JP,Lajeunesse D,et al.Differential modulation ofRANKL isoforms by human osteoarthritic subchondral boneosteoblasts:influence of osteotropic factors[J].Bone,2008,43(2):284. [6]劉雙信,王文建,夏運風,et al.Receptor activator of NF-kappaB and its ligand is a novel raceptor-ligand complex for survival response during podocytes injury[J].中華醫學會腎臟病學分會2011學術年會,2011:165. [7]Liu S S,Shi W,Xiao H,et al.Receptor activator of NF-kappaB and podocytes:towards a function of a novel receptor-ligand pair in the survival response of podocyte injury[J].PLoS One,2012,7(7):p.e41331. [8]Reddy GR,Kotlyarevska K,Ransom RF,et al.The podocyte and diabetes mellitus:Is the podocyte the key to the origins of diabetic nephropathy?[J].Current opinion in nephrology and hypertension,2008,17(1):32. [9]Bedi S,Vidyasagar A,Djamali A.Epithelial-to-mesenchymal transition and chronic allograft tubulointerstitial fibrosis[J].Transplantation reviews,2008,22(1):1. [10]李玉山,劉麗秋.實驗性2型糖尿病腎病大鼠模型研究[J].中國實驗診斷學,2009,13(5):574. [11]馬瑞霞,劉雪梅,劉麗秋等.雷公藤甲素對2型糖尿病大鼠腎組織足細胞Nephrin、Podocin蛋白表達的影響及機制[J].中華糖尿病雜志,2010.02(4):291. [12]TsubakiM,Komai M,Fujimoto S,et al.Activation of NF-kappaB by the RANKL/RANK system up-regulates snail and twist expressions and induces epithelial-to-mesenchymal transition in mammary tumor cell lines[J].J Exp Clin Cancer Res,2013,32:62. [13]HessE,Duheron V,Decossas M,et al.RANKL induces organized lymph node growth by stromal cell proliferation[J].J Immunol,2012,188(3):1245. [14]Kiechl S,Wittmann J,Giaccari A,et al.Blockade of receptor activator of nuclear factor-kappaB (RANKL) signaling improves hepatic insulin resistance and prevents development of diabetes mellitus[J].Nat Med,2013,19(3):358. [15]馮仲林,劉雙信,史 偉,等.嘌呤霉素氨基核苷腎病腎臟中RANK-RANKL的表達[J].南方醫科大學學報,2014,(1):65. [16]劉雙信,史 偉,梁磬苓,等.核因子κB受體活化因子及其配體在5/6腎切除大鼠腎臟中表達及纈沙坦對其影響[J].中華腎臟病雜志,2006,22(7):421.
2 結果
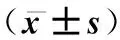
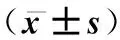
3 討論