中藥健脾方對糖尿病大鼠腎組織骨橋蛋白及腎臟病理的影響
邢艷陽,李中南,邢宇婷,竇德梅
(1.安徽中醫藥大學,合肥 230038;2.安徽中醫藥大學第一附屬醫院)
糖尿病腎病(DKD)是糖尿病(DM)常見的嚴重慢性并發癥之一,20%~40%的糖尿病患者發展成慢性腎臟病,是糖尿病患者腎衰竭的主要原因[1]。骨橋蛋白(OPN)是一種具有細胞粘附和遷移功能的分泌型磷酸化糖蛋白,可作為腎小管間質的一種重要趨化因子,通過介導該部位的巨噬細胞浸潤、蛋白尿漏出、腎小球硬化等機制促進DKD的發生與發展[2]。降低糖尿病腎病骨橋蛋白的表達,抑制巨噬細胞驅化,改善早期腎臟病變程度,是延緩糖尿病腎損害的一個新途徑[3]。本次實驗旨在研究中藥健脾方對糖尿病大鼠腎組織OPN的表達及對腎臟病理的影響,分析討論健脾活血中藥對腎臟的調節機制。
1 材料與方法
1.1 實驗材料
1.1.1 實驗動物 取正常雄性大鼠50只,體質量(190±20)g,由安徽醫科大學動物實驗中心供應,合格證號:0001841。飼養房空氣流通,溫度維持在18~25 ℃,相對濕度保持在40%~70%,動物自由進食和飲水,適應性飼養1周。
1.1.2 藥物與試劑 中藥健脾方由黃芪20 g、山藥15 g、白術10 g、茯苓10 g、生地10 g、丹參15 g、菝葜15 g、地龍10 g、五味子5 g、黃連10 g組成,飲片由安徽中醫藥大學第一附屬醫院中藥房提供;鹽酸吡咯列酮(杭州中美華東制藥有限公司生產,批號:H20050500);鏈脲佐菌素(STZ)(購自美國Sigma公司,批號:S0130);水合氯醛(青島宇龍海藻有限公司生產,批號:H3702673);通用型二抗試劑盒(購自北京中杉金橋生物技術有限公司,批號:131208K)。
1.1.3 主要儀器與設備 血糖監測儀(美國強生公司,型號:穩豪型);JD801形態學圖像分析系統(江蘇省捷達科技發展有限公司);全自動生化儀(日本株式會社,型號:日立 7600)。
1.2 實驗干預與分組 將50只健康雄性大鼠予基礎飼料(蛋白質16%,碳水化合物50%,脂肪8%)飼喂1周,隨機抽取10只作為健康對照組,其余大鼠作實驗組。對照組予基礎飼料飼喂至本實驗終止;實驗組予高脂飼料(其中蛋白質15%,脂肪25%,碳水化合物45%,膽固醇5%,豬油10%)喂養,4周后造模,禁食8 h后,將STZ用0.1 mol/L的檸檬酸-檸檬酸鈉緩沖液(pH值為4.4)配成2%濃度,按35 mg/kg劑量于大鼠左下腹一次性腹腔注射,120 h后取鼠尾靜脈測血糖,血糖≥16.7 mmol/L視為造模成功。將造模失敗的5只大鼠剔去,成模的45只大鼠隨機分成模型組11只,中藥組12只,吡格列酮組12只。按人與鼠的單位體質量折算系數算出各組的藥用劑量,其中中藥組按3 g·kg-1·d-1予健脾方灌胃,吡格列酮組按10 mg·kg-1·d-1灌胃,健康對照組和模型組按5 mL·kg-1·d-1予0.9%氯化鈉溶液灌胃,各組持續飼喂8周直至本實驗完成。
1.3 指標檢測與方法 連續灌胃,分別在第2、4周末測定各組大鼠血糖并記錄,8周末測定血糖及血脂[低密度脂蛋白-膽固醇(LDL-C)、三酰甘油(TG)、總膽固醇(TC)],禁食不禁水8 h,再以3%水合氯醛按10 mg/kg給大鼠腹腔注射麻醉,迅速分離雙腎,將新鮮組織放在凍存管內,并保存于液氮中,按免疫組織化學法操作標準完成。采取JD801形態分析系統分析腎組織OPN的表達圖,以陽性面積及平均吸光度來表示OPN的表達強度。高倍鏡(×400)下觀察并記錄切片中腎組織不重疊視野下的陽性細胞數。病理切片采取HE染色法,光鏡下觀察并比較腎組織病理學變化程度。
2 結果
實驗期間模型組、吡格列酮組、中藥組因血糖過高各死亡1只,兩藥物組因大鼠打斗各死亡1只。
2.1 各組大鼠腎組織OPN的比較 高倍鏡觀察顯示:正常組大鼠OPN在腎組織中未見明顯表達;模型組OPN的表達較正常組顯著升高,多呈強陽性,尤其以腎小管與腎間質細胞中較明顯;與模型組對比,中藥組、吡格列酮組大鼠腎組織中OPN的表達有不同程度的下降,多呈弱陽性,差異較為明顯。
與健康對照組相比,模型組大鼠腎組織OPN的陽性面積、平均吸光度及陽性細胞數均明顯增高(P<0.01);與模型組相比,中藥組和吡咯列酮組OPN陽性面積、平均吸光度、陽性細胞數顯著降低(P<0.01或P<0.05),差異有統計學意義。見圖1,表1。
2.2 各組大鼠腎組織病理學的改變 光鏡觀察顯示:正常組大鼠腎組織形態規則,腎小球結構完整,基底膜較薄,腎小管形態完整清晰,未見炎性細胞浸潤。同正常組比較,模型組大鼠腎組織形態欠規則,毛細血管袢結構不清晰,腎小球體積顯著增大,可見腎小球囊腔增大、結構不規整,基底膜增厚,腎小管部分萎縮、部分擴張,間質血管有不同程度的增生,細胞外基質明顯增多,腎間質內可見大量的炎性細胞浸潤。同模型組比較,中藥組、吡格列酮組大鼠腎組織病變有不同程度的改善,腎小球結構清晰、規則,基膜增厚減輕,可見部分腎小球體積增大,腎小管腔輕度擴張,腎小球內的細胞數目稍增多,細胞外基質增多降低,腎間質內見少許的炎性細胞浸潤。見圖2。
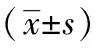
表1 各組大鼠腎組織中OPN陽性面積、平均吸光度、陽性細胞數的比較
注:與正常組比較,aP<0.01;與模型組比較,bP<0.01,cP<0.05
2.3 各組大鼠血糖、血脂的比較 與正常組相比,模型組各時段血糖、血脂(TG、TC、LDL-C)水平明顯升高(P<0.01);與模型組相比,中藥組和吡格列酮組血糖及血脂水平顯著降低(P<0.01)。見表2,3。

表2 各組大鼠血脂的比較
注:與正常組比較,aP<0.01;與模型組比較,bP<0.01

表3 各組大鼠不同時段血糖的比較
注:與正常組比較,aP<0.01;與模型組比較,bP<0.01
3 討論
目前多數學者認為DKD的發病機制為糖脂代謝紊亂、遺傳易患性、氧化應激、炎性反應等多種因素共同作用,導致細胞外基質增多、基膜變厚、微血管病變、腎組織纖維化等病理變化[4]。研究發現,OPN大量表達于腎臟及骨骼中,腎組織中OPN可由腎小管上皮細胞合成、分泌,高糖可誘導OPN合成增加[5]。腎組織OPN進一步介入到巨噬細胞趨化、蛋白尿滲出及腎小球硬化等多個環節,促使DKD的發生與發展。故早期阻斷腎組織中OPN的表達,對DKD的治療有重要意義[6-7]。
本次實驗注意到模型組大鼠腎組織OPN的表達明顯增加,多呈強陽性。中藥組大鼠腎組織OPN的表達顯著下降,多數不表達或呈弱陽性表達。同時,提示模型組大鼠腎組織OPN的陽性面積、平均吸光度、陽性細胞數目均顯著增加;中藥組和吡咯列酮組上述指標明顯下降,表明中藥健脾方可顯著抑制OPN的表達。腎臟病理結果提示,模型組大鼠腎臟受損較為嚴重,予中藥健脾方治療后大鼠腎組織病變明顯減輕,提示本方可減輕糖尿病大鼠腎臟病理損傷,對腎臟早期損傷具有良好的保護作用。同時實驗結果顯示出模型組大鼠的血糖、TC、TG等水平顯著增高,予中藥健脾方后大鼠的血糖、血脂水平較模型組明顯降低。分析本方的作用機制,可能是通過減少炎性因子的刺激,減輕糖脂毒性對內皮細胞功能的損害,進而降低腎組織OPN的高表達,減緩腎臟的病理損害,抑制DKD的進展。

A1:健康對照組;B1:模型組;C1:中藥組;D1:吡格列酮組

A2:健康對照組;B2:模型組;C2:中藥組;D2:吡格列酮組
近幾年,課題組從臨床調查入手,發現糖尿病腎病患者中脾虛血瘀型增多。如名老中醫曹恩澤主任認為,脾腎虧虛是DKD的病理基礎,瘀血是DKD發病的重要病理因素[8]。糖尿病腎病雖病本在腎,但與脾胃關系密切。祖國醫學認為,脾胃為乃后天之本,氣血生化之源;腎是先天之本,為精血之海,生命之根[9-10]。脾腎二臟在生理上相互滋生,在病理上亦互為因果,彼此影響。同時,“久病入絡”“久病致瘀”,瘀血阻絡貫穿著DKD的始終,既是DKD的病理產物,又可作為其致病因素。故治療糖尿病腎病應注意調養脾腎,活血化瘀。本實驗選擇健脾益氣活血方符合臨床實際。方中黃芪、白術、茯苓益氣健脾利濕,山藥健脾補腎,養胃生津;生地清熱涼血,滋腎養陰;黃連清熱燥濕解毒;丹參活血祛瘀,五味子滋腎生津,菝葜健脾利濕解毒,地龍活血通絡、捜剔驅邪。諸藥合用,達到健脾補腎,益氣活血之效,全方陰陽互濟,攻補兼施,扶正祛邪,使機體陰陽平,瘀濁去,腎絡通。
藥理研究證實,丹參、黃芪等能夠降低血糖和改善胰島素抵抗(IR)[11-12];黃芪甲苷能夠修復高糖誘導的平滑肌細胞和內皮細胞的功能障礙,故能在一定程度上保護糖尿病血管重構[13],且黃芪通過減少腎臟局部TGF-β1、OPN的表達和巨噬細胞驅化,減輕組織損傷,保護腎臟功能,對患者整體起著矯正蛋白質及脂質代謝紊亂的作用;丹參可明顯下調腎臟OPN的合成與分泌[14];黃連中的小檗堿能增強胰島素的敏感性,且能下調血清中游離脂肪酸,改善大鼠的高糖高脂狀態,調節胰島素分泌及改善IR[15]。山藥多糖對胰島細胞起到保護和修復作用,并能降低胰高血糖素的水平,使胰島素的分泌增加[16];白術能夠減輕四氧嘧啶損害胰島B細胞,或能改善胰島B細胞功能,達到降糖效果[17];茯苓多糖能顯著升高2型糖尿病小鼠腎臟中超氧化物岐化酶及谷胱甘肽過氧化物酶的水平,減少丙二醛的含量,增強腎組織的抗氧化能力,降低脂質過氧化,改善自由基所致氧化損傷,抑制T2DM小鼠腎臟中Bax基因的表達,進而減緩腎組織細胞凋亡趨勢,保護腎臟[18];地龍能改善DKD患者的脂質代謝紊亂,保護內皮細胞,清除氧自由基,降低過氧化脂質水平[19];生地黃、北五味子可增強抗氧化能力、加速自由基的清除[20]。菝葜提取物對于小鼠蛋清致足腫、醋酸致腹膜炎等有良好的抗炎、消腫作用,大大降低炎癥部位的炎癥介質,并有不同程度的免疫調節作用[21]。
綜上所述,中藥健脾方可能是通過多環節、多靶點提高機體免疫功能,減少炎性反應,清除氧自由基,改善血液高粘、高聚狀態,抑制糖尿病腎臟病理炎癥狀態,調節糖脂代謝紊亂,降低腎臟骨橋蛋白的高表達,從而起到延緩糖尿病腎臟損傷,保護腎臟功能的作用。
[1] 紀立農,陳莉明,郭曉蕙,等.中國慢性疾病防治基層醫生診療手冊(糖尿病分冊)2015年版[J].中國糖尿病雜志,2015,23(8):673-701.
[2] 劉丹,吳紅艷.骨橋蛋白在糖尿病腎病中作用的研究進展[J].安徽醫藥,2016,20(10):1832-1835.
[3] 張筠,王建平,臧麗,等.吡格列酮對2型糖尿病腎病患者骨橋蛋白和尿微量清蛋白的影響[J].實用醫學雜志,2012,28(16):2772-2774.
[4] 王鳳梅,蔣克國,張桂霞,等.高糖激活PI3K/AKT/Mtorc1通路誘導人腎小管上皮細胞骨橋蛋白的表達[J].中國藥理學通報,2014,30(8):1156-1160.
[5] 崔京男,崔海月.冬蟲夏草對糖尿病大鼠腎組織骨橋蛋白表達的影響[J].中華中醫藥學刊,2010,28(12):2635-2637.
[6] 張寧,李全民.糖尿病腎病患者血清骨橋蛋白檢測的臨床意義[J].中國醫學工程,2012,20(5):86-87.
[7] 鄧蓉蓉,沈婕,張麗麗,等.骨橋蛋白與糖尿病腎臟疾病的相關性研究進展[J].國際泌尿系統雜志,2014,33(2):283-285.
[8] 王億平,王翠萍.曹恩澤治療糖尿病腎病經驗[J].中醫藥臨床雜志,2013,25(4):298-300.
[9] 汪健,李中南.益氣養陰活血方聯合前列地爾治療糖尿病腎病[J].中國臨床保健雜志,2004,7(4):252-253.
[10] 孫文娟,王敏.腎炎康復片聯合前列地爾改善糖尿病腎病患者血液微循環的效果[J].中國臨床保健雜志,2016,19(6):602-605.
[11] 李娜,胡正芳,江振洲,等.中藥抗糖尿病研究進展[J].藥學與臨床研究,2011,19(4):343-347.
[12] 劉穎,陸付耳,黃光英.丹參對HepG2細胞胰島素抵抗狀態的影響[J].醫藥導報,2008,27(3):265-267.
[13] 歐陽靜萍,王念,張德玲,等.黃芪多糖抑制2型糖尿病大鼠肝臟PTP1B的表達改善胰島素抵抗的機制[J].中國動脈硬化雜志,2009,17(7):569-570.
[14] 劉虹彬,溫進坤,韓梅.丹參對血管平滑肌細胞基質金屬蛋白酶和骨橋蛋白基因表達及細胞增殖的影響[J].中國中西醫結合雜志,2002,22(10):764-766.
[15] 殷峻,陳名道,唐金鳳,等.小檗堿對實驗大鼠糖脂代謝的影響[J].中華糖尿病雜志,2004,12(3):215-218.
[16] 楊宏莉,張宏馨,李蘭會,等.山藥多糖對2型糖尿病大鼠降糖機制的研究[J].河北農業大學學報,2010,33(3):100-103.
[17] 單俊杰,田庚元.白術糖復合物AMP-B的理化性質及降血糖活性的研究[J].藥學學報,2003,38(6):438-441.
[18] 黃聰亮,鄭佳俐,李鳳林,等.茯苓多糖對2型糖尿病小鼠腎組織抗氧化能力及Bax、Bcl-2蛋白表達影響[J].食品與生物技術學報,2016,35(1):82-88.
[19] 馬艷春,周波,宋立群,等.地龍有效成分對糖尿病腎臟疾病患者血脂、脂質過氧化反應的影響[J].中國臨床保健雜志,2012,15(1):53-54.
[20] 戴衛波,梅全喜,李樂愚.中藥組方治療糖尿病藥理作用研究進展[J].世界中醫藥,2016,11(6):1122-1125.
[21] 李蘇翠,舒孝順,楊祥良.菝葜根莖活性部位的抗炎作用及其對環氧化酶活性影響的研究[J].亞太傳統醫藥,2009,5(7):16-21.

