“嗅三針”對阿爾茨海默病小鼠空間記憶能力和海馬APP、Aβ蛋白表達的影響*
王 淵,劉智斌,牛文民,王 強,李 杰,魯 剛
陜西中醫(yī)藥大學(咸陽 712046)
阿爾茨海默病(Alzheimer's disease,AD)是一種常見的癡呆癥,約占癡呆患者的60%~80%,絕大多數(shù)AD患者發(fā)病前期無明顯征兆,一旦出現(xiàn)進行性認知功能障礙等典型表現(xiàn)時已處于中晚期[1]。研究發(fā)現(xiàn),嗅覺功能障礙是AD早期較為常見的臨床表現(xiàn)之一[2-3],如能在AD早期對嗅覺功能障礙進行干預,將有可能延緩AD發(fā)病進程。研究表明,β-淀粉樣蛋白(β-amyloid protein ,Aβ)的沉積和累積所引起的病理級聯(lián)反應(yīng)是導致AD的基本病因之一,而Aβ由淀粉樣前體蛋白(Amyloid precursor protein,APP)裂解所產(chǎn)生[4]。“嗅三針”療法是劉智斌教授多年來治療癡呆的經(jīng)驗針法,對其具有明顯的優(yōu)勢和確切的臨床療效。本研究擬通過切斷和保留嗅覺通路,觀察嗅三針對AD小鼠空間記憶能力和海馬APP、 Aβ蛋白表達的影響,以揭示嗅三針治療AD的作用機制。
材料與方法
1 動物和分組 采用Morris水迷宮檢測,剔除不合格的動物,篩選后選取7個月齡的APP/PS1雙轉(zhuǎn)基因小鼠(AD模型小鼠)40只,隨機分為4組,同窩陰性小鼠10只作為正常對照組。Ⅰ組(sham):正常對照組;Ⅱ組(model):AD模型組;Ⅲ組(XSZ):嗅三針組;Ⅳ組(XSZ+XSJ):嗅三針加嗅神經(jīng)切斷組;Ⅴ組(Donepezil ):鹽酸多奈哌齊組,每組10只。動物均由南京大學模式動物研究所提供,動物批號:SCXK(寧)2016-003,體重(35.8±4.22)g。
AD模型組、正常組與三個干預組相同時間、相同程度的捉抓刺激,但不做電針刺激;嗅三針組行嗅三針干預;嗅三針加嗅神經(jīng)切斷組在AD小鼠行嗅神經(jīng)切斷術(shù)后行嗅三針干預;鹽酸多奈哌齊組以3 mg/(kg·d)的劑量,對AD小鼠進行灌胃;以上各組均1次/d,5 d為1個療程,休息2 d,共進行4個療程。
2 主要儀器與試劑 韓氏穴位神經(jīng)刺激儀(型號:HANS-200A型,由南京濟生醫(yī)療科技有限公司生產(chǎn)),Morris水迷宮(型號:XR-XM101型,由上海欣軟信息科技有限公司生產(chǎn)),西格瑪臺式高速離心機(型號:3-16PK型,由德國Sigma公司生產(chǎn)),電泳儀(型號:NYCP-34ACG型,由北京六一生物科技有限公司生產(chǎn)),華佗針灸針(規(guī)格:0.25 mm×13 mm,由蘇州醫(yī)療用品有限公司生產(chǎn)),兔Aβ一抗和兔APP一抗(由武漢博士德生物工程有限公司生產(chǎn)), 山羊抗兔二抗(由辣根過氧化物酶標記,由北京中杉金橋生物技術(shù)有限公司生產(chǎn))。
3 嗅神經(jīng)切斷術(shù)模型制作 參照文獻[5]對AD小鼠在行嗅神經(jīng)切斷術(shù),采用水合氯醛將AD小鼠進行麻醉,應(yīng)用立體定位儀將麻醉后的小鼠固定其上,切開小鼠顱頂正中區(qū)域的皮膚并小范圍分離,以使得其前囟充分暴露,于矢狀靜脈竇、鼻額縫與眼眶上內(nèi)側(cè)緣之間鉆兩個小孔以暴露嗅球,均以1 mm為直徑,位于嗅球前端的硬腦膜將其用顯微解剖鑷提起,對于充分暴露的嗅神經(jīng)采用銳性切斷術(shù),原則上使嗅球不致?lián)p傷,對于出血處采用明膠海綿進行壓迫,并將青霉素點在傷口處,最后進行傷口縫合。
4 嗅三針干預方法 動物經(jīng)腹腔注射戊巴比妥鈉麻醉后仰臥位放置于預先加熱的小動物實驗臺上。取穴:迎香(雙側(cè))和印堂。迎香(定位):小鼠鼻孔外側(cè)上端,有毛與無毛交界處;印堂(定位):小鼠兩眼眶上緣中點連線與正中線交點[6]。操作方法:采用0.25mm×13mm寸毫針,對于迎香采用斜刺法,進針深度為2 mm,方向朝向內(nèi)上方,對于印堂采用平刺法,進針深度為2 mm,方向朝向鼻根部;對于印堂將電針的正極接于其上,對于一側(cè)迎香將電針的負極接于其上,刺激時間為10 min,之后將電針的負極換接于另側(cè)迎香上,刺激時間為10 min。刺激參數(shù):疏密波,頻率為2/15HZ,強度為1 mA。
5 Morris水迷宮空間探索實驗 空間探索實驗:于干預治療的最后一天,在Morris水迷宮環(huán)境、池水溫度、定位航行試驗不發(fā)生變化的條件下,去除水迷宮下的站臺,然后將小鼠放置于第3象限面壁池內(nèi),用電腦記錄并分析小鼠60 s內(nèi)所經(jīng)過的游泳路線,清理小鼠身上水漬,放入鼠籠。其他象限的實驗則無需再進行。通過記錄小鼠第3象限時間占總時間的百分比以及穿越平臺次數(shù),評估小鼠的空間記憶能力。
6 免疫蛋白印跡(Western blot)法檢測海馬水平APP蛋白、Aβ蛋白表達 實驗結(jié)束后,將小鼠用10%水合氯醛(0.35 ml/100 g)麻醉后,快速取海馬組織,裝入EP管后迅速放入液氮,移入-80度保存?zhèn)溆谩B檢測步驟如下:將海馬(等量大小)樣本剪取后,放置于EP管中,將RIPA蛋白裂解液(等體積預冷)加入到每份等量的海馬樣本中,采用超聲破碎儀對其研磨,高速冷凍離心機4 ℃、1500 r/min離心。對于各樣本的蛋白濃度的測定,采用BCA蛋白定量試劑盒對其進行檢測,蛋白上樣量的劑量經(jīng)確定約30 μg,并將5×SDS-PAGE蛋白上樣緩沖液加入其中。對于目標蛋白,將其上樣后,再進行為時1 h的電泳,然后轉(zhuǎn)膜至PVDF膜上,封閉, 再加入一抗兔抗鼠APP(1∶100)和Aβ(1∶100),4 ℃孵育過夜。然后經(jīng)二抗HRP-羊抗兔IgG(1∶100),常溫下孵育1 h,TBST洗滌,使用ECL試劑盒顯影5 min,將目標蛋白曝光完畢后,應(yīng)用凝膠成像分析系統(tǒng)計算目標條帶灰度值。每個樣品重復測量3次,取均值分析。實驗以GAPDH作為內(nèi)參照物。
結(jié) 果
1 各組小鼠空間探索實驗穿越平臺次數(shù) 見表1。通過單因素方差分析,其結(jié)果顯示:通過空間探索實驗,在對靶象限(第三象限)的觀察統(tǒng)計中得出,五組小鼠在實驗中穿越平臺的次數(shù)分別為:空白組1.82次,模型組0.71次,嗅三針組1.41次,嗅三針加嗅神經(jīng)切斷組0.76次,鹽酸多奈哌齊組1.53次。嗅三針組在靶象限(第三象限)穿臺次數(shù)成績居中,高于模型組,低于空白對照組。
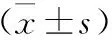
表1 各組小鼠空間探索實驗穿越平臺次數(shù)比較
注:與空白組比較,*P<0.01;與模型組比較,#P<0.05
2 各組小鼠空間探索實驗靶象限時間占總時間百分比 見表2。通過單因素方差分析,其結(jié)果顯示:通過空間探索實驗,在對靶象限(第三象限)所占總時間(60 s)的百分比觀察統(tǒng)計中得出,五組小鼠在靶象限的時間分別為:空白組49.12%,模型組23.53%,嗅三針組39.54%,鹽酸多奈哌齊組37.13%,嗅三針加嗅神經(jīng)切斷組19.97%。五組比較結(jié)果顯示嗅三針組成績最好。
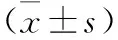
表2 各組小鼠空間探索實驗靶象限時間
注:與空白組比較, *P<0.01;與模型組比較,#P<0.05
3 各組小鼠海馬APP、 Aβ蛋白表達 見圖1、2,表3、4。通過對大鼠海馬區(qū)APP蛋白、Aβ蛋白的檢測,經(jīng)統(tǒng)計學處理,我們發(fā)現(xiàn),對于APP蛋白、Aβ蛋白的表達,與正常對照組比較,AD模型組小鼠的APP蛋白、Aβ蛋白表達顯著增高,具有顯著性差異(P<0.01);與AD模型組比較,“嗅三針”干預組小鼠的APP蛋白、Aβ蛋白表達顯著降低(P<0.05);與AD模型組比較,“嗅三針加嗅神經(jīng)切斷組”的APP蛋白、Aβ蛋白表達沒有顯著性差異(P>0.05);與AD模型組比較,鹽酸多奈哌齊組小鼠的APP蛋白、Aβ蛋白表達顯著降低(P<0.05);嗅三針組與鹽酸多奈哌齊組比較無顯著性差異(P>0.05)。
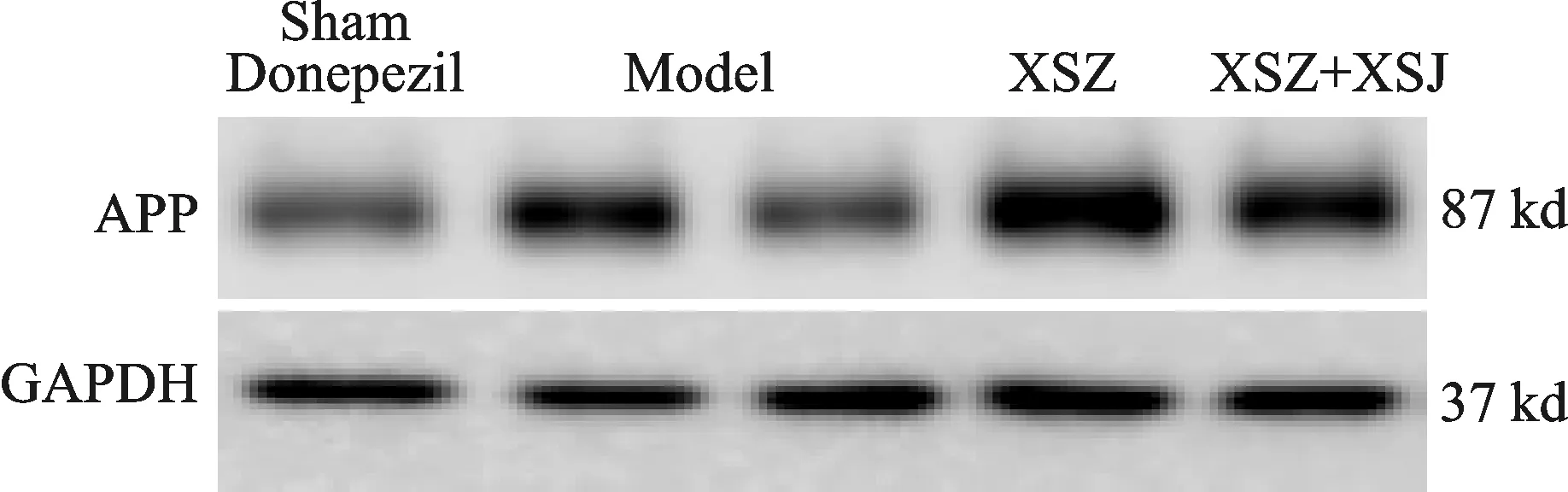
圖1 各組小鼠海馬APP蛋白表達

圖2 各組小鼠海馬Aβ蛋白表達
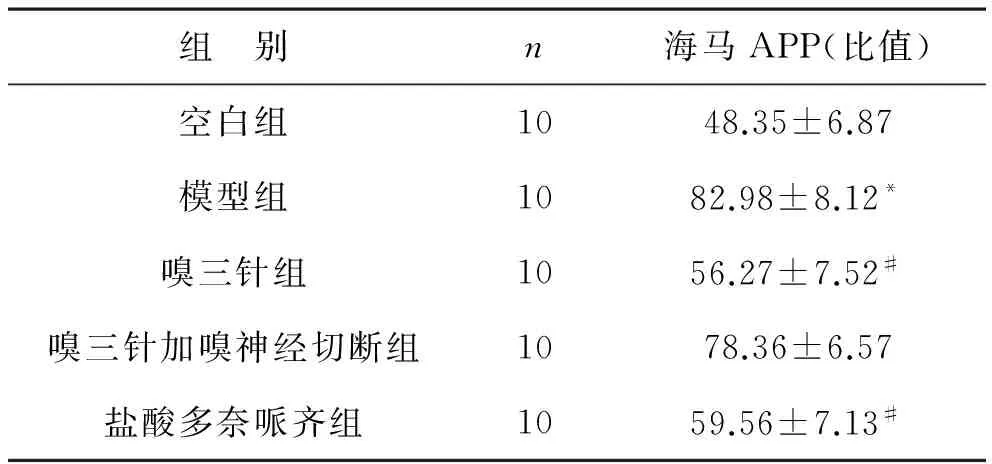
組 別n海馬APP(比值)空白組1048.35±6.87模型組1082.98±8.12*嗅三針組1056.27±7.52#嗅三針加嗅神經(jīng)切斷組1078.36±6.57鹽酸多奈哌齊組1059.56±7.13#
注:與空白組比較,*P<0.01;與模型組比較,#P<0.05
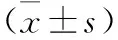
表4 各組小鼠海馬Aβ蛋白表達
注:與空白組比較,*P<0.01;與模型組比較,#P<0.05
討 論
研究表明,β-淀粉樣蛋白(β-amyloid protein ,Aβ)的沉積和累積所引起的病理級聯(lián)反應(yīng)是導致AD的基本病因之一。Aβ沉積導致小膠質(zhì)細胞(Microglia,MG)在淀粉樣斑塊周圍大量分布并活化,進而激活細胞內(nèi)信號轉(zhuǎn)導,分泌具有細胞毒性的炎癥因子,導致神經(jīng)元凋亡或死亡,加速AD的發(fā)展[7-8]。
嗅覺功能減退是AD早期主要的臨床癥狀之一,且癥狀持續(xù)時間最長[9],AD的病情具有不可逆性且病程較長,而目前臨床上對其中晚期的治療效果較差,所以為了延緩其病情的進展或預防其發(fā)病,早期的干預治療具有重要意義。“嗅三針”療法是課題組多年來用于治療AD和嗅覺功能障礙的一種特色電針療法[10],由雙側(cè)迎香和印堂三穴配穴組成,二穴功能主治均與嗅覺系統(tǒng)密切相關(guān),故命名為“嗅三針”。前期臨床及基礎(chǔ)研究應(yīng)用“嗅三針”方法治療AD,均取得良好的療效。有鑒于此,為了進一步明確嗅三針對AD的調(diào)控機制,通過影響相關(guān)調(diào)控環(huán)節(jié)提高嗅三針療效延緩AD發(fā)展進程,本研究擬通過切斷和保留嗅覺通路,觀察嗅三針對AD小鼠空間記憶能力和海馬APP蛋白、Aβ蛋白表達的影響。
對于小鼠空間記憶能力的評估,我們采用Morris水迷宮測試中的空間探索試驗,Morris水迷宮實驗是目前應(yīng)用最廣泛并得到國內(nèi)外學者普遍認可,用來評價動物空間學習記憶能力的行為學實驗[11]。研究結(jié)果表明:對于空間探索試驗各指標,嗅三針組和鹽酸多奈哌齊組與空白組比較無顯著性差異,與模型組比較有顯著性差異,說明嗅三針組和鹽酸多奈哌齊組的干預對AD模型小鼠的記憶能力起到了改善作用,但還不能認為嗅三針和鹽酸多奈哌齊使AD模型小鼠的記憶能力恢復到正常鼠水平,這可能與小鼠空間搜索策略之間具有一定的相關(guān)性,對于空白組小鼠,其在空間平臺位置記憶方面表現(xiàn)較好,而當其跨越原平臺位置多次后,仍未找到空間平臺, 小鼠對其記憶能力開始懷疑并進行其他方式的新探索;嗅三針加嗅神經(jīng)切斷組與模型組比較無顯著性差異,說明嗅三針加嗅神經(jīng)切斷組干預后小鼠的記憶能力沒有得到改善,提示嗅三針發(fā)揮改善AD小鼠記憶能力的作用是基于嗅覺通路完整性的基礎(chǔ)之上的。
對于小鼠海馬APP蛋白、Aβ蛋白表達,研究結(jié)果表明:嗅三針干預組可以顯著減少海馬區(qū)APP蛋白、Aβ蛋白的表達,效應(yīng)與鹽酸多奈哌齊組無顯著性差異,說明嗅三針干預AD小鼠的可能作用機制之一是通過減輕小鼠海馬區(qū)APP蛋白、Aβ蛋白的表達,改善小鼠空間記憶能力;嗅覺神經(jīng)切斷組即使在嗅三針的干預下也并沒有減少APP蛋白、Aβ蛋白在嗅神經(jīng)切斷后,干預效應(yīng)不顯現(xiàn),說明嗅三針通過激活嗅覺通路發(fā)揮對APP蛋白、Aβ蛋白的干預效應(yīng),且嗅三針干預效應(yīng)的發(fā)揮有賴于嗅覺通路的完整性。
鹽酸多奈哌齊是目前臨床上對AD有較好治療效果的藥物,且安全性較高[12],而在本實驗研究中,“嗅三針”刺激與鹽酸多奈哌齊灌胃干預均能改善AD小鼠空間記憶能力并發(fā)揮對海馬APP蛋白、Aβ蛋白表達的抑制效應(yīng),兩者相比,無顯著性差異。有鑒于此,我們認為“嗅三針”通過激活嗅覺通路發(fā)揮以上干預效應(yīng),且其發(fā)揮有賴于嗅覺通路的完整性,這可能是嗅三針干預AD小鼠的機制之一,但對其影響嗅覺系統(tǒng)功能的作用機制有待于進一步研究。
[1] Sanchezmut JV,Johannes G.Epigenetic alterations in Alzheimer’s disease [J].Frontiers in Behavioral Neuroscience, 2015,9(1):347.
[2] Woodward MR, Amrutkar CV, Shah HC. Validation of olfactory deficit as a biomarker of Alzheimer disease[J]. Neurol Clin Pract,2017,7(1):5-14.
[3] 羅超群,文 安,楊 赟,等.阿爾茨海默病相關(guān)嗅覺障礙研究進展[J].中國神經(jīng)免疫學和神經(jīng)病學雜志,2016,23(6):434-437.
[4] Wu PJ, Hung YF, Liu HY. Deletion of the inflammasome sensor Aim2 mitigates Aβ deposition and microglial activation but increases inflammatory cytokine expression in an alzheimer disease mouse model[J].Neuroimmunomodulation, 2017,16(1):1159.
[5] 羨 慕,魏永祥,韓德民,等. 嗅神經(jīng)切斷對小鼠嗅感覺神經(jīng)元的影響[J].中國耳鼻咽喉頭頸外科,2005,40(9):671-674.
[6] 李忠仁.實驗針灸學[M] .北京:中國中醫(yī)藥出版社, 2003 :327 -329 .
[7] Pires LR, Rocha DN, Ambrosio L,etal.The role of the surface on microglia function: implications for central nervous system tissue engineering[J]. Journal of the Royal Society Interface. 2015, 12(2):1098-1106.
[8] Costello DA, Carney DG, Lynch MA. α-TLR2 antibody attenuates the Aβ-mediated inflammatory response in microglia through enhanced expression of SIGIRR[J]. Brain Behav Immun,2015,22(1):1591-1599.
[9] 于煥新, 杭 偉,張金玲. 阿爾茨海默病患者嗅覺功能以及嗅球體積和嗅溝深度的研究[J]. 臨床耳鼻咽喉頭頸外科雜志,2015,29(5):444-447.
[10] 劉智斌,牛文民,楊曉航,等. “嗅三針”對阿爾茨海默病大鼠海馬Bcl-2 和Bax 表達的干預效應(yīng)[J].針刺研究,2011,36(1):7-11.
[11] 武海霞,吳志剛,劉紅彬,等. Morris 水迷宮實驗在空間學習記憶研究中的應(yīng)用[J].神經(jīng)藥理學報,2014,5(4):30-35.
[12] 陳 科.鹽酸多奈哌齊治療阿爾茨海默病的臨床研究[J].中國臨床藥理學雜志,2016,32(11):981-983.

