增強心臟磁共振成像評估心房顫動患者射頻消融術后左心房及肺靜脈開口變化與術后復發的關系
李雪蓮,陳文蘇,李承宗,李菲,張超群,韓曙光,王佳麗,王志榮,張卓琦
目前,對于藥物治療效果欠佳的心房顫動(房顫),導管射頻消融術是一線治療手段[1,2],不過盡管手術療效較好,但術后較高的復發率還是嚴重影響了其臨床應用。有數據顯示,陣發性房顫的首次手術成功率在70%~80%,而持續性房顫僅60%[2]。就術后復發的影響因素,大量研究提示,術后肺靜脈傳導恢復是多數患者復發的主因[3]。
心臟磁共振成像(CMR)具有良好的軟組織分辨率和空間分辨力,是心臟解剖結構、功能形態及血流灌注等方面診斷和評估的“金標準”[4],其多角度、多層面、多參數成像方式可以清晰、直觀地顯示肺靜脈、左心房及左心耳區域的結構功能及形態特征[5]。利用3D掃描技術進行三維重建獲得左心房容積,有助于對房顫發生機制及心房和肺靜脈的形態學變化進一步認識。目前國內多僅利用多層螺旋計算機斷層攝影術(CT)在術前評估左心房-肺靜脈解剖特點,關于射頻消融手術前后左心房容積和肺靜脈形態功能發生了何種變化,尚乏研究。本研究旨在利用延遲增強心臟磁共振3D檢查對房顫患者及健康成人進行對照研究,同時觀察手術前后左心房及肺靜脈開口最大橫截面積變化,并探討其與房顫射頻消融術后復發的相關性。
1 資料與方法
1.1 研究對象
入選2016-02至2017-03在徐州醫科大學附屬醫院就診的房顫患者78例(房顫組),平均年齡為(57.8±13.0)歲,男性47例,女性31例。入選標準:房顫診斷明確且有客觀診斷依據(心電圖、心臟彩色多普勒超聲心動圖、動態心電圖等)。排除標準:(1)有體內金屬異物置入者(植入性起搏器、鋼釘、鋼板等);(2)幽閉恐懼癥患者;(3)紐約心臟協會(NYHA)心功能分級≥Ⅲ級或心原性休克;(4)腫瘤晚期患者;(5)嚴重肝腎功能不全。另外,納入20例健康成年人作為正常對照組,平均年齡為(35.5±13.6)歲,男性13例。
78例房顫包括46例陣發性房顫患者(陣發性房顫亞組)和32例持續性房顫患者(持續性房顫亞組)。這些房顫患者有2例合并瓣膜病,1例合并甲狀腺功能亢進癥、13例合并冠狀動脈粥樣硬化性心臟病,3例合并糖尿病,47例患有高血壓,4例合并心力衰竭,8例合并腦卒中。78例房顫患者中共有66例行射頻消融術,術中及術后隨訪(180±20)天期間,17例復發(復發亞組),49例無復發(無復發亞組),均無術后并發癥發生。
所有受試者在入組時及房顫手術組患者在術后6個月均行CMR檢查。本研究符合醫院倫理委員會要求并獲得患者知情同意。
1.2 檢查方法
采用荷蘭Philips公司Ingenia 3.0 T超導磁共振掃描儀,胸前四導聯向量心電觸發及呼吸導航檢測裝置。常規掃描包括黑血序列及亮血系列電影成像,分別行左心室兩腔心長軸、四腔心長軸、左心房橫軸位、左心房矢狀位及6~8層左心室短軸掃描。首過灌注對比劑采用釓噴酸葡胺(Gd-DTPA),以0.1 mmol/kg、4~5 ml/s流速注射,注射與掃描同時開始。心肌灌注完成后立即以2 ml/s的流速追加0.1~0.15 mmol/kg劑量的對比劑,同時追加20 ml生理鹽水。首過灌注后10~15 min行相位敏感反轉恢復(PSIR)的T1Wl掃描,根據獲得的最佳T1時間行心肌延遲強化掃描,包括左心房橫軸位切面、6~8層左心室短軸切面,左心室兩腔心切面及四腔心切面各一層。掃描參數:重復時間(TR)/回波時間(TE)6.15/3.0 ms,翻轉時間 230~320 ms,翻轉角度 10°,分辨率1.25 mm×1.25 mm×2.5 mm,間距 -1.8 mm,層厚6.0 mm,重建分辨率0.625 mm×0.625 mm×1.25 mm。
1.3 圖像測量與分析
應用星云工作站(荷蘭 Philips)及QMASS 4.20(萊頓大學 MEDIS公司)心臟分析軟件處理圖像,根據冠狀位、矢狀位、軸位三維圖像確認各肺靜脈位置及肺靜脈變異情況,分別測量并記錄各肺靜脈口在矢狀位上垂直血流方向的最大橫截面積(CSA),利用QMASS 4.20心臟分析軟件手動勾畫心內膜及心外膜輪廓,分析心功能并重建左心房三維模型,利用容積再現方法軟件自動計算其三維容積。每位受試者由2名資深放射科醫師對各肺靜脈口最大橫截面積及左心房容積各測量1次,2次測量間隔1周,取2次測量的平均值進行統計。
1.4 射頻消融手術方式
所有行射頻消融手術的房顫患者均在2%利多卡因局部麻醉下穿刺左鎖骨下靜脈送入10極電極導管至冠狀靜脈竇,穿刺右股骨靜脈,送入8.5 F鞘,2次穿刺房間隔,放置2根Swartz鞘管于左心房后,注入肝素(100 IU/kg),鞘管尾端給予稀釋肝素生理鹽水持續滴入預防血栓形成。首先經Swartz鞘管進行左右肺靜脈造影,選擇與肺靜脈大小相近的Lasso導管(Biosense Webster)經Swartz鞘送入各個肺靜脈內記錄消融前后的肺靜脈電位,在三維標測系統指導下完成左心房及肺靜脈的電解剖學圖像融合,在此基礎上完成消融,消融能量由冷鹽水灌注消融導管(強生ST導管)提供,消融部位為環肺靜脈前庭部位(肺靜脈開口外0.5~1.0 cm)。
消融設置:功率30~35 W,溫度43℃,生理鹽水流速17 ml/min。每處放電直至該處雙極電位振幅降低>70%,或已成為碎裂電位,或放電時間已達30 s。消融后應用消融導管線上起搏驗證肺靜脈電位隔離,在未隔離處補點,達到肺靜脈電隔離。若未能成功轉復,則給予電復律,觀察15 min。若仍未能轉復,則加行其他徑線消融(左心房峽部,左心房頂部,右心房峽部,左、右肺靜脈消融環間等)或碎裂電位消融,至房顫轉為竇性心律或碎裂電位消失。
1.5 消融后處理和隨訪
手術成功定義為術后3個月無抗心律失常藥物治療、無復發。所有完成環肺靜脈前庭消融的房顫患者術后繼續口服達比加群酯2個月,持續性房顫患者常規服用可達龍,3個月后停藥觀察消融效果。采用電話、門診或者住院隨訪的方式。
隨訪的主要研究終點事件如下:(1)術后復發定義為有或無癥狀患者,任意一次心電圖、24 h動態心電圖或者長程心電記錄儀記錄到>15 s的房顫等房性心律失常事件;(2)手術并發癥(肺靜脈狹窄、左心房食管瘺、心臟壓塞)等安全性終點事件。
1.6 統計學處理方法
所有資料采用SPSS 17.0軟件處理,所有定量資料以均數±標準差表示,各組間定量資料的比較采用獨立樣本t檢驗。分類資料率以百分比表示(%),兩組間比較采用卡方檢驗或者秩和檢驗。采用單因素和多因素Logistic回歸法,分析各因素與術后復發的關系。P<0.05為差異有統計學意義。
2 結果
2.1 房顫組與正常對照組受試者臨床資料比較(表1)
通過比較臨床資料可見,與正常對照組比較,房顫組平均年齡明顯較大,高血壓、CHA2DS2-VaSc評分和腦卒中比例也顯著較高。其中,陣發性房顫亞組的平均年齡比持續性房顫亞組明顯較小,提示房顫是一種進展性疾病。
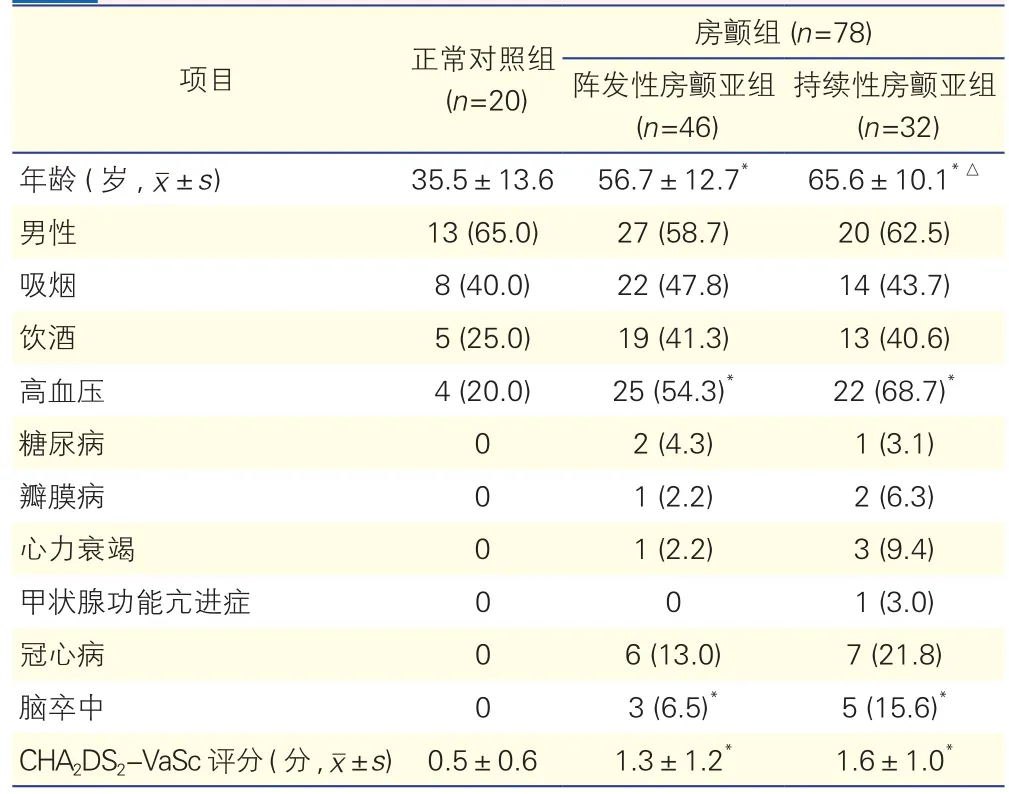
表1 房顫組和正常對照組受試者臨床資料比較[例(%)]
2.2 房顫組與正常對照組以及各亞組受試者左心房和肺靜脈解剖結構特征的比較
2.2.1 房顫組與正常對照組受試者比較(表2)
所有受試者肺靜脈及左心房均顯示良好,無肺靜脈畸形引流。受試者上肺靜脈開口均大于下肺靜脈開口,且右上肺靜脈開口大于左上肺靜脈開口。與正常對照組相比,房顫組左右上肺靜脈的開口最大橫截面積以及左心房容積均顯著增大(P<0.05),左心室射血分數(LVEF)顯著降低(P=0.044);亞組分析顯示:持續性房顫亞組左右上肺靜脈開口最大橫截面積及左心房容積均顯著高于陣發性房顫亞組(P值均< 0.05),提示房顫發生與上肺靜脈及左心房大小的關系密切。
表2 房顫組和正常對照組受試者術前左心房及肺靜脈結構特征比較(±s)
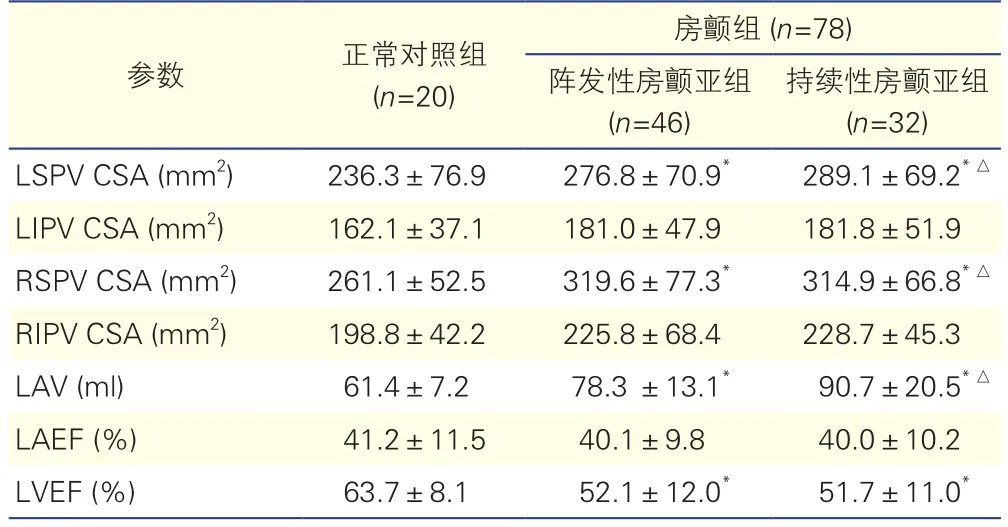
表2 房顫組和正常對照組受試者術前左心房及肺靜脈結構特征比較(±s)
注:CSA:開口橫截面積;LSPV:左上肺靜脈;LIPV:左下肺靜脈;RSPV:右上肺靜脈;RIPV:右下肺靜脈;LAV:左心房容積;LAEF:左心房射血分數;LVEF:左心室射血分數。與正常對照組比較*P<0.05;與陣發性房顫亞組比較△P<0.05
參數 正常對照組(n=20)房顫組 (n=78)陣發性房顫亞組(n=46)持續性房顫亞組(n=32)LSPV CSA (mm2) 236.3±76.9 276.8±70.9* 289.1±69.2*△LIPV CSA (mm2) 162.1±37.1 181.0±47.9 181.8±51.9 RSPV CSA (mm2) 261.1±52.5 319.6±77.3* 314.9±66.8*△RIPV CSA (mm2) 198.8±42.2 225.8±68.4 228.7±45.3 LAV (ml) 61.4±7.2 78.3 ±13.1* 90.7±20.5*△LAEF (%) 41.2±11.5 40.1±9.8 40.0±10.2 LVEF (%) 63.7±8.1 52.1±12.0* 51.7±11.0*
2.2.2 行射頻消融術房顫患者術前和術后6個月亞組分析
(1)肺靜脈開口最大橫截面積和左心房容積變化:與術前相比,復發亞組的右上肺靜脈開口在術后顯著增大,而其他肺靜脈開口最大橫截面積與術前相比差異無統計學意義;無復發亞組左上肺靜脈、兩右肺靜脈的開口最大橫截面積術后均顯著減小(P均<0.05),左下肺靜脈術前術后相比相似。這提示,右上肺靜脈開口大小對術后復發影響較大。在左心房容積,與術前比較,無復發亞組術后明顯降低,復發亞組術后顯著增大(表3),這提示房顫的復發與左心房進行性擴大有關。
表3 無復發和復發亞組患者各肺靜脈開口最大橫截面積和左心房容積手術前后變化(±s)
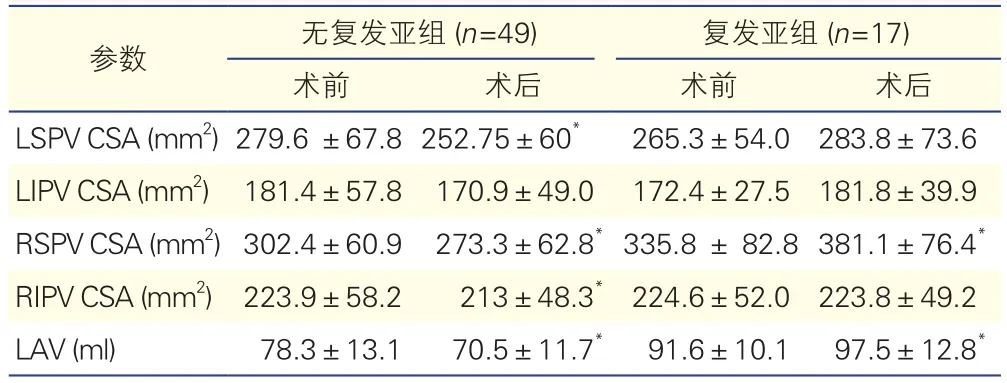
表3 無復發和復發亞組患者各肺靜脈開口最大橫截面積和左心房容積手術前后變化(±s)
注:LSPV:左上肺靜脈;CSA:開口橫截面積;LIPV:左下肺靜脈;RSPV:右上肺靜脈;RIPV:右下肺靜脈;LAV:左心房容積。與術前比較*P<0.05
參數 無復發亞組 (n=49) 復發亞組 (n=17)術前 術后 術前 術后LSPV CSA (mm2)279.6 ±67.8 252.75±60* 265.3±54.0 283.8±73.6 LIPV CSA (mm2) 181.4±57.8 170.9±49.0 172.4±27.5 181.8±39.9 RSPV CSA (mm2)302.4±60.9 273.3±62.8*335.8 ± 82.8 381.1±76.4*RIPV CSA (mm2)223.9±58.2 213±48.3*224.6±52.0 223.8±49.2 LAV (ml) 78.3±13.1 70.5±11.7* 91.6±10.1 97.5±12.8*
(2)無復發和復發兩亞組術后左心房容積的減小與左上肺靜脈[(r=0.407,P=0.01)、右上肺靜脈(r=0.697,P=0.001)]、左下肺靜脈(r=0.626,P< 0.01)以及右下肺靜脈(r=0.184,P=149)的開口最大橫截面積的減小顯著相關。這提示,肺靜脈擴張可能和增大的左心房牽拉作用有一定相關性。
(3)多因素分析顯示,左心房容積(HR=1.05,P<0.01)及右上肺靜脈開口最大橫截面積(HR=1.09,P=0.046)仍與房顫射頻消融術后復發相關(表4)。
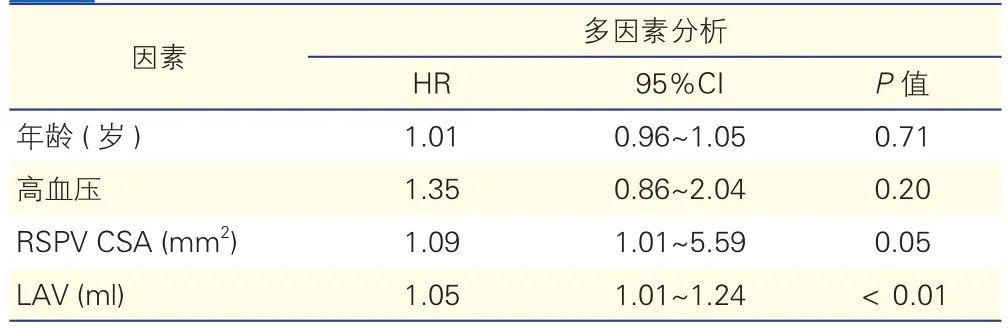
表4 射頻消融術后房顫復發相關因素的多因素Logistic分析
3 討論
關于房顫發生機制與肺靜脈的關系,既往大量研究已證實房顫肺靜脈起源的異常觸發灶多位于上肺靜脈[6], Rostock等[6]研究提出“房顫致房顫”也發生在肺靜脈,即肺靜脈異位起搏點誘發房顫,而房顫又進一步引起左心房及肺靜脈的重構。本研究中持續性房顫亞組左右上肺靜脈開口最大橫截面積較正常對照組、陣發性房顫亞組均顯著增大這一結果也支持了這一觀點。此外我們術中發現粗大的肺靜脈在線性消融時不能形成透壁性損傷的漏點概率增大,另外由于左心房-肺靜脈區域電傳導的高度異向性,異位起搏靶點出現的概率增加,且消融位置過深,導致電傳導恢復的機率增高;另外肺靜脈增粗者可能伴有心房內電重構,房顫子波的發生機制和維持機制仍然存在,仍可能發生房顫等房性心律失常事件。目前關于消融術后肺靜脈開口橫截面積減小這種改變的機制說法不一。Dong等[7]提出,肺靜脈直徑的減小可能與術后恢復竇性節律引起的血流動力學改變有關。Hauser等[8,9]提出,術后肺靜脈開口變小與開口瘢痕程度顯著相關。
其次,房顫致左心房重構包括電重構、結構重構以及收縮重構,可表現為心房肌纖維化、左心房擴大等[10-12]。何衛等[13]研究犬的房顫模型發現增齡和房顫時,左心房心肌組織中膠原組織增多、心肌纖維化加重,心房間質纖維化擾亂了心房局部興奮或沖動的傳導,導致房內傳導的不均一性,易于形成折返,促進房顫的發生和維持。由此可見擴大的心房結構具有重要的電生理效應,隨著左心房的擴大,發生房顫的危險性增加,而房顫又進一步加重左心房的重構。有研究顯示,房顫引起的左心房及肺靜脈重構在恢復竇性心律后是可逆的[14,15],我們在此基礎上進一步比較了逆轉的程度,發現術后6個月時逆轉重構未恢復至正常對照組水平,對于是否能夠完全恢復至正常水平或其恢復的時限尚需進一步研究。
最后,本研究還發現,房顫組左心房及左心室的功能均低于正常對照組。當房顫發生時,左心房機械運動失去正常協調,結構改變,進而繼發左心房壓力和容積負荷增加,表現為左心房的初級泵、儲存功能的減低,最終影響心室收縮功能[16]。而這些改變又會促使房顫持續、慢性發展,因此,盡早干預治療,控制左心房擴大的危險因素有助于阻止甚至逆轉左心房重構,改善長期預后。
本研究具有一定局限性,首先研究的目的之一是觀察房顫患者左心房及肺靜脈開口最大橫截面積的變化,但目前尚缺乏患者發病前的相關數據,無法精確評估術后逆轉程度。其次,納入的研究樣本量較少。
綜上所述,射頻消融術可逆轉房顫患者左心房及肺靜脈的重構,房顫的復發與左心房進行性擴大及肺靜脈的擴張密切相關。利用CMR能夠準確地評估左心房及肺靜脈這種形態及功能的改變[17,18],為心血管疾病在未來定量結構和功能的重構提供了強有力動態的形態學指標。
[1] Camm AJ, Lip GY, De Caterina R, et al. 2012 focused update of the ESC guidelines for the management of atrial fibrillation: an update of the 2010 ESC guidelines for the management of atrial fibrillation--developed with the special contribution of the European Heart Rhythm Association[J]. Europace, 2012, 14(10): 1385-1413. DOI: 10. 1093/europace/eus305.
[2] Peters DC, Wylie JV, Hauser TH, et al. Recurrence of atrial fibrillation correlates with the extent of post-procedural late gadolinium enhancement: a pilot study[J]. JACC Cardiovasc Imaging. 2009, 2(3):308-316. DOI: 10. 1016/j. jcmg. 2008. 10. 016.
[3] Di Biase L, Elayi CS, Fahmy TS, et al. Atrial fibrillation ablation strategies for paroxysmal patients: randomized comparison between different techniques[J]. Circ Arrhythm Electrophysiol, 2009, 2(2):113-119. DOI: 10. 1161/CIRCEP. 108. 798447.
[4] Daccarett M, McGann CJ, Akoum NW, et a1.MRI ofthe left atrium:predicting clinical outcomes in patients with atrial fibrillation[J].Expert Rev Cardiovasc Ther, 2011, 9(1): 105-111.DOI: 10. 1586/erc. 10. 177.
[5] McGann C, Akoum N, Patel A, et al. Atrial fibrillation ablation outcome is predicted by left atrial remodeling on MRI[J]. Circ Arrhythm Electrophysiol, 2014, 7(1): 23-30. DOI: 10. 1161/CIRCEP.113. 000689.
[6] Rostock T, Steven D, Lutomsky B, et a1.Atrial fibrillation begets atrial fibrillation in the pulmonary veins: on the impact of atrial fibrillation on the electrophysiological properties of the pulmonary veins in humans[J].J Am Coll Cardiol, 2008, 51(22): 2153-2160.DOI: 10. 1016/j. jacc. 2008. 02. 059.
[7] Dong J, Vasamreddy CR, Jayam V, et al. Incidence and predictors of pulmonary vein stenosis following catheter ablation of atrial fibrillation using the anatomic pulmonary vein ablation approach: results from paired magnetic resonance imaging[J]. J Cardiovasc Electrophysiol,2005, 16(8): 845-852. DOI: 10. 1111/j. 1540-8167. 2005. 40680. x.
[8] Hauser TH, Yeon SB, McClennen S, et al. Subclinical pulmonary vein narrowing after ablation for atrial fibrillation[J]. Heart, 2005, 91(5):672-673. DOI: 10. 1136/hrt. 2004. 039347.
[9] Hauser TH, Peters DC, Wylie MV, et al. Relationship of ostial pulmonary vein scar with reduction in pulmonary vein size after radiofrequency ablation for the treatment of atrial fibrillation: An observational cohort study[J]. J Atr Fibrillation, 2013, 5(6): 788. DOI:10. 4022/jafib. 788. eCollection 2013 Apr-May.
[10] Kallergis EM, Manios EG, Kanoupakis EM, et al. Extracellular matrix alterations in patients with paroxysmal and persistent atrial fibrillation:biochemical assessment of collagen type-I turnover[J]. J Am Coll Cardiol, 2008, 52(3): 211-215. DOI: 10. 1016/j. jacc. 2008. 03. 045.
[11] Yoshihara F, Nishikimi T, Sasako Y, et al. Plasma atrial natriuretic peptide concentration inversely correlates with left atrial collagen volume fraction in patients with atrial fibrillation: plasma ANP as a possible biochemical marker to predict the outcome of the maze procedure[J]. J Am Coll Cardiol, 2002, 39(2): 288-294.
[12] Burstein B, Nattel S. Atrial fibrosis: mechanisms and clinical relevance in atrial fibrillation[J]. J Am Coll Cardiol, 2008, 51(8): 802-809. DOI:10. 1016/j. jacc. 2007. 09. 064.
[13] 何衛, 董麗君, 許國軍, 等. 增齡和心房顫動所致的左心房結構重構與miRNA表達改變的相關性研究[J]. 中華心律失常學雜志, 2015,19(1): 60-64. DOI: 10. 3760/cma. j. issn. 1007-6638. 2015. 01. 016.
[14] Marsan NA, Maffessanti F, Tamborini G, et al. Left atrial reverse remodeling and functional improvement after mitral valve repair in degenerative mitral regurgitation: a real-time 3-dimensional echocardiography study[J]. Am Heart J, 2011, 161(2): 314-321. DOI:10. 1016/j. ahj. 2010. 10. 029.
[15] Gelsomino S, Luca F, Rao CM, et al. Improvement of left atrial function and left atrial reverse remodeling after surgical treatment of atrial fibrillation[J]. Ann Cardiothorac Surg, 2014, 3(1): 70-74. DOI: 10.3978/j. issn. 2225-319X. 2013. 12. 03.
[16] Pontecorboli G, Figueras I Ventura RM, Carlosena A, et al. Use of delayed-enhancement magnetic resonance imaging for fibrosis detection in the atria: a review[J]. Europace, 2017, 19(2): 180-189.DOI: 10. 1093/europace/euw053.
[17] Sohns C, Sohns JM, Vollmann D, et al. Left atrial volumetry from routine diagnostic work up prior to pulmonary vein ablation is a good predictor of freedom from atrial fibrillation[J]. Eur Heart J Cardiovasc Imaging, 2013, 14(7): 684-691. DOI: 10. 1093/ehjci/jet017.
[18] Cochet H, Scherr D, Zellerhoff S, et al. Atrial structure and function 5 years after successful ablation for persistent atrial fibrillation: an MRI study[J]. J Cardiovasc Electrophysiol, 2014, 25(7): 671-679. DOI: 10.1111/jce. 12449.

