高壓氧艙治療新生兒缺氧缺血性腦病的療效探討
李 娜,呂 艷,孟祥恩,郭大志,潘樹義
高壓氧艙治療新生兒缺氧缺血性腦病的療效探討
李 娜,呂 艷,孟祥恩,郭大志,潘樹義
目的探討高壓氧艙治療新生兒缺氧缺血性腦病的臨床效果。方法2013-01至2017-02選擇住院治療的130例新生兒缺氧缺血性腦病作為研究對象,按照隨機數字法分為對照組和觀察組,每組65例,對照組給予常規對癥支持治療,觀察組在對照組治療的基礎上給予高壓氧艙治療,兩組都治療觀察3個月。結果治療后觀察組與對照組的總有效率分別為98.5%和81.5%,觀察組的總有效率高于對照組(P<0.05)。治療后觀察組與對照組的MMSE評分分別為(89.45±5.39)分和(78.20±6.14)分,都明顯高于治療前的(65.23±8.14)分和(65.11±7.89)分(P<0.05),治療后觀察組的MMSE評分明顯高于對照組(P<0.05)。治療后兩組的血清肌酸激酶、乳酸脫氫酶及肌酸激酶同工酶含量都明顯低于治療前(P<0.05),治療后觀察組的各指標也明顯低于對照組(P<0.05)。兩組治療后NOX2灰度比值和ROS較治療前均顯著降低,觀察組治療后NOX2灰度比值(0.37±0.06)顯著低于對照組(0.42±0.09)(P<0.05),ROS(518.85±54.48)U/ml顯著低于對照組(551.28±69.93)U/ml(P<0.05)。結論高壓氧艙治療新生兒缺氧缺血性腦病能改善患兒的心肌功能,抑制氧化應激作用,從而提高治療效果,促進認知功能的改善,有很好的應用價值。
高壓氧艙;新生兒缺氧缺血性腦病;心肌功能;氧化應激
新生兒缺血缺氧性腦病是臨床上較為常見的新生兒傷殘乃至死亡的重要因素,是由于新生兒分娩過程中發生缺血缺氧,出現低氧血癥酸中毒從而引起各器官功能障礙甚至實質性病變。隨著我國高齡產婦與二胎產婦的增多,新生兒缺血缺氧性腦病在我國的發病人數也在增加[1,2]。現代醫學經過了快速的發展,新生兒缺血缺氧性腦病的存活率得到了明顯提高,但是致殘率一直居高不下[3,4]。特別是新生兒缺血缺氧性腦病出現心功能損傷,疾病可進一步惡化,難以及時搶救,可導致終身殘疾[5]。當前對于新生兒缺血缺氧性腦病的治療方法包括改善腦循環、神經保護劑、康復治療等,研究顯示磷酸肌酸鈉在體內能生成ATP改善能量代謝,維持心肌細胞活性,保證心肌收縮力,從而達到改善心肌功能的效果[6,7]。單唾液酸四己糖神經節苷酯鈉可改善腦血流動力學參數和損傷后腦水腫,對損傷后繼發性神經退化有保護作用[8,9]。高壓氧艙治療能增加血氧含量和血氧彌散力,提高腦組織氧張力,糾正腦缺氧狀態。不過當前高壓氧艙在新生兒缺血缺氧性腦病中的應用報道還不多,具體的作用機制也不太明確[10]。有研究表明新生兒腦缺血缺氧常引起氧化應激,從而加重缺血缺氧過程,形成惡性循環,故控制氧化應激反應成為治療疾病的根本辦法[11,12]。本研究具體探討了高壓氧艙治療新生兒缺氧缺血性腦病的臨床效果與相關機制,現報道如下。
1 對象與方法
1.1 對象 2013-01至2017-02選擇我院治療的130例新生兒缺氧缺血性腦病作為研究對象,(1)納入標準:患兒家長知情同意本研究;符合新生兒缺血缺氧性腦病的診斷標準(出現子宮內呼吸窘迫的臨床表現或分娩時出現窒息;臍動脈持續血氣分析≤7.0,胎兒伴有重度窒息也就是1 min Apgar評分<3分;出生后短時間內發生神經系統功能損傷癥狀,并且持續時間≥24 h;靜息狀態下胎兒心率>100次/min,持續時間大于5 min或水重度污染);腦電圖、B超、CT、MRI均顯示有缺血缺氧性腦部變化;出現心肌功能損傷或出現新生兒窒息等并發癥狀;出現肌張力改變及異常反射狀態及呼吸功能改變,瞳孔大小異常及對光反射消失;研究得到醫院倫理委員會的批準。(2)排除標準:存在腦代謝性疾病等病變;伴有先天性遺傳性心臟病等心肌損傷;出現先天性顱腦畸形或腦回功能性或器質性損壞;腫瘤,血液系統疾病等嚴重癥狀。按照隨機數字表法分為對照組和觀察組,每組65例,兩組患兒的性別、日齡、分娩孕周、分娩方式、體重、1 min Apgar評分等對比差異無統計學意義(P>0.05,表1)。
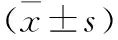
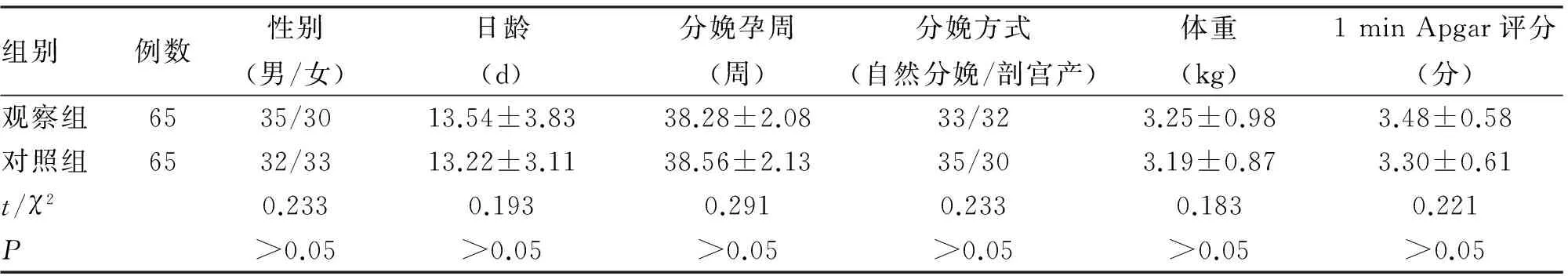
組別例數性別(男/女)日齡(d)分娩孕周(周)分娩方式(自然分娩/剖宮產)體重(kg)1minApgar評分(分)觀察組6535/3013.54±3.8338.28±2.0833/323.25±0.983.48±0.58對照組6532/3313.22±3.1138.56±2.1335/303.19±0.873.30±0.61t/χ20.2330.1930.2910.2330.1830.221P>0.05>0.05>0.05>0.05>0.05>0.05
注:對照組采用常規對癥支持治療;觀察組采用常規對癥支持治療并輔以高壓氧艙治療
1.2 治療方法 (1)對照組:給予常規對癥支持治療,低流量吸氧,保證內環境穩定性,降低顱內壓,維持電解質平衡;給予唾液酸四己糖神經節苷酯鈉[7](齊魯制藥有限公司)治療,20~40 mg/d,遵醫囑一次或分次肌內注射或緩慢靜脈滴注;給予磷酸肌酸鈉(吉林英聯藥業)治療,1.0 g/d。(2)觀察組:在對照組治療的基礎上給予高壓氧艙治療,選擇我院高壓氧科三艙七門型高壓氧艙,治療壓力1.6 ATA,每次治療周期60 min,連續吸氧40 min, 10 min減壓后出艙,1/d,周一至周五治療。兩組都治療觀察3個月。
1.3 觀察指標 (1)療效標準判定,顯效:患兒癥狀體征消失,神經功能恢復2級以上;有效:患兒癥狀體征明顯改善,神經功能恢復1級;無效:無達到上述標準甚或惡化者。(有效+顯效)/總例數×100.0%=總有效率。(2)認知功能評定:在治療前后選擇簡易智力狀態檢查量表(MMSE)進行認知缺損篩選評定,分數越高,認知功能越好。(3)在治療前后進行血清心肌酶的測定,包括肌酸激酶、乳酸脫氫酶、肌酸激酶同工酶等。(4)氧化應激指標檢測:在治療前后進行血清煙酰胺腺嘌呤二核苷酸磷酸氧化酶(NOX2灰度比值)與活性氧(ROS)的測定。
2 結 果
2.1 總有效率比較 治療后觀察組與對照組的總有效率分別為98.5%和81.5%,觀察組的總有效率高于對照組(P<0.05,表2)。
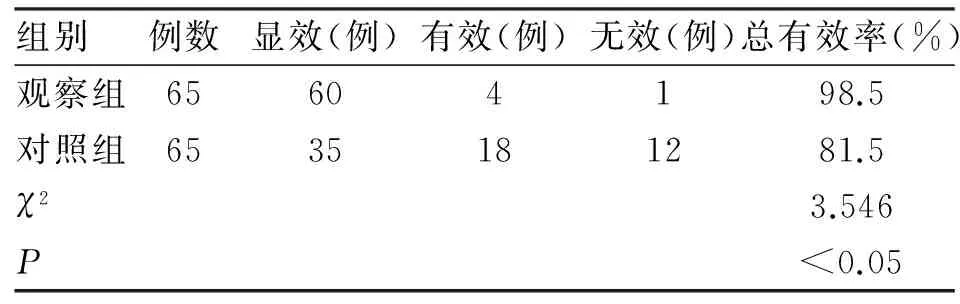
表2 兩組新生兒缺氧缺血性腦病患者治療總有效率對比
2.2 MMSE評分變化對比 治療后觀察組與對照組的MMSE評分分別為(89.45±5.39)分和(78.20±6.14)分,都明顯高于治療前的(65.23±8.14)分和(65.11±7.89)分(P<0.05),治療后觀察組的MMSE評分明顯高于對照組(P<0.05)。
2.3 血清酶譜變化對比 治療后兩組的血清肌酸激酶、乳酸脫氫酶及肌酸激酶同工酶含量都明顯低于治療前(P<0.05),治療后觀察組的各指標也明顯低于對照組(P<0.05,表3)。
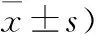
表3 兩組新生兒缺氧缺血性腦病患者治療前后血清酶譜變化對比 (U/ml;
2.4 NOX2與ROS含量變化對比 兩組治療后NOX2灰度比值和ROS較治療前均顯著降低,觀察組治療后NOX2灰度比值顯著低于對照組(P<0.05),ROS顯著低于對照組 (P<0.05,表5)。
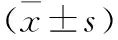
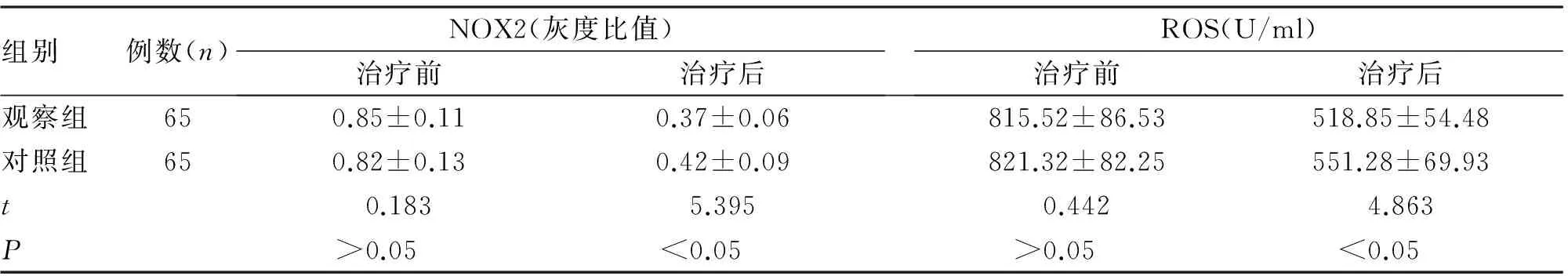
組別例數(n)NOX2(灰度比值)治療前治療后ROS(U/ml)治療前治療后觀察組650.85±0.110.37±0.06815.52±86.53518.85±54.48對照組650.82±0.130.42±0.09821.32±82.25551.28±69.93t0.1835.3950.4424.863P>0.05<0.05>0.05<0.05
3 討 論
當前我國新生兒缺氧缺血性腦病的發生率有逐漸增高的趨勢,雖然隨著診治技術的提高,新生兒缺氧缺血性腦病的病死率有明顯降低,但是存活新生兒往往留有不同程度的功能障礙,嚴重影響其生活質量[13]。從發病機制上分析,缺氧缺血性腦病可導致新生兒機體無法維持正常血壓穩定性,降低組織微環境血流灌注,造成心肌缺血缺氧-心肌射血降低-組織微環境低灌注惡性循環,阻礙血液循環,加重患兒病情[14]。不過新生兒機體各組織器官細胞具有再生能力,若能早期發現并及時治療,可使受損組織恢復正常功能,若未及時進行治療,造成心肌不可逆損傷,造成嚴重預后[15]。Apgar評分作為現時全世界最普遍使用的新生兒健康評估標準在國際上早已被認可,在很多評分結果一致的情況下,給不同患兒評分所涉及和使用的具體指標是不同的;但是作為統一的評分標準,其1 min Apgar評分<3分者均為重度窒息,表示的嚴重程度是一致的,故本研究將此列為患兒的入選標準。
在常規藥物治療中,單唾液酸四己糖神經節苷酯鈉屬于親脂性化學物質,可改善腦血流動力學參數和損傷后腦水腫,能與細胞膜緊密結合,在缺血缺氧性腦病中的應用比較多見[16]。磷酸肌酸鈉具有抑制溶血酯酶作用,可增加心肌磷脂穩定性,減少氧化自由基對心肌細胞造成的損傷。高壓氧艙療法是一種物理療法,其是將患兒放置在比大氣壓高的氣壓環境下吸入純氧或高濃度氧,利用增加血液中的溶解氧量來達到改善預后的效果[17]。高壓氧的應用不但可以使腦血管收縮,減少腦血流量;也可減輕腦組織的繼發損害,阻斷顱內壓增高和腦水腫之間的惡性循環,迅速改善腦水腫癥狀[18]。本研究顯示治療后觀察組與對照組的總有效率分別為98.5%和81.5%,觀察組的總有效率高于對照組(P<0.05)。治療后觀察組與對照組的MMSE評分分別為89.45±5.39分和78.20±6.14分,都明顯高于治療前的65.23±8.14分和65.11±7.89分(P<0.05),治療后觀察組的MMSE評分明顯高于對照組(P<0.05)。相關研究也表明高壓氧艙療法可以有效地增加氧的彌散程度,恢復可逆的受損傷的神經元,增加組織對氧的利用,加快患兒認知功能的改善[19,20]。
機體正常氧供情況下心肌能量代謝主要為有氧代謝,當發生新生兒缺血缺氧時,心肌代謝方式可轉變為無氧糖代謝,進而影響氧化磷酸化,從而形成以缺血缺氧-能量代謝降低-高能磷酸鍵合成減少為主的惡性循環,加重心肌細胞缺血[21]。在藥物治療中,磷酸肌酸鈉是機體細胞能量補充的主要來源,可在細胞膜、線粒體內膜、肌漿網等多處膜性結構中完成能量供應,保護心肌細胞結構以及維持細胞膜穩定性,達到快速能量供應與維持細胞代謝的目的,減少缺血缺氧造成的危害[22]。心肌血清酶譜是檢測心肌壞死以及細胞膜通透性的重要指標,當心肌酶譜水平顯著提升時提示機體存在心肌細胞壞死,細胞膜通透性顯著增加[23]。高壓氧艙療法主要是通過提高缺血組織氧供,糾正組織的低氧血癥,促進側支循環建立和血腦屏障功能的恢復[24]。臨床研究表明高壓氧艙療法能增加腦部局部缺血組織供氧量,促進細胞生理功能恢復,改善細胞能量供應,從而改善心肌功能[25]。本研究顯示治療后兩組的血清肌酸激酶、乳酸脫氫酶及肌酸激酶同工酶含量都明顯低于治療前(P<0.05),治療后觀察組的各指標也明顯低于對照組(P<0.05),也表明高壓氧的應用能促進改善缺氧缺血性腦病新生兒的心肌功能。
新生兒缺氧缺血性腦病初期,腦部組織由于缺血缺氧,可影響電子傳遞功能而產生自由基;同時部分氧合血紅蛋白因紅細胞裂解而釋放,生成大量自由基,從而產生催化生化反應,使神經細胞及髓鞘的結構與功能受到損害[26]。研究表明NOX2與ROS在氧化應激過程中活化,在缺血缺氧解除,組織微環境發生血流再灌注時通過線粒體途徑產生大量NOX2與ROS,造成細胞破壞,故通過測量NOX2與ROS含量是檢測氧化應激水平的重要手段[27]。本研究顯示兩組治療后NOX2灰度比值和ROS較治療前均顯著降低,觀察組治療后NOX2灰度比值顯著低于對照組(P<0.05),ROS也顯著低于對照組(P<0.05)。從機制上分析,高壓氧能提高氧含量、氧儲備量和氧分壓,增加損傷組織的組織氧張力,改善微循環,增加氧的彌散能力及范圍,提高超氧化物歧化酶的含量,從而有效清除氧自由基,有利于新生兒恢復健康[28]。本研究的不足之處在于樣本量過少,從而導致高壓氧艙療法的隨訪長期效果有待進一步確定。
總之,高壓氧艙治療新生兒缺氧缺血性腦病能改善患兒的心肌功能,抑制氧化應激作用,從而提高治療效果,促進認知功能的改善,有很好的應用價值。
【參考文獻】
[1] Neves A L, Henriques-Coelho T, Leite-Moreira A,etal.Cardiac injury biomarkers in paediatric age: Are we there yet?[J].Heart Fail Rev,2016,21(6):771-781.
[2] Bhorat I E, Bagratee J S, Pillay M,etal.Determination of the myocardial performance index in deteriorating grades of intrauterine growth restriction and its link to adverse outcomes[J].Prenat Diagn,2015 ,35(3):266-273.
[3] 章 櫻,陳國慶,張 勤.磷酸肌酸鈉對新生兒缺氧缺血性腦病氧化應激的影響及心肌損傷的保護作用[J].中華全科醫學,2016,14(5):786-789.
[4] Hochwald O, Jabr M, Osiovich H,etal.Preferential cephalic redistribution of left ventricular cardiac output during therapeutic hypothermia for perinatal hypoxic-ischemic encephalopathy[J].J Pediatr,2014,164(5):999-1004.
[5] Montaldo P, Rosso R, Chello G,etal.Cardiac troponin I concentrations as a marker of neurodevelopmental outcome at 18 months in newborns with perinatal asphyxia[J].J Perinatol,2014,34(4):292-295.
[6] Ameri K, Rajah A M, Nguyen V,etal.Nuclear localization of the mitochondrial factor HIGD1A during metabolic stress[J].PLoS One,2013,8(4):e62758.
[7] Simovic A M, Igrutinovic Z, Obradovic S,etal.The significance of second generation cardiac troponin I in early screening of hypoxic-ischemic encephalopathy after perinatal asphyxia[J].Srp Arh Celok Lek,2012,140(9-10):600-605.
[8] 徐 晨.苯巴比妥與高壓氧治療新生兒缺氧缺血性腦病的療效觀察[J].中國實用神經疾病雜志,2017,20(7):105-107.
[9] Robertson N J, Kato T, Bainbridge A,etal.Methyl-isobutyl amiloride reduces brain Lac/NAA, cell death and microglial activation in a perinatal asphyxia model[J].J Neurochem,2013,124(5):645-657.
[10] Vijlbrief D C, Benders M J, Kemperman H,etal.Cardiac biomarkers as indicators of hemodynamic adaptation during postasphyxial hypothermia treatment[J].Neonatology,2012,102(4):243-248.
[11] 江秀云.高壓氧對新生兒缺氧缺血性腦病血液流變學的影響[J].中國實用神經疾病雜志,2017,20(11):105-107.
[12] Mirza M A, Ritzel R, Xu Y,etal.Sexually dimorphic outcomes and inflammatory responses in hypoxic-ischemic encephalopathy[J].Journal of Neuroinflammation,2015,12(1):1121-1130.
[13] 劉正艷.高壓氧療法對新生兒缺氧缺血性腦病患兒行為神經功能和智能發育的影響[J].中國實用神經疾病雜志,2017,20(4):98-100.
[14] Li Y, Zhang P, Liu Y,etal.Helium preconditioning protects the brain against hypoxia/ischemia injury via improving the neurovascular niche in a neonatal rat model[J].Behav Brain Res,2016,1(314):165-172.
[15] Chen J, Chen Y H, Lv H Y,etal.Effect of hyperbaric oxygen on lipid peroxidation and visual development in neonatal rats with hypoxia-ischemia brain damage[J].Biomed Rep,2016,5(1):136-140.
[16] Kidani Y, Miki Y, Nomimura N,etal.The therapeutic effect of CD133 +, cells derived from human umbilical cord blood on neonatal mouse hypoxic-ischemic encephalopathy model[J].Life Sciences, 2016, 157(45):108-115.
[17] Aggarwal S, Natarajan G.Biventricular function on early echocardiograms in neonatal hypoxic-ischaemic encephalopathy[J].Acta Paediatr,2017,106(7):1085-1090.
[18] Nestaas E, Skranes J H, St?ylen A,etal.The myocardial function during and after whole-body therapeutic hypothermia for hypoxic-ischemic encephalopathy, a cohort study[J].Early Hum Dev,2014,90(5):247-252.
[19] 蔡肇雄.神經節苷脂鈉聯合高壓氧治療在新生兒缺氧缺血性腦病治療中應用效果[J].現代診斷與治療,2017,14(2):249-250.
[20] Ostrowski R P, St?pień K, Pucko E,etal.Hyperbaric oxygen modalities are differentially effective in distinct brain ischemia models[J].Med Gas Res,2016,6(1):39-47.
[21] Gamdzyk M, Ziembowicz A, Bratek E,etal.Combining hypobaric hypoxia or hyperbaric oxygen postconditioning with memantine reduces neuroprotection in 7-day-old rat hypoxia-ischemia[J].Pharmacol Rep,2016,68(5):1076-1083.
[22] Li Y, Liu K, Kang Z M,etal.Helium preconditioning protects against neonatal hypoxia-ischemia via nitric oxide mediated up-regulation of antioxidases in a rat model[J].Behav Brain Res,2016,1(300):31-37.
[23] Zhu M, Lu M, Li Q J,etal.Hyperbaric oxygen suppresses hypoxic-ischemic brain damage in newborn rats[J].J Child Neurol,2015,30(1):75-82.
[24] 梁 格.神經節苷酯輔治新生兒缺氧缺血性腦病近期療效及對神經功能修復的影響[J].中國實用神經疾病雜志,2016,19(20):60-61.
[25] Stetler R A, Leak R K, Gan Y,etal.Preconditioning provides neuroprotection in models of CNS disease:paradigms and clinical significance[J].Prog Neurobiol,2014,3(114):58-83.
[26] Feng Z, Liu J, Ju R.Hyperbaric oxygen treatment promotes neural stem cell proliferation in the subventricular zone of neonatal rats with hypoxic-ischemic brain damage[J].Neural Regen Res,2013,8(13):1220-1227.
[27] 黃維清,彭小明,常淑婷,等.新生兒重度缺氧缺血性腦病123例臨床與隨訪分析[J].中國新生兒科雜志,2016,31(2):120-124.
[28] Liu X H, Yan H, Xu M,etal.Hyperbaric oxygenation reduces long-term brain injury and ameliorates behavioral function by suppression of apoptosis in a rat model of neonatal hypoxia-ischemia[J].Neurochem Int,2013,62(7):922-930.
[29] Lobo N, Yang B, Rizvi M,etal.Hypothermia and xenon: novel noble guardians in hypoxic-ischemic encephalopathy?[J].J Neurosci Res,2013,91(4):473-478.
(2017-08-24收稿 2017-11-20修回)
Theclinicalstudyofhyperbaricoxygeninthetreatmentofneonatalhypoxicischemicencephalopathy
LI Na, LV Yan, MENG Xiangen, GUO Dazhi, and PAN Shuyi.Department of Hyperbaric Oxygen,Navy General Hospital, Beijing 100048, China
ObjectiveTo investigate the clinical effect of hyperbaric oxygen in the treatment of neonatal hypoxic ischemic encephalopathy.MethodsBetween January 2013 and February 2017, 130 cases of neonatal hypoxic ischemic encephalopathy were selected as subjects, who were randomly divided into control group and observation group with 65 cases in each. The control group was given routine symptomatic treatment, while the observation group was additionally given hyperbaric oxygen therapy. Both groups were observed for three months.ResultsAfter treatment, the total effective rates in the observation group and the control group were 98.5% and 81.5%, respectively.After treatment, the MMSE scores in the observation group and the control group were 89.45±5.39 points and 78.20±6.14 points, compared with 65.23±8.14 points and 65.11±7.89 points before treatment (P<0.05).The levels of serum CK, LDH and CK were significantly lower after treatment in the two groups (P<0.05), and the indexes in the observation group were significantly lower after treatment than those in the control group (P<0.05).The NOX2 gray ratio and ROS in the two groups were significantly lower after treatment.The NOX2 gray ratio (0.37±0.06) in the observation group was significantly lower after treatment than in the control group (0.42±0.09) (P<0.05). ROS (518.85±54.48) U/ml in the observation group was also significantly lower than in the control group (551.28±69.93) U/ml (P<0.05).ConclusionsHyperbaric oxygen, when used in the treatment of neonatal hypoxic ischemic encephalopathy, can improve myocardial function while inhibiting oxidative stress, thus improving the therapeutic effect and promoting cognitive function, so it has good applicability.
hyperbaric oxygen; neonatal hypoxic ischemic encephalopathy; myocardial function; oxidative stress
李 娜,碩士,主治醫師。
100048 北京,海軍總醫院高壓氧科
潘樹義,E-mail:psy9992011@163.com
R459.6
梁秋野)

