染色體核型改變在不同類型白血病診斷與治療及預后判斷中的臨床意義
高 娟
(重慶市九龍坡區中醫院檢驗科 400016)
白血病為體內造血干細胞發生突變造成的克隆性惡性腫瘤,是臨床較為常見的腫瘤之一。當前對于白血病病因尚不完全清楚,但已經證實白血病從細胞的起源、分化到生物學行為的不同而導致白血病的特異性非常高[1-2]。為了準確、客觀地反映這種生物學特性,白血病的診斷分型由最初單純以形態學為主的分型(FAB分型)發展為形態學、免疫學、細胞遺傳學和分子生物學聯合起來進行的MICM分型。以前對白血病的診斷一般是依據患者臨床特征和骨髓組織檢測、骨髓細胞形態學和血液學,患者誤診率比較高,對患者疾病進展與預后提供的參考價值非常有限。目前隨著分子生物學和細胞遺傳學等新技術的發展,人們發現白血病發生和體內染色體異常有直接關系,對患者染色體進行分析能夠顯示其惡性克隆印記,細胞遺傳學比細胞免疫學與形態學表型更精準地對白血病亞型與分類進行區分,特異性染色體異常對患者選擇不同治療措施也非常重要。從第一個和白血病有關的Ph染色體被發現以來,患者血液惡性腫瘤診療中已廣泛使用細胞遺傳學進行檢測[3]。本文通過R顯帶技術對白血病染色體核型進行分析,探討其對不同類型白血病診斷與治療及預后判斷的臨床意義。
1 資料與方法
1.1一般資料 選取2011年2月至2016年2月在本院接受治療的白血病患者367例,其中慢性粒細胞白血病患者(CML)共137例,男78例,女59例,平均年齡(50.3±8.4)歲,其中加速期(AP)患者6例,慢性期(CP)患者117例,急變期患者(BP)14例;急性白血病(AL)患者230例,男109例,女121例,平均年齡(43.6±7.9)歲,其中急性髓細胞白血病(AML)患者119例,包含M1~M7分別為11、42、39、10、13、2、2例,急性淋巴細胞白血病(ALL)患者111例,包含L1~L3分別為29、54、28例。患者診療均依據《血液病診斷及療效準則》[4]。
1.2儀器與試劑 設備:-20 ℃冰箱(日本三洋公司)、光學顯微鏡(日本Olympus公司)、臺式自動平衡離心機(北京醫用離心機工廠)、白瓷顯帶缸(蘇州高頻電瓷廠)、電熱恒溫鼓風干燥箱(上海躍進醫療廠)。配置試劑:RPMI1640培養液、0.3%肝素、白細胞稀釋液、秋水仙胺溶液、Earle′s溶液和吉姆薩染液。
1.3方法
1.3.1收集標本 本研究收集標本為患者骨髓,其抽取數量依據患者外周血白細胞數量高低來確定,通常是2~4 mL。當患者體內白細胞總數量>9×109/mL,幼細胞、原細胞百分比大于11%,可使用外周的血液來培養[5]。
1.3.2制備染色體[6]本文使用短期培養法來進行:使用無菌注射器收集外周血2~4 mL或者骨髓液放入肝素抗凝試管中而后放入1640培養瓶內,進行細胞培養24 h。而后進行阻留中期分裂、收獲細胞進行低滲、固定3次,最后把第3次固定標本以1 000 r/min進行10 min離心,棄掉上清液,加入適當的固定液制作成細胞的懸液,在4 ℃的冰箱內進行保存。
1.3.3染色體R顯帶[7](1)進行制片:使用吸管把細胞懸液處理均勻以后,從15 cm高處滴至經過25%乙醇或者冰水浸泡過的無脂載玻片內,一個載玻片上滴兩滴,在酒精燈火焰上經過幾次,使其變得干燥;(2)使用50 mL白瓷立式染缸加入pH為6.6的Earle′s溶液,蓋上蓋子在水浴箱內加熱到88 ℃;(3)把制作好載玻片放入上述染缸內2 h;(4)取出載玻片晾干以后加入11% Giemsa溶液進行15 min染色,清水沖洗,載玻片干燥后在顯微鏡下進行觀察。
1.3.4分析染色體的核型 使用顯微鏡對患者染色體核型進行分析,每例患者分析15個中期分裂細胞,察看染色體是否出現異常。使用顯微相機對染色體核型進行拍照,依次排列成核型。根據《人類細胞遺傳學國際命名體制》對核型進行描述[8]。
1.3.5患者的治療效果準則 完全緩解:患者體征與臨床癥狀消失,骨髓內早幼及原粒含量低于5%,血小板計數>105×109/L,外周血液內中性粒細胞絕對值>1.6×109/L;部分緩解(PR):完全緩解中有一項沒有達到相應標準;未緩解(NP):完全緩解中所有項目都沒有達到相應標準。CML完全遺傳學緩解(CCyR):患者骨髓內沒有Ph陽性細胞;部分遺傳學的緩解(MCR):骨髓內Ph陽性細胞含量在35%以下。
1.4統計學處理 采用SPSS19.0統計軟件進行數據分析,計數資料以率表示,采用χ2檢驗進行比較,以P<0.05為差異有統計學意義。
2 結 果
2.1367例患者染色體的核型特征 367例患者中染色體核型異常有302例(82.3%),核型正常有65例(17.7%),見表1。
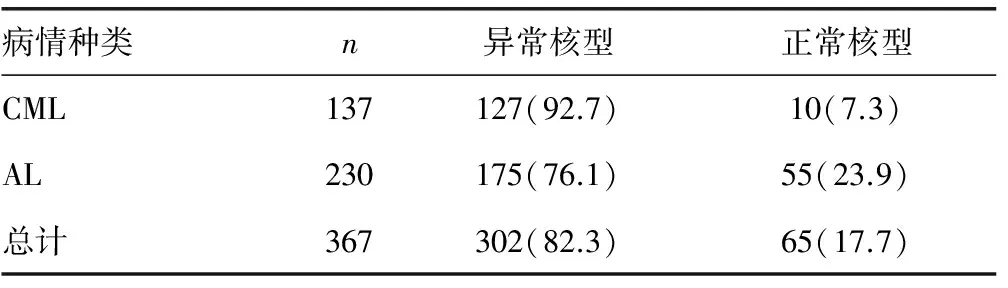
表1 患者染色體的核型情況對比[n(%)]
2.2AL患者染色體核型特征 AL患者中染色體核型特征,見表2。其中數目異常是非整倍體和多倍體表征,比如-Y、+4、+8、+21和-7等(圖1)。結構異常主要是特異性染色體重新排列而且和FAB亞型有聯系,比如t(q23;q23)(9;20)、t(q23;q23)(9;20)等。少部分的患者檢查發現t(q33;q10)(8;21)、t(p13;p12)(7;15)、t(q22;p14)(2;18)等,見圖2。

表2 AL患者核型特征情況對比(n=175)
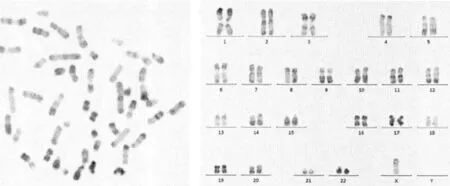
圖1 ALL患者的染色體核型 46,X,-Y
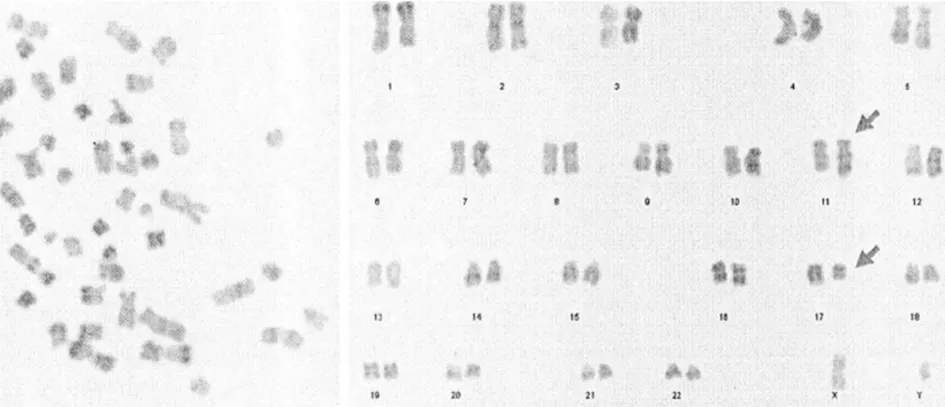
圖2 ALL患者骨髓細胞的R顯帶核型45,XY,t(q12;q19)(10;18)
2.3CML患者染色體的核型特征 137例CML患者異常核型情況,見表3。114例Ph陽性表現是典型易位t(q32;q9)(10;19),見圖3;剩余表現為變異易位比如t(q11;q32;q9)(3;8;19)、t(p23;q9)(2;21)等,見圖4。

表3 CML患者異常的核型情況對比
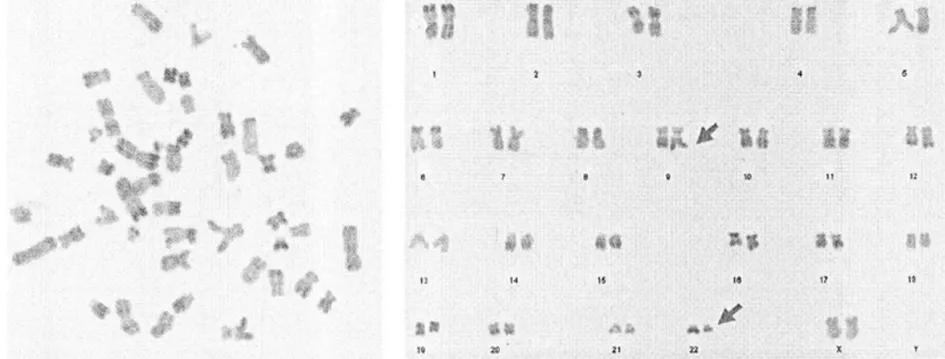
圖3 CML患者染色體核型異常
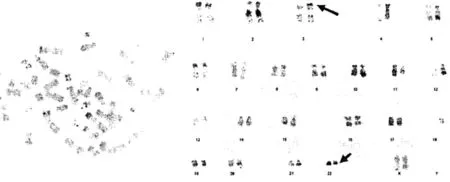
圖4 CML患者骨髓細胞的R顯帶核型
2.4CML患者的染色體的核型變化特征 114例Ph陽性患者內檢測出24例有額外染色體出現,慢性期患者中有8例,加速期患者中有5例,急變期患者中有11例,多見與+21、+9和2Ph等,CML患者病程發展與出現的額外染色體有緊密聯系,見表4。

表4 CML患者的染色體的核型變化特征情況對比
注:與慢性期對比,#P<0.05
2.5患者治療效果和染色的體核型變化情況 AML-M3有t(15;17)患者中經過全反式維甲酸分化治療后24例(24/29)得到緩解,而M3型患者中不伴隨此異常核型患者緩解1例(1/10)對比,差異有統計學意義(P<0.05)。AML-M2有t(9;19)患者中緩解的有29例(29/34),而不伴隨此核型異常8例患者均沒有緩解,對比差異有統計學意義(P<0.05)。
3 討 論
當前MICM分型能夠更好地對白血病本質進行反映,結合FAB分型來確認AL亞型,對患者治療和預后有重要影響。通過細胞遺傳學對白血病進行研究不僅對患者病情分型、治療和預后有幫助,還能夠顯示出和疾病相關的新基因與基因位點,對病情的發生、進展和惡性克隆有更深刻的認知[9-11]。特別是通過使用免疫學、形態學和細胞遺傳學聯合檢測與靶向的治療給難治或復發老年AL患者帶來了新希望。MANOLA[12]總結了近些年來文獻中所研究的常見急性白血病的染色體異常,認為t(8;21)(q22;q22)、t(15;17)(q22;21q)、inv(16)(p13;q22)等預后良好;正常核型、+8、del(7q)、MLL等顯示中等預后;而-5/del(5q)、-7、t(9;11)(p22;q23)等染色體異常顯示預后不良或較差。
本文使用細胞遺傳學對230例AL患者進行檢測發現,有175例患者出現了染色體核型異常,檢測出結構異常最多是t(14;16),在AML-M3中較為常見,還有一部分患者伴隨復雜異常。AML-M3為異性性非常高的白血病,患者體內t(14;16)是否存在對其治療有重要影響,而使用砷劑與維甲酸對有此易位患者治療效果非常顯著。t(7;19)易位多見于AML-M2,患者體內檢查到t(7;19)發生易位時對化療會很敏感,患者生存時間和緩解率均非常好,比其他染色體發生畸變緩解率都要高[13]。在WHO分型內,t(7;19)是顯示預后較好的染色體之一。CML是造血干細胞異質性較高的一種疾病,CML患者體內比較特征標志物是Ph的染色體,同時也是依據Ph染色體來對CML進行診斷。依據Ph染色體不僅能夠對骨髓增生綜合征、CML和類白血病的反應進行區分,還能夠把CML分為Ph陰性與Ph陽性不同類型[14-15]。本研究發現,大多數Ph陽性患者表現是典型易位,剩余很少一部分患者是變異異位,包含復雜變異異位與簡單變異異位,而分析生物學調查也表示復雜變異異位內有相同分子病理學變化,它們在患者預后、臨床和血液學等方面表現基本一樣。伴隨著患者病情發展,急變期和加速期患者體內會發生染色體核型變化,表現為出現了Ph染色體以后其他克隆性染色體發生異常,還會合并有額外染色體出現,這些變化與患者病情發展聯系緊密。
綜上所述,AL患者體內染色體畸變率比較高,還和FAB分型相關;CML患者體內出現額外染色體和其病情發展有密切聯系。
[1]郝潔,楊元發,劉維凱.慢性粒細胞白血病患者骨髓細胞染色體核型的變化分析[J].基層醫學論壇,2015,19(29):4033-4034.
[2]MATNANI R,PAREKH V,BORATE U,et al.Therapy-related B-lymphoblastic leukemia associated with Philadelphia chromosome and MLL rearrangement:Single institution experience and the review of the literature[J].Pathol Int,2015,65(10):536-540.
[3]劉黔偉,魏輝.白血病發生發展過程中的克隆演變[J].癌癥進展,2015,13(3):251-254.
[4]丁懿,李萍,張文君,等.同濟96方案序貫治療Ph染色體陰性成人急性淋巴細胞白血病療效分析[J].中華血液學雜志,2015,36(4):272-276.
[5]KOHLA S A,SABBAGH A A,OMRI H E,et al.Mixed phenotype acute leukemia with two immunophenotypically distinct B and T blasts populations,double Ph+chromosome and complex karyotype:report of an unusual case[J].Clin Med Insights Blood Disord,2015,8(1):25-31.
[6]李靜.關于慢性粒細胞白血病染色體的核型臨床研究[J/CD].臨床醫藥文獻電子雜志,2016,3(34):6747-6750.
[7]SHORT N J,KANTARJIAN H M,SASAKI K A,et al.Poor outcomes associated with+1der(22) t(9;22) and-9/9p in patients with Philadelphia chromosome-positive acute lymphoblastic leukemia receiving chemotherapy plus a tyrosine kinase inhibitor[J].Am J Hematol,2017,92(3):238-243.
[8]周蘭蘭,潘學誼,郭煜.48例急性混合細胞表型白血病患者的臨床特征及預后[J].山東大學學報(醫學版),2017,55(2):79-83.
[9]DING B,ZHOU L,JIANG X,et al.The relationship between clinical feature,complex immunophenotype,chromosome karyotype,and outcome of patients with acute myeloid leukemia in China[J].Dis Markers,2015,6(2):1-10.
[10]吳蔚,顧健,馬莉,等.細胞遺傳學檢測在慢性粒細胞白血病中的應用價值[J].中華全科醫學,2015,13(8):1320-1322.
[11]CHEBIHI Z T,BELKHAYAT A,EL-KABABRI M,et al.P 1:pediatric acute lymphoblastic leukemia with Philadelphia chromosome in Morocco:experience of BIOLAB laboratory[J].Clin Cancer Investig J,2015,55(6):173-177.
[12]MAUOLA K N.Cytogeneties of pediatric acute myeloid leukemia[J].Eur J Haematol,2009,83(9):391-405
[13]吳海英,任莉,陶疊紅,等.Ph+急性單核細胞白血病伴復雜核型病例并文獻復習[J].全科醫學臨床與教育,2015,28(3):348-350.
[14]王娟,張龑莉,胡杰英,等.慢性髓系白血病患者染色體核型分析[J].白血病·淋巴瘤,2016,25(4):220-223.
[15]蔡文治,劉彬,徐楊,等.Ph+急性淋巴細胞白血病ABL激酶區突變患者的臨床、分子遺傳學特征和治療選擇[J].中華血液學雜志,2016,37(2):105-109.

