多元弱酸酸式酸根離子的水解和電離
王 明
(重慶市育才中學校 400050)
一、以書為據
仔細分析和研讀教材,選修4教材第42頁到43頁,通過“實驗3-2”,可以得出結論:①弱酸的強度可以從其K電離的大小來比較,K電離越大,酸性越強;②多元弱酸比較酸性強弱時,通常只考慮第一步電離.選修4教材第53頁,“科學視野”中引入了水解平衡的相關概念和計算方法,可以得出結論:①K水解=Kw/K電離;②K水解越大,對應的離子越容易水解.所以,上面涉及到的問題,只要給出弱酸的逐級電離平衡常數,利用高中知識即可以定量計算得出多元弱酸的酸式酸根離子到底是以電離為主,還是以水解為主.
二、定量驗證
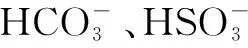

化學式H2SO3H2CO3H3PO4K電離Ka1=1.3×10-2Ka2=6.3×10-8Ka1=4.2×10-7Ka2=5.6×10-11Ka1=7.6×10-3Ka2=6.3×10-8Ka3=4.4×10-13
驗證過程如下:
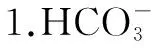
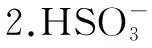
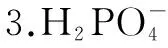
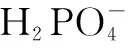
三、驗證過程的推廣和應用
例1 酒石酸(C4H6O6,簡寫為RH2)是一種重要的有機酸,廣泛用于醫藥、食品、制革等工業.已知:25℃時,各物質的電離平衡常數(K)如下表所示:
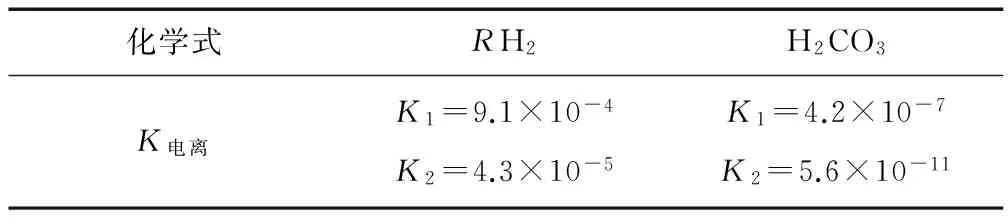
化學式RH2H2CO3K電離K1=9.1×10-4K2=4.3×10-5K1=4.2×10-7K2=5.6×10-11
25℃時,將等物質的量濃度的RH2溶液和NaOH溶液等體積混合,所得溶液中各離子濃度由大到小的順序為 ,此時溶液中水的電離程度 純水的電離程度(填“>”、“<”或“=”).
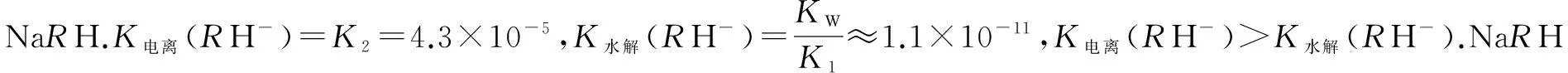
例2 在25℃時,H2R及其鈉鹽的溶液中,H2R、HR-、R2-三者所占的物質的量分數(a)隨溶液pH變化關系如下圖所示,下列敘述錯誤的是( ).
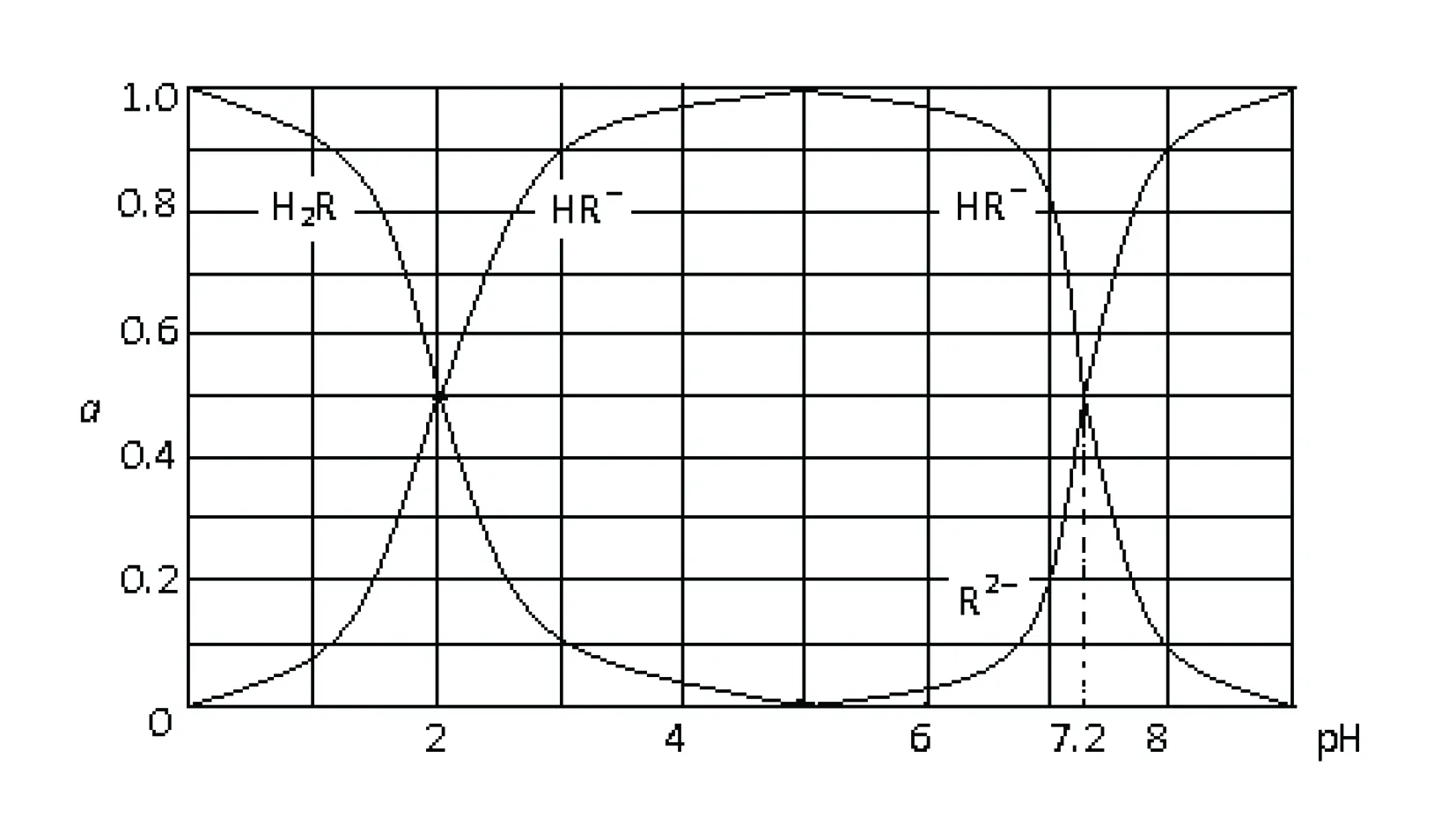
A.H2R是二元弱酸,其Ka1=1×10-2
B.當溶液恰好呈中性時,c(Na+)=2c(R2-)+c(HR-)
C.NaHR在溶液中水解傾向大于電離傾向
D.含Na2R與NaHR各0.1mol的混合溶液的pH約為7.2
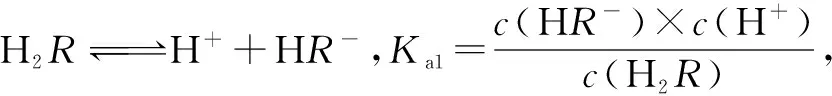
B中,溶液恰好呈中性時,電荷守恒得出c(H+)+c(Na+)=c(OH-)+2c(R2-)+c(HR-),中性溶液中c(H+)=c(OH-),故B 正確.
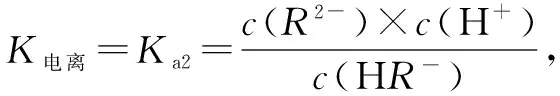
D中,Na2R與NaHR各0.1mol的混合溶液,水解和電離程度均很低,溶液中含R元素的離子主要為HR-和R2-,且c(HR-)≈c(R2-),此時pH≈7.2.故D正確.
參考文獻:
[1]曹錫章,宋天佑,王杏喬.無機化學[M].北京:高等教育出版社.1994.
[2]周天澤.普通高中課程標準實驗教課書化學選修(4)[M].北京:人民教育出版社.2007.

