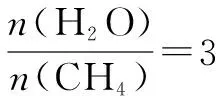破解化學平衡圖像考點攻略
王曉波
(內蒙古赤峰市林東第一中學 025450)
通過對全國新課標卷試題的分析研究,可以看出化學反應速率與化學平衡及其圖像分析是歷年高考的重點、難點和熱點,其重視程度呈逐年增加趨勢,在選擇題中命題內容常與熱化學結合,融合圖象于一體,重點考查化學反應速率的相關判斷與計算,以及利用平衡移動的原理分析、解決實際問題.現就化學平衡圖象的考點進行探究和總結,共同破解圖像試題的解題攻略.
一、圖像類型
1.濃度—時間圖


2.速率—時間圖
如Zn與足量鹽酸的反應,反應速率隨時間的變化出現如圖2所示的情況,解釋原因:AB段(v漸增),因反應為放熱反應,隨著反應的進行,溫度漸高,導致反應速率增大;BC段(v漸小),則主要原因是隨反應的進行,溶液中c(H+)逐漸減小,導致反應速率減小.故分析時要抓住各階段的主要矛盾,認真分析.
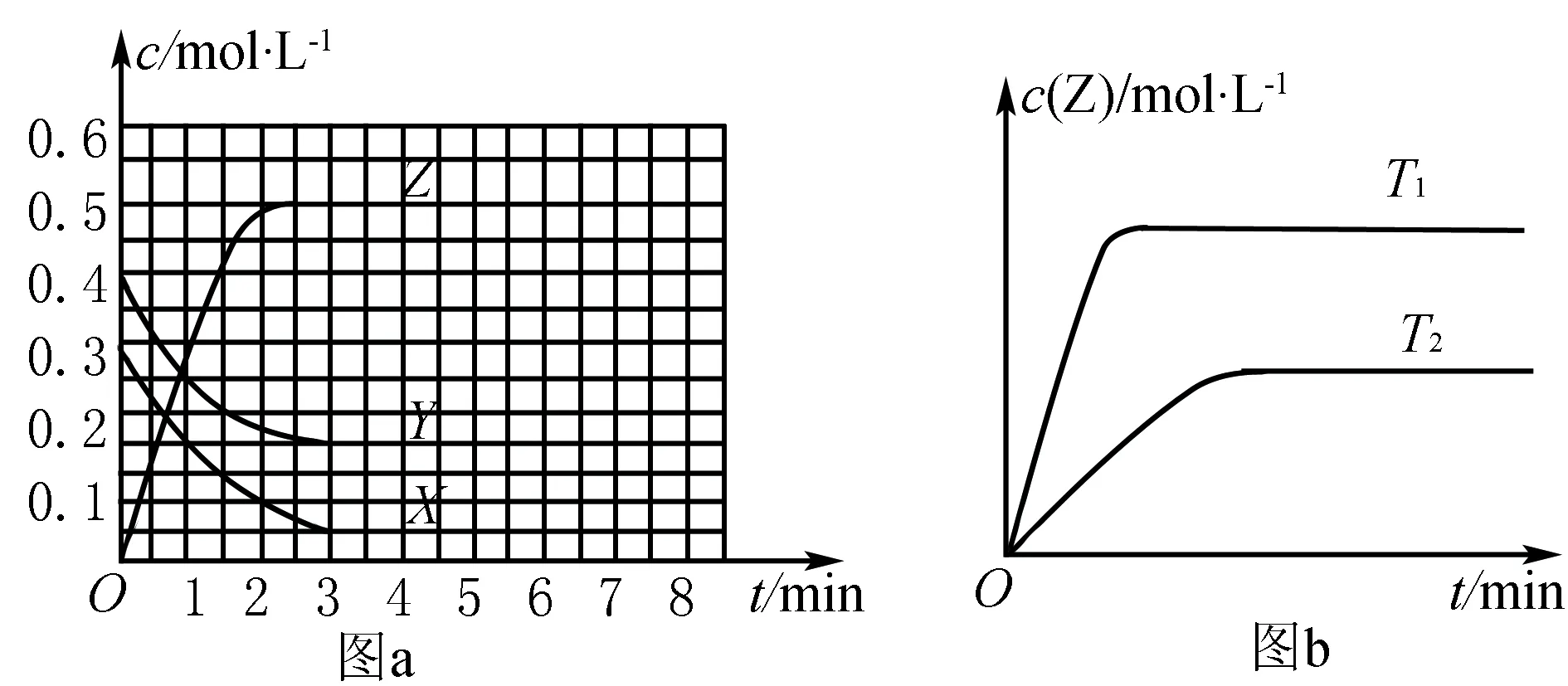
3.含量—時間—溫度(壓強)圖
常見形式有如下幾種(C%指生成物的質量分數;B%指某反應物的質量分數)


4.恒壓(溫)線(如圖3所示)
該類圖的縱坐標為物質的平衡濃度(c)或反應物的轉化率(α),橫坐標為溫度(T)或壓強(p),常見類型如圖3所示.
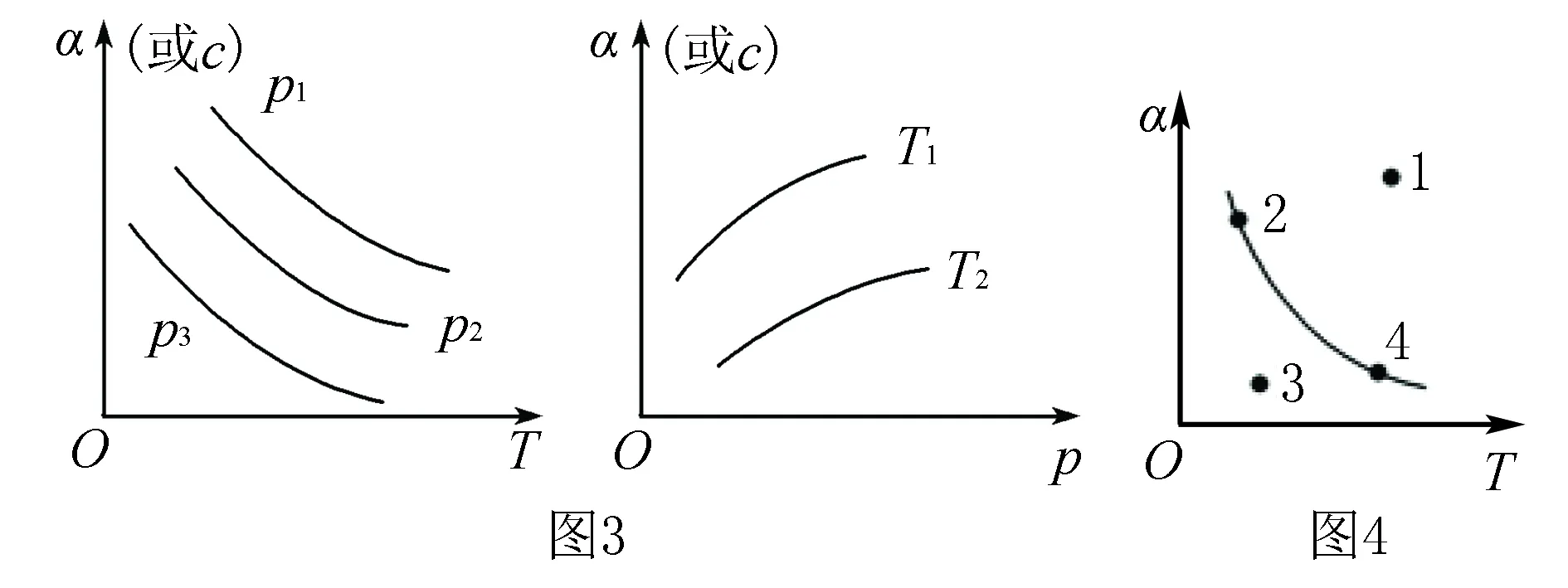
5.其他
如圖4所示曲線是其他條件不變時,某反應物的最大轉化率(α)與溫度(T)的關系曲線,圖中標出的1、2、3、4四個點,表示v正>v逆的點是3,表示v正 化學平衡圖像題的解題步驟:有關化學平衡、化學反應速率的圖表題一直是高考關注的熱點,在審題時,一般采用“看特點,識圖像,想原理,巧整合”四步法. 第一步:看特點.即分析可逆反應化學方程式,觀察物質的狀態、氣態物質分子數的變化(正反應是氣體分子數增大的反應,還是氣體分子數減小的反應)、反應熱(正反應是放熱反應,還是吸熱反應)等. 第二步:識圖像.即識別圖像類型,橫坐標和縱坐標的含義、線和點(平臺、折線、拐點等)的關系.利用規律“先拐先平,數值大”判斷,即曲線先出現拐點,先達到平衡,其溫度、壓強越大. 第三步:想原理.聯想化學反應速率、化學平衡移動原理,特別是影響因素及使用前提條件等. 第四步:巧整合.圖表與原理整合.逐項分析圖表,重點看圖表是否符合可逆反應的特點、化學反應速率和化學平衡原理.即: 1.緊扣特征,弄清可逆反應的正反應是吸熱還是放熱,體積增大、減小還是不變,有無固體、純液體物質參與反應等. 2.先拐先平,在含量(轉化率)—時間曲線中,先出現拐點的則先達到平衡,說明該曲線反應速率快,表示溫度較高、有催化劑、壓強較大等. 3.定一議二,當圖像中有三個量時,先確定一個量不變,再討論另外兩個量的關系,有時還需要作輔助線. 4.三步分析法,一看反應速率是增大還是減小;二看v正、v逆的相對大小;三看化學平衡移動的方向. 圖5 A.該反應的焓變ΔH>0 B.圖中Z的大小為a>3>b D.溫度不變時,圖中X點對應的平衡在加壓后φ(CH4)減小 A.發生反應時,各物質的反應速率大小關系為:v(X)=v(Y)=2v(Z) B.圖6中反應達到平衡時,Y的轉化率為37.5% C.T0℃時,該反應的平衡常數為33.3 D.該反應正反應的反應熱ΔH<0 這類試題的知識點是高考必考的重難點內容,近幾年高考對化學反應速率和化學平衡的考查比較穩定,題型有選擇題和填空題,重點考查化學反應速率和化學平衡的基本概念、影響因素、實驗分析和設計、速率及轉化率和平衡常數的計算.側重解析化學平衡圖像的讀圖,析圖,搜集獲取信息,采集處理數據等,需特別關注平衡常數表達式及其計算和化學平衡圖像的綜合應用. 參考文獻: [1]人民教育出版社,課程教材研究所,化學課程教材研究開發中心.化學反應原理[M].北京:人民教育出版社,2004. [2]新課標導學系列叢書編委會.走向高考——高考一輪總復習[M].南昌:江西教育出版社,2012.二、具體步驟

三、解題技巧
四、典型例題