匙吻鱘卵黃囊仔魚生長及抗氧化能力研究
秦國兵,安元銀,莫顯義,姚俊杰*,楊通枝
(1.貴州大學 動物科學學院水產系,貴州 貴陽 550025;2.貴州省水產技術推廣站,貴州 貴陽 550003;3.貴州省羅甸縣水產站,貴州 羅甸 550100)
匙吻鱘(Polyodonspathula)俗稱鴨嘴魚,是一種濾食性淡水經濟魚類,適應性強,生長迅速,以攝食浮游動物為主[1]。我國引進匙吻鱘有20余年,但苗種培育成活率低仍是目前解決大規模養殖的關鍵瓶頸[2]。影響魚類生長的因素很多,不同魚類生長的差異,主要是由其生長遺傳潛力、生活環境、餌料(營養)及外界因子的不同等因素所決定,所以不同的魚類常會有不同的生長過程、生長方式和生長特點[3]。為了維持種群持續繁衍,魚類在長期進化中形成了一種存活策略和個體發育機制,即優先發育那些對存活起首要作用的器官[4],并且這種生長的優先性會隨著個體的發育而改變。其中,在魚類早期發育過程中各器官的生長普遍表現出異速生長現象[5],以這種異速生長特征確保最重要的器官優先發育[6]。
抗氧化酶系統能在魚類生長過程中,消除機體代謝產生的活性氧自由基, 對增強吞噬細胞防御能力和機體免疫功能具有重要作用。仔魚適應環境能力有限,對環境變化非常敏感,外界環境如水溫、溶解氧、餌料營養成分[7]變化,易使魚體內活性氧含量及抗氧化酶活性發生變化,產生應激反應。若長期處于應激狀態必然導致機體免疫防御能力和抗病力下降,影響仔魚的正常生長[8],造成仔魚大量死亡。目前,有關匙吻鱘的研究主要集中于生物學觀察、養殖及繁殖技術、肉質評價、消化酶及生長規律等[9-13]。關于匙吻鱘仔魚發育階段生長與抗氧化能力變化關系相關研究還未見報道。為了更好了解貴州地區匙吻鱘魚苗培育生長及抗氧化能力變化情況,本研究旨在針對卵黃囊仔魚的生長及抗氧化酶活力的檢測,以期為匙吻鱘早期發育生物學和抗氧化生理提供基礎數據。
1 材料與方法
1.1 材料
實驗材料來自貴州羅甸縣匙吻鱘養殖基地,從出膜第3天暫養室內水泥池 (8×3×1) m,采用微流水養殖,培育期間保證溶氧不低于5 mg/L,總氨氮值小于0.2 mg/L,平均水溫18.5℃,pH 6~7。放養密度為900尾/m3,出膜第6 天投喂生物餌料,直至出膜10 d,整個培育過程中未對匙吻鱘進行馴化。每天對同一批魚苗隨機抽取10尾魚樣觀察,同時,測定全長及體重等形態指標;并取出膜后第3~10 d仔魚樣品保存-20℃,用于酶活力測定。酶活性測定試劑盒均購自南京建成生物工程研究所。
1.2 方法
用Motic SML-168 型體視顯微鏡觀察和拍照。從出膜3日齡開始每天隨機抽取10尾仔魚苗作為觀察材料,用Motic Images Advanced 3.2軟件拍照并測量全長、口寬、吻長、眼徑等各個指標,精確到0.01 mm,所有量度指標以平行或垂直于魚體水平軸為基準。取全仔魚勻漿后取上清用于酶活分析。
1.3 數據處理
頭部器官與全長關系用異速生長模型,以冪函數方程即異速生長方程y=axb計算[14],以卵黃囊期仔魚全長為自變量x,y為與相對應的各種器官長度,a為y軸截距,b為異速生長指數。當b =1時,為等速生長,此時仔魚器官的生長與全長等比例增長;b>1時,為快速生長,此時器官的生長要比全長生長快;b<1時為慢速生長,此時器官的生長比全長生長慢。數據用SPSS 19.0軟件進行回歸參數擬合,結果以平均值±標準誤(mean±SE)表示,P<0.01或P<0.05表示差異顯著。
2 結果與分析
2.1 匙吻鱘卵黃囊仔魚生長情況
2.1.1形態特征 匙吻鱘仔魚一些主要形態特征見表1,對匙吻鱘仔魚培育期間,隨機抽取10尾仔魚進行常規生物學測量,全長范圍在(10.028±0.627~18.090±0.950)mm,體重范圍在(0.008±0.001~0.028±0.006)g。
2.1.2全長、體質量生長情況 匙吻鱘卵黃囊期仔魚全長、體質量與日齡的關系見圖1,通過曲線模擬分析得出,仔魚全長隨日齡的變化曲線符合冪函數生長,生長方程為:L=6.113x0.469(3≤x≥10),R2=0.996;仔魚體質量隨日齡的變化曲線符合二次函數生長,生長方程為:W=0.0004x2-0.002x+0.01(3≤x≥10),R2=0.982。全長(L)與體質量(M)的回歸分析見圖2,呈冪函數生長,生長方程為W=6.3004L2.041,R2=0.814。
2.1.3頭部器官與全長生長的關系 頭部器官與全長的生長關系見圖3、4、5和6。吻長(圖3)、口寬(圖4)、眼徑(圖5)和眼間距(圖6)的異速生長指數b分別為1.782、1.043、2.990和1.439。口寬、吻長和眼間距異速生長指數與1之間均具有顯著性差異(P<0.05),表現出快速生長,眼徑異速生長指數與1之間差異不顯著(P>0.05),表現為等速生長,但均沒有出現生長拐點。

表1 匙吻鱘卵黃囊仔魚的可量性狀Tab.1 The values of measurable characters in Polyodon spathula during the growth form of larvae
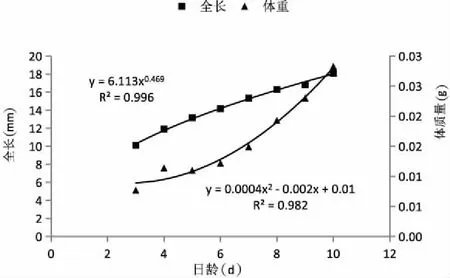
圖1 匙吻鱘卵黃囊仔魚全長、體質量與日齡的關系Fig.1 The relationship between weight, total length and day age of P. spathula yolk-sac larvae
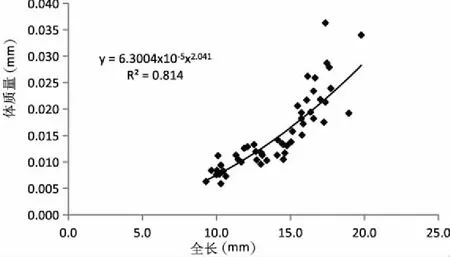
圖2 匙吻鱘卵黃囊仔魚全長與體質量函數關系Fig.2 The function relationship between weight and total length of P. spathula yolk-sac larvae
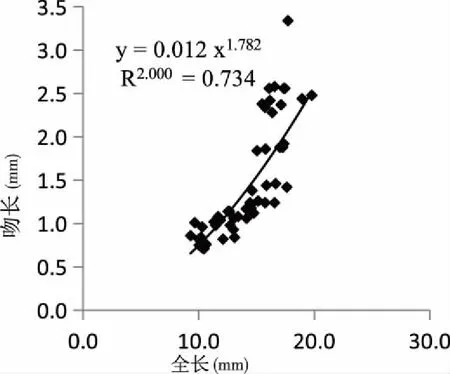
圖3 匙吻鱘卵黃囊仔魚口寬與全長關系Fig.3 The relationship between mouth width and total length of P. spathula yolk-sac larvae
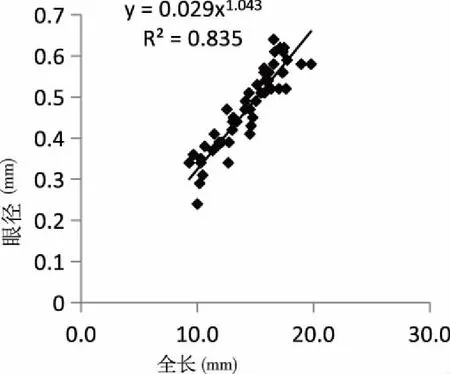
圖5 匙吻鱘卵黃囊仔魚眼徑與全長關系Fig.5 The relationship between eye diameter and total length of P. spathula yolk-sac larvae
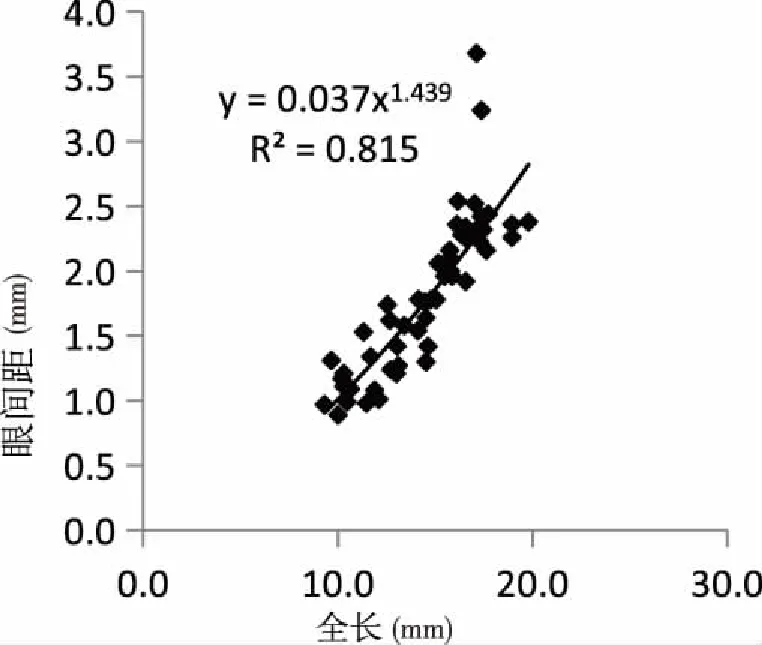
圖6 匙吻鱘卵黃囊仔魚眼間距與全長關系Fig.6 The relationship between eye distance and total length of P. spathula yolk-sac larvae
2.2 匙吻鱘卵黃囊仔魚抗氧化能力變化
2.2.1仔魚T-SOD與CAT活性變化 匙吻鱘卵黃囊仔魚超氧化物歧化酶與過氧化氫酶活性變化見圖7和圖8。仔魚從出膜3天到5天T-SOD和CAT活性均顯著升高(P<0.01),出膜6天均出現最大值。T-SOD在出膜6天后開始下降,到出膜10天到達最低值(圖7),CAT在出膜7天出現最低值,之后出現上升現象(圖8)。
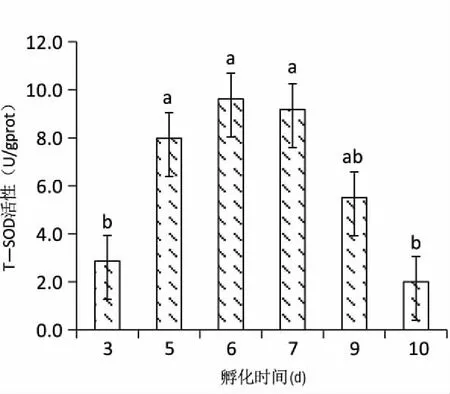
圖7 匙吻鱘卵黃囊仔魚T-SOD活性變化Fig.7 The changes of catalase activity of P. spathula yolk-sac larvae
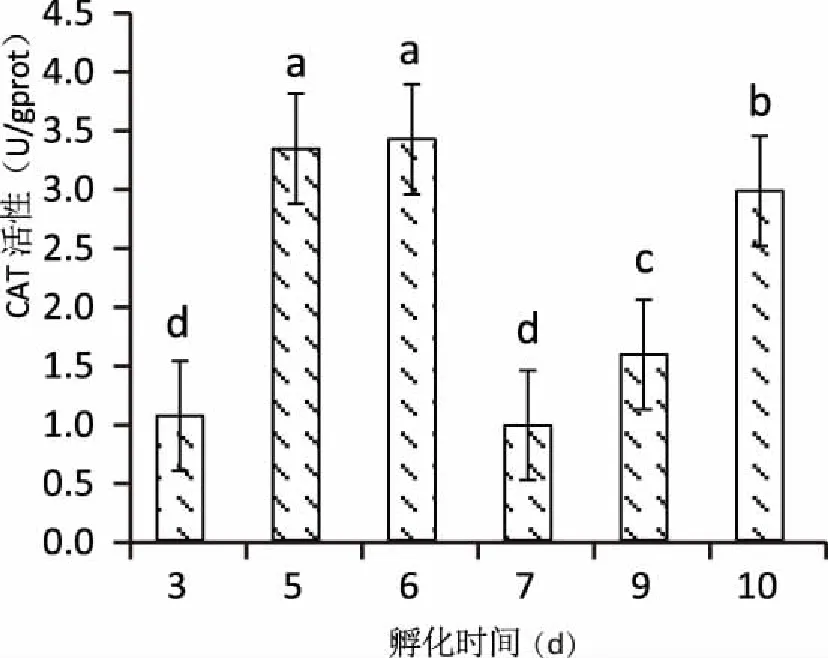
圖8 匙吻鱘卵黃囊仔魚CAT活性變化Fig.8 The changes of superoxide dismutase activity of P. spathula yolk-sac larvae
柱圖上不同小寫字母表示不同日齡間有顯著差異(P<0.05),相同小寫字母表示不同日齡間無顯著差異(P>0.05)。
2.2.2仔魚T-AOC與MDA含量變化 匙吻鱘卵黃囊仔魚總抗氧化能力與丙二醛含量變化見圖9。仔魚T-AOC在出膜3~9日齡逐漸升高,直至卵黃囊消失前出現下降,差異不顯著(P>0.05)。仔魚的MDA含量從出膜3~9日齡天逐漸降低,直至卵黃囊消失前出現顯著升高(P<0.01)。
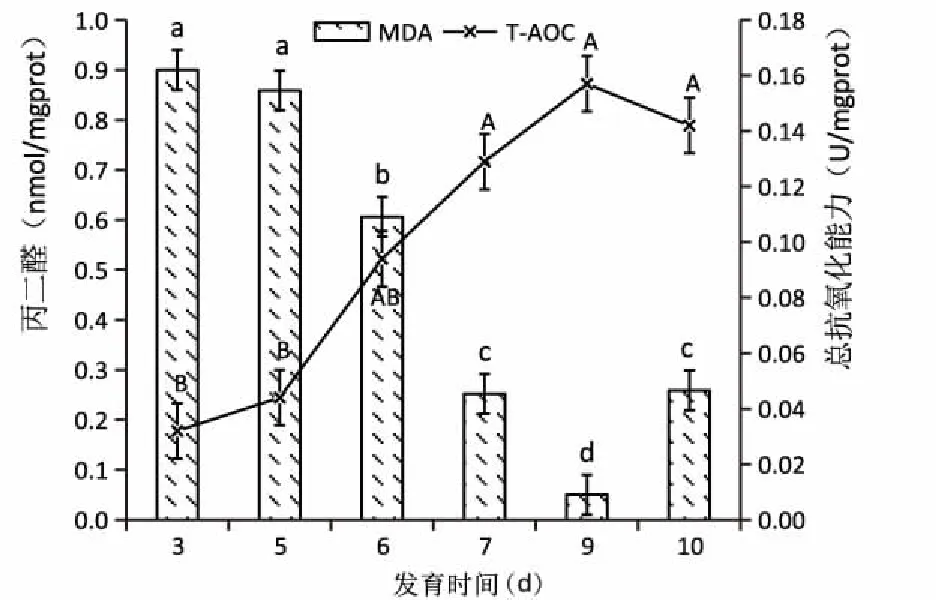
圖9 匙吻鱘卵黃囊仔魚T-AOC與MDA含量變化Fig.9 The changes of total antioxidative capacity and malondialdehyde content of P. spathula yolk-sac larvae
柱圖上不同小寫字母表示不同日齡間有顯著差異(P<0.05),相同小寫字母表示不同日齡間無顯著差異(P>0.05);線圖上不同大寫字母表示不同日齡間有顯著差異(P<0.01),相同大寫字母表示不同日齡間無顯著差異(P>0.05)
3 結論與討論
3.1 匙吻鱘卵黃囊仔魚頭部器官生長特點
異速生長指生物體某一特征的相對生長速率不等于第二種特征的相對生長速率,身體各個功能器官表現出了生長不同步的現象,是動植物長期適應外界環境所進化保留下來的發育特征[15~16],在魚類早期發育中,特別是剛出膜仔魚,為適應生活環境,必須優先發育相關的器官,提高存活率,在長期進化中形成了個體發育機制和生存策略。仔魚早期發育和器官分化是個極其重要而又復雜的過程,包括形態發生,身體外形、體內新陳代謝和生活行為等變化[17],所有這些變化都是對外界惡劣生活環境的適應性選擇,而這種選擇在仔魚早期發育過程中主要體現在一些功能器官如感覺、攝食、游泳等器官快速的生長。匙吻鱘卵黃囊仔魚在自然發育中,隨日齡的增長,口寬、吻長和眼間距相對于全長快速生長,眼徑相對于全長等速生長。仔、稚魚攝食能力的強弱與口寬、吻長的發育和完善程度密切相關。仔魚開口攝食后內源營養物質的不斷消耗,亟需進食以保證正常的發育。匙吻鱘仔魚在出膜6日齡左右開口,10日齡左右卵黃完全消失,表明匙吻鱘仔魚從6 d至10 d是一個混合營養時期。仔魚從出膜3日齡開始至10日齡,口裂寬相對全長呈現快速增長,而相比吻長,口寬的生長指數比較大,這或許與早期仔魚進食方式相關,即在較大的口裂前提下吞食更多的食物來滿足生長。通過口寬的生長來增加捕食能力,這結果也表明,在這一時期,口裂寬的快速增長與仔魚完全轉變為外源營養是同時進行的,類似的結果在對大黃魚[18]的研究中也得到了證實。
視覺器官——眼睛的發育程度直接關系到仔、稚魚攝食和逃避敵害的效率。研究表明,施氏鱘[19]和西伯利亞鱘[20]眼睛分別在2日齡和3~4日齡便完成了快速生長階段。匙吻鱘仔魚眼徑在3日齡至10日齡相對于全長等速生長,這暗示了眼睛已完成了優先發育,進入次要發育階段。研究表明, 一旦器官生長優先順序完成,就會進入趨向于與全長等速的生長階段[21~22]。由此可見,匙吻鱘仔魚從胚胎發育到出膜3日齡時,眼的發育已經較為成熟。
3.2 匙吻鱘卵黃囊仔魚抗氧化能力變化特點
匙吻鱘卵黃囊仔魚在出膜6日齡左右開口,10日齡左右卵黃完全消失,隨日齡的增長,抗氧化能力逐漸增加,抗氧化損傷逐漸降低。少量氧自由基(reactive oxygen species,ROS),是生物體所必需的,但過多的ROS如果不能被及時清除,它們將會攻擊各種生物大分子,引起生物體各種生理病變,進而影響生長。抗氧化防御系統存在于所有需氧生物細胞內,而超氧化物歧化酶(SOD)、過氧化氫酶(CAT)等是生物體內清除氧自由基的重要抗氧化酶。匙吻鱘卵黃囊仔魚在開口攝食前,隨著出膜時間的延長,其各項生理機能不斷完善,代謝加強,使得耗氧率不斷增加,產生的自由基也越多,為保證機體內自由基的動態平衡,機體必須清除過多的自由基,這是SOD、CAT在內源營養期顯著升高的原因。進入混合營養期后, SOD開始下降,可能是攝取的生物餌料中抗氧化物質(如Vc)可以直接清除自由基[23],而CAT在進入混合營養期降到最低后又逐漸升高,CAT是H2O2的清除劑,因此它的高活性表明系統中大量過氧化氫的存在,混合營養期CAT逐漸增多,可能是餌料刺激機體產生大量的H2O2,但需進一步研究。由此可見,匙吻鱘卵黃囊仔魚的不同發育階段是由不同種類的抗氧化酶發揮抗氧化作用來提高抗氧化能力。
3.3 匙吻鱘卵黃囊仔魚生長與抗氧化能力變化關系
仔魚早期的生長發育是個極其重要而又復雜的過程,也是生命周期中脆弱階段,其在發育過程中生理代謝活動十分活躍,以進行細胞增殖和組織器官構建等重要生命活動。代謝過程中會產生大量的自由基,為了保證發育的順利,早期發育階段中的抗氧化防御系統將會及時清除。不同生長階段抗氧化系統的效應對于魚類的正常發育起著非常重要的作用。機體內抗氧化防御系統可能隨發育狀態和生物體的生理特征而改變[24]。仔魚發育階段抗氧化能力的強弱與其健康程度密切相關。研究表明,尖吻鱸(Latescalcarifer)從出膜至25天中CAT活性逐漸降低, SOD的活性無顯著變化[25],大菱蝦從出膜至11天的發育過程中, CAT和GSH-Px活性呈逐漸升高的趨勢,SOD逐漸降低的趨勢[26]。匙吻鱘卵黃囊仔魚隨生長的進行,總抗氧化能力逐漸增加,在完全轉變為外源營養之前出現下降現象,相關研究表明,生物攝入的食物在生成能量的同時也不斷產生ROS[27],表明匙吻鱘仔魚在卵黃囊期間攝食器官不斷完善,攝食外源餌料增多,同時,也表明不同的水生生物及不同階段抗氧化能力變化不一樣。
致謝:感謝羅甸縣匙吻鱘養殖技術公司提供場所,感謝公司工作人員在實驗期間給予的幫助。
參考文獻:
[1] Ji H, Sun HT, Xiong DM. Studies on activity, distribution, and zymogram of protease, α-amylase, and lipase in the paddlefishPolyodonspathula[J].FishPhysiology&Biochemistry, 2012, 38(3):603.
[2] 丁慶秋,萬成炎,易繼舫,等.匙吻鱘苗種規模化培育技術[J]. 水生態學雜志,2011, 32(1):142-144.
[3] 鮑新國.金沙江長鰭吻鮈年齡與生長及其肌肉生化成分分析研究[D]. 武漢:華中農業大學, 2009.
[4] Osse J W M. Form Changes in Fish Larvae in Relation To Changing Demands of Function[J].NetherlandsJournalofZoology, 1989, 40(1):362-385.
[5] Choo C K, Liew H C. Morphological development and allometric growth patterns in the juvenile seahorse,HippocampuskudaBleeker[J].JournalofFishBiology, 2006, 69(2):426-445.
[6] Rodriguez A, Gisbert E. Eye development and the role of vision during Siberian sturgeon early ontogeny[J].ZeitschriftFurAngewandteIchthyologie, 2002, 18(6):280-285.
[7] 萬 敏,麥康森,馬洪明,等.硒和維生素E對皺紋盤鮑血清抗氧化酶活力的影響[J]. 水生生物學報, 2004, 28(5):496-503.
[9] Liu J H, Chen C Q, Diao X M,etal. Study on post-embryo development of quantitative characters of feeding organs inPolyodonspathula[J].JournalofShanghaiFisheriesUniversity,1998,7 (4):288 -293.
[10] Ji H, Shan S T, Cao F Y,etal. Study on rearing paddlefishPolyodonspathulajuvenile using spawning pool of Chinese carp in Ankang area [J].ChinaFisheries, 2009,3:43-44.
[11] 吉 紅,孫海濤,單世濤.池塘與網箱養殖匙吻鱘肌肉營養成分及品質評價[J]. 水產學報, 2011,35(2):261-267.
[12] 吉 紅,孫海濤,田晶晶,等.匙吻鱘仔稚魚消化酶發育的研究[J]. 水生生物學報, 2012, 36(3):457-465.
[13] 聶文強,李 婧,吉 紅,等.匙吻鱘仔稚魚攝食前后生長規律與體脂肪酸組成研究[J]. 水生態學雜志, 2017, 38(3):103-110.
[14] Huxley J S. Problems of Relative Growth [M]. New York: Lincoln Mac Veagh the Dial Press. 1932, 241
[15] Peters R H. The Ecological Implications of Body Size[M]. Second Edition. Cambridge: Cambridge University Press. 1986, 184-215.
[16] Niklas K J. Plant Allometry: the Scaling of Form and Process [M]. Chicago: University of Chicago Press. 1994, 274-290.
[17] Nogueira L B, Godinho A L, Godinho H P. Early development and allometric growth in hatchery-reared characinBryconorbignyanus[J].AquacultureResearch, 2014, 45(6):1004-1011.
[18] 宋洪建,劉 偉,王繼隆,等.大麻哈魚卵黃囊期仔魚異速生長及其生態學意義[J]. 水生生物學報, 2013, 37(2):329-335.
[19] 馬 境,章龍珍,莊 平,等.施氏鱘仔魚發育及異速生長模型[J]. 應用生態學報,2007, 18(12):2875-2882.
[20] 莊 平, 宋 超, 章龍珍,等. 全人工繁殖西伯利亞鱘仔稚魚發育的異速生長[J]. 生態學雜志, 2009, 28(4):681-687.
[21] Fuiman F A. Growth gradients in fish larvae [J].JournalofFishBiology, 1983, 23(1): 117-123.
[22] Clemmesen C, Malzahn A M, Peck M A,etal. Development and allometric growth patterns during early larval stages of the spotted sand bass Paralabrax maculatofasciatus (Per-coidei: Serranidae) [J].ScientiaMarina, 2009, 73(1): 183-189.
[23] 熊鏵龍, 姚俊杰, 安 苗,等. 外源性Vc對普安銀鯽仔魚抗氧化酶活性的影響[J]. 淡水漁業, 2015(1):79-82.
[24] Livingstone D R. Contaminant-Stimulated reactive oxygen Species production and oxidative damage in aquatic organisms[J].MarPollutBull, 2001, 42(8):656-666.
[25] Kalaimani N, Chakrvarthy N, Shanmugham R,etal. Anti-oxidant status in embryonic, post-hatch and larval stages of Asian seabass(Latescalcarifer) [J].FishPhysiolBiochem, 2008, 34(2):151-158.
[26] Peters L D, Livingstone D R. Antioxidant enzyme activities in embryologic and early larval stages of turbot[J].JournalofFishBiology, 1996, 49(5): 986-997.
[27] Meng D, Wang X, Chang Q,etal. Arsenic promotes angiogenesis in vitro via a heme oxygenase-1-dependent mechanism[J].Toxicology&AppliedPharmacology, 2010,244(3):291-299.

