同型半胱氨酸及血清胱抑素C與糖尿病周圍神經病變的相關性
金明月 李國姣 郭妍 劉藝璇 吳兵書 陳彥彥 王應昉 王滌非
中國醫科大學附屬第一醫院老年內分泌科(沈陽110001)
糖尿病周圍神經病變(diabetic perineuropa?thy,DPN)是糖尿病(DM)的一種常見并發癥,目前研究表明其發病機制與神經內皮缺血損傷及氧化應激等多種因素相關。而臨床發現,DPN是導致患者反復住院治療并影響DM患者生存質量及預后的重要因素。因此,探討實驗室可測的相關血清指標與DPN的相關性對預測和評估病情程度及預后,并及時防治有較為重要的意義[2]。近年研究發現同型半胱氨酸(Hcy)水平與DM及其大血管病變并發癥密切相關[3?4]。而 EIBOGHDADY等[5]認為Hcy可能為DPN的一個獨立危險因素。血清胱抑素 C(cystatin c,Cys?c)也與 DPN 的發病機制相關[7],但尚沒有研究論證這二者在DPN發生中的協同作用。本研究選擇203例2型糖尿病(T2DM)患者進行Hcy、Cys?c等指標測定,分析這些指標與DPN的相關性。
1 資料與方法
1.1 一般資料 入選2014年9?12月于中國醫科大學附屬第一醫院住院的T2DM患者203例(根據2005年WHO診斷及分型標準),其中男117例,女86例,年齡26~83歲,平均(54.63±11.318)歲。病程1~30年,平均(8.26±6.27)年。根據2010年ADA糖尿病神經病變指南,分為兩組。DPN+組:123例,男/女:65/58;非DPN(DPN?)組:80例,男/女:52/28。排除標準:所有研究對象均無心、腦、肝、腎、外周血管閉塞性病變;近3個月內未用葉酸、維生素B12和B6;排除其他病因引起的神經病變。兩組患者性別、年齡、WHR、BMI比較差異均無統計學意義,具有可比性。
1.2 方法 所有納入對象測量身高、體質量、腰圍,計算體質指數(BMI);指標測定:空腹采集靜脈血,測定空腹血糖(FBG)、空腹C肽(C?P)、糖化血紅蛋白(HbA1c)、三酰甘油(TG)、總膽固醇(TC)、低密度脂蛋白膽固醇(LDL?C)、高密度脂蛋白膽固醇(HDL?C)、超敏C反應蛋白(hs?CRP)、Cys?c、Hcy、纖維蛋白原(Fg)、尿微量白蛋白(MA)、尿肌酐(Cr)、UAER;根據患者空腹血糖及C肽水平改良HOMA公式評價胰島素抵抗和胰島β細胞功能[8]。HOMA?IR(CP):1.5+空腹血糖×空腹C肽/2 800;HOMA?islet(CP?Normal)=0.27×空腹C肽/(空腹血糖-3.5)+50;HOMA?islet(CP?DM)=0.27×空腹C肽/(空腹血糖-3.5)。
1.3 診斷標準 根據美國神經病學會(AAN)、美國神經肌肉和電子診斷醫學會(AANEM)推薦的設計傳導檢查流程:采用日本光電MEB?9200K肌電圖誘發電位儀,分別對患者進行雙側正中神經、尺神經、腓神經和腓總神經的運動傳導速度、末端潛伏期、動作電位波幅測定以及正中神經、尺神經的感覺傳導速度、動作電位波幅測定,存在兩項及兩項以上傳導減慢者或波幅下降或潛伏期延長,其中一條為腓腸神經,即可診斷為周圍神經病變。
1.3 統計學方法 采用SPSS 17.0軟件分析,數據均以均數±標準差表示,組間比較采用t檢驗,多組間比較采用方差分析。采用Pearson相關及多元Lo?gistic回歸分析,P≤0.05為差異有統計學意義,P≤0.01為差異有極顯著統計學意義。
2 結果
2.1 DPN+組與DPN?組一般資料比較 病程在兩組間差異均有極顯著統計學意義(P<0.01),而年齡等其他指標比較,差異無統計學意義。見表1。
2.2 DPN+組與DPN?組生化指標比較 DPN+組的Hcy、Cys?c水平高于DPN?組(P< 0.01)。DPN?組HOMA?islet(CP)指數則明顯高于DPN+組(P<0.01)。其他如血脂等指標比較,差異無統計學意義。見表2。
表1 DPN+組與DPN-組一般資料分析Tab.1 Analysis of baseline data between DPN+group and DPN?group ±s
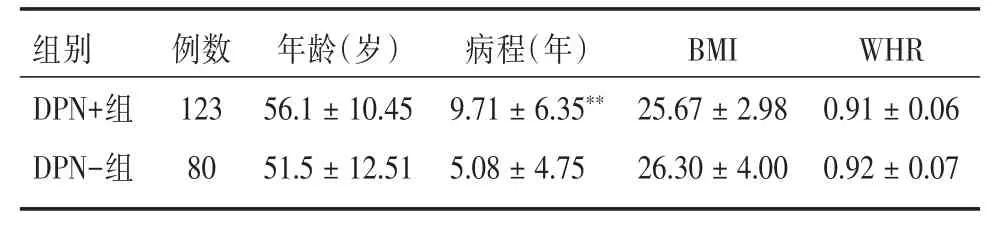
表1 DPN+組與DPN-組一般資料分析Tab.1 Analysis of baseline data between DPN+group and DPN?group ±s
注:組間比較,*P<0.05,**P<0.01
組別DPN+組DPN-組例數123 80年齡(歲)56.1±10.45 51.5±12.51病程(年)9.71±6.35**5.08±4.75 BMI 25.67±2.98 26.30±4.00 WHR 0.91±0.06 0.92±0.07
表2 DPN+組與DPN-組一般生化指標分析Tab.2 Compared of blood biochemical indexes between DPN+group and DPN?group ±s
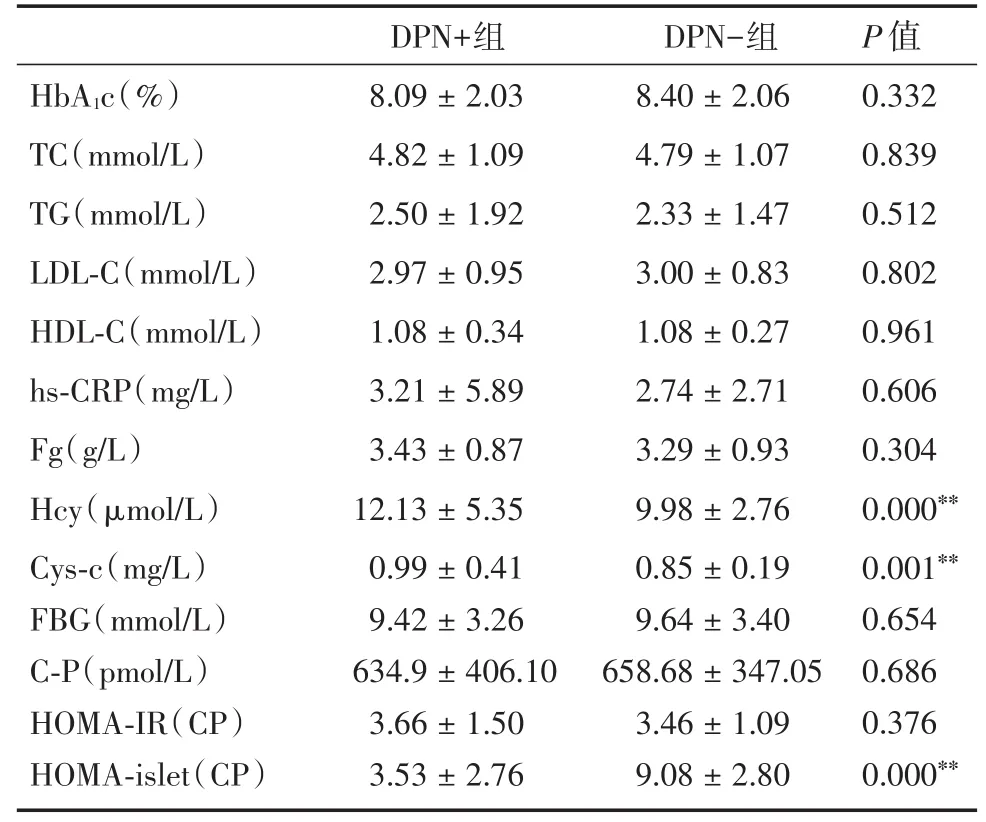
表2 DPN+組與DPN-組一般生化指標分析Tab.2 Compared of blood biochemical indexes between DPN+group and DPN?group ±s
注:組間比較,*P<0.05,**P<0.01
HbA1c(%)TC(mmol/L)TG(mmol/L)LDL?C(mmol/L)HDL?C(mmol/L)hs?CRP(mg/L)Fg(g/L)Hcy(μmol/L)Cys?c(mg/L)FBG(mmol/L)C?P(pmol/L)HOMA?IR(CP)HOMA?islet(CP)DPN+組8.09±2.03 4.82±1.09 2.50±1.92 2.97±0.95 1.08±0.34 3.21±5.89 3.43±0.87 12.13±5.35 0.99±0.41 9.42±3.26 634.9±406.10 3.66±1.50 3.53±2.76 DPN-組8.40±2.06 4.79±1.07 2.33±1.47 3.00±0.83 1.08±0.27 2.74±2.71 3.29±0.93 9.98±2.76 0.85±0.19 9.64±3.40 658.68±347.05 3.46±1.09 9.08±2.80 P值0.332 0.839 0.512 0.802 0.961 0.606 0.304 0.000**0.001**0.654 0.686 0.376 0.000**
2.3 高Hcy對DPN影響 以正常人群的空腹Hcy水平均值加2個標準差(即≥13.49 μmol/L)定義為高Hcy血癥。將T2DM患者分為高Hcy組及正常Hcy對照組,分析兩組中DPN的患病率及其他相關指標。高Hcy組的患者中DPN發生率顯著高于正常Hcy組(P<0.01)。此與2.2中對DPN+,DPN?組關于Hcy獨立樣本t檢驗結論一致。通過對Hcy水平進行分組的方式進一步發現,高水平Hcy組中的Cys?c水平也在顯著增加(P<0.01)。見表3。
2.4 DPN+組患者中Hcy及Cys?c與各指標間的Pearson相關性分析 Hcy與BMI、UAER、Cys?c呈正相關,與HbA1c及HDL?C呈負相關。Cys?c與年齡及病程、Fg、Hcy、UAER呈正相關,與HbA1c呈負相關。控制BMI、病程、Fg、UAER后,Hcy仍與Cys?c顯著相關。見表4。
2.5 多元Logistics回歸分析 以是否伴發DPN為因變量,將年齡、病程、BMI、WHR、Hcy、Cys?c等為自變量,進行多元Logistics回歸,結果發現僅病程可進入回歸方程。
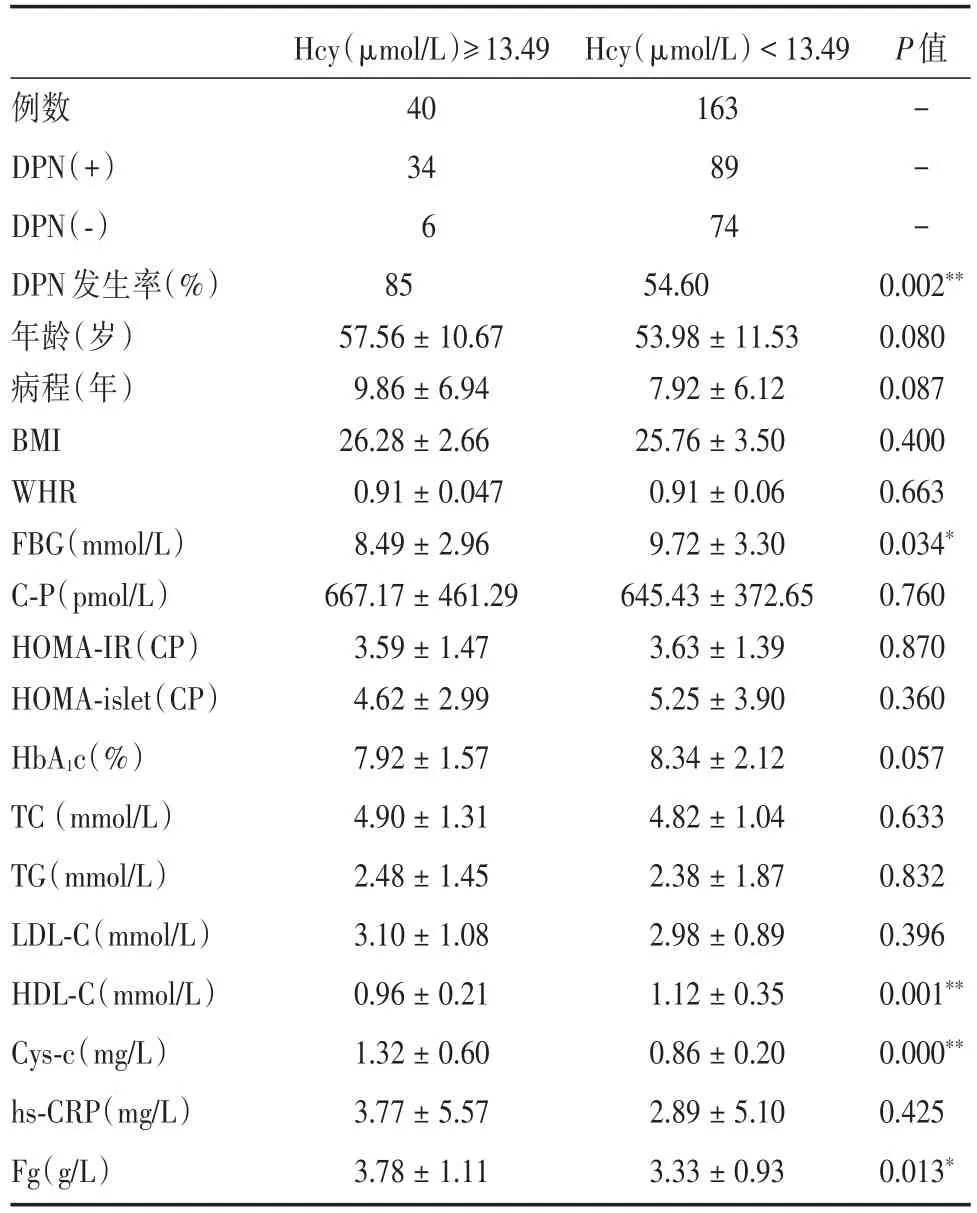
表3 高Hcy組與正常Hcy組中DPN患病率及其他相關指標比較Tab.3 Compared of the prevalence rate of DPN and other baseline data between high level Hcy and normal level x±s
3 討論
DPN的發病機制暫未完全清楚。而經近年來的研究表明,其可能是由多種因素共同作用的結果,與血糖控制不佳等代謝紊亂、血管損傷、神經營養障礙、氧化應激及自身免疫因素等因素有關。但在臨床中發現,即使長期血糖控制良好的部分糖尿病患者仍發生并發神經病變,這就提示可能血糖外的其他因素也參與了糖尿病神經病變的發生和發展過程[4?5]。有研究表明,DPN 患者Hcy、Cys?c水平較健康者明顯升高的原因在于高血糖所致的應激及血管損傷。
Hcy是蛋氨酸代謝的中間產物,是血管內皮損傷及糖脂代謝紊亂的重要危險因素,高Hcy具有促氧化應激及神經細胞毒性等作用,這也是糖尿病周圍神經病變的致病機制[4],故研究者們考慮高Hcy水平是否為DPN的獨立危險因素,但相關研究不多且存在爭議[5,9-10]。國內的研究多是在從軀體運動感覺神經的方面來探討高Hcy水平對DPN的影響,結論多為高Hcy水平與DPN發生有關,是 DPN 的獨立危險因素[11?13]。有研究結果顯示[6]T2DM患者的血漿空腹Hcy升高與周圍神經病變的患病率升高具有相關性。BRUCE等[9]的研究也顯示Hcy是DPM的獨立危險因子。但也另有研究認為Hcy是引起大血管病變的影響因素,而與DPN并無相關性。
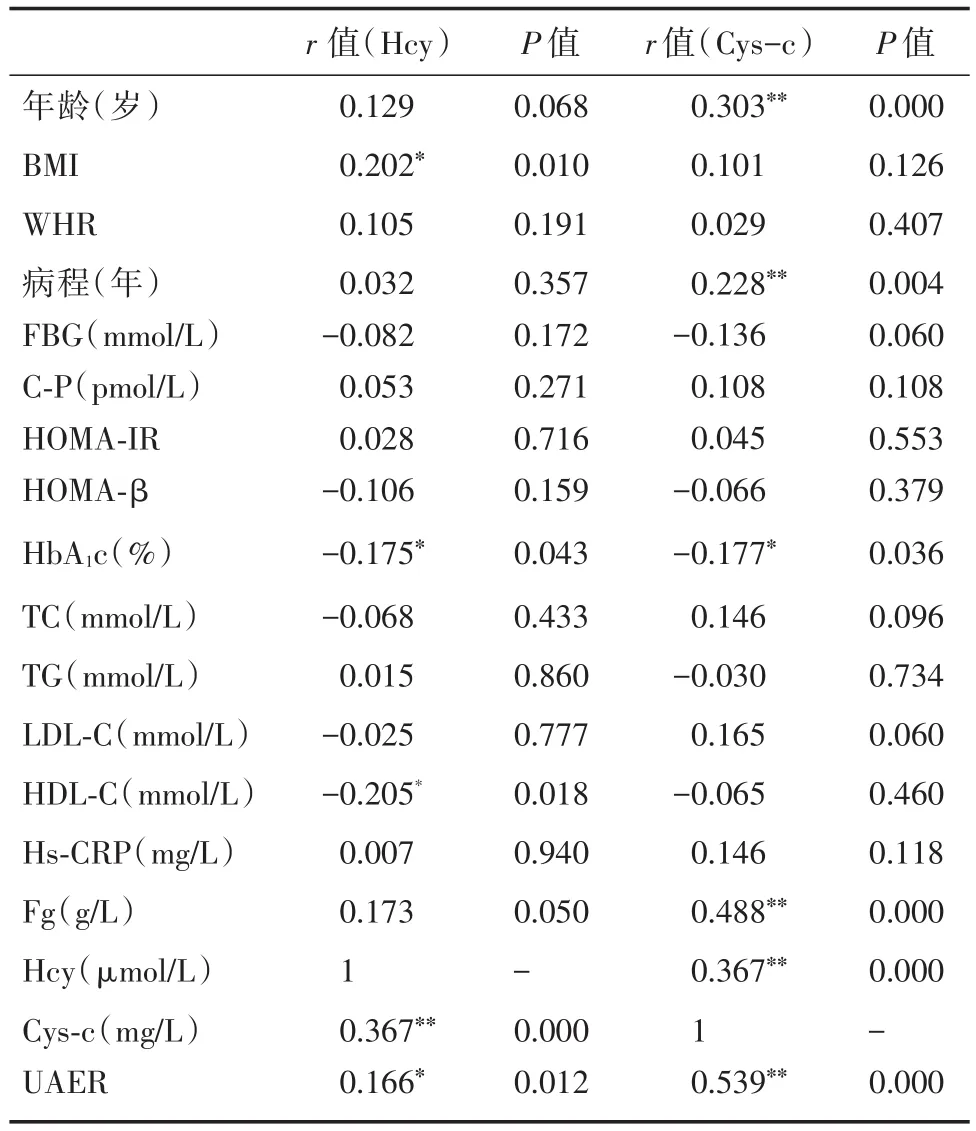
表4 DPN+組患者各指標與Hcy及Cys?c相關性分析Tab.4 Correlational analysis of baseline data with Hcy,Cys?c
本研究結果顯示,DPN+組的Hcy水平明顯高于DPN?組(P<0.05)時再將Hcy分組統計后,顯示高Hcy組患者的DPN發生率也明顯高于正常Hcy組。表明血中Hcy水平升高與T2DM患者DPN的發生可能相關,臨床上監測Hcy水平對提示神經病變的發生可能具有意義。
Cys?c作為一種半胱氨酸蛋白酶抑制劑,它產生于人體所有的有核細胞。它的生理功能之一是調節半胱氨酸蛋白酶活性,可抑制Hcy分解的過程中的酶,升高血漿Hcy的濃度,并與Hcy及組織蛋白酶等相互作用,在血管損傷過程中起到重要的作用。Cys?c濃度比較穩定,腎臟是清除循環中Cys?c的惟一場所。Cys?c也是反映早期GFR變化的一個標志物。研究[9]表明,Cys?c、Hcy與糖尿病腎病密切相關,參與其發生發展,可作為早期腎損傷診斷的重要指標[10]。目前,Hcy與Cys?c在DPN中的作用及相互關系的相關報道較少。本研究對T2DM是否合并DPN患者進行分組研究,結果顯示隨著DPN的發生,血漿Hcy與Cys?c的水平均有明顯升高的趨勢,DPN+組的Cys?c水平也明顯高于DPN?組(P<0.05)。本研究還發現,將Hcy根據水平分為高Hcy組及正常Hcy對照組后,Cys?c水平在高Hcy組也明顯升高(P<0.01)。在控制了其他相關因素后,Hcy與Cys?c水平仍極顯著相關(r=0.287,P=0.001),提示兩者在DPN發生中可能存在協同作用。HOMA?islet(CP)指數在DPN?組中較DPN+組中明顯升高(P<0.01),說明內源性胰島功能較差的患者發生DPN概率較大,可以解釋在臨床上應用胰島素治療DPN后,患者癥狀可出現明顯減輕的這一現象。
綜上,本研究通過檢測T2DM患者的Hcy、Cys?c水平,發現Hcy、Cys?c在DPN+組較DPN?組顯著升高,提示高水平的Hcy和Cys?c是DPN的重要危險因素,聯合測定Hcy及Cys?c可能會對DPN早期診斷具有重要意義。由于本研究是橫斷面研究,未對患者進行隨訪,且研究樣本量不夠大,未來我們會通過隨機對照研究對兩項指標對DPN的預測價值進行深入研究。
參考文獻
[1] 守華,胡祥,盛夏,等.昌市夷陵區農村2型糖尿病患者糖尿病周圍神經病變患病狀況及相關因素的研究[J].中國糖尿病雜志,2013,1(6):502?504.
[2] ZIEGLER D,BUEHHOLZ S,SOHR C,et al.Oxidative stress predicts progression of peripheral and cardiacautonomic nerve dysfunction over 6 years in diabetic patients[J].Acta Diabetol,2015,52(1):65?72.
[3] 劉宋芳,王述進,左紅,等.2型糖尿病患者同型半胱氨酸與大血管病變的關系[J].中國循環雜志,2015,30(2):130?132.
[4] REAL J T,FOLGADO J,MOLINA M,et al.Plasma homocyste?ine,Lp(a),and oxidative stress markers in peripheral macroan?giopathy in patients with type 2 diabetes mellitus[J].Clin Inves?tig Arterioscler,2016,28(4):188?194.
[5] EIBOGHDADY N A,BADR G A.Evaluation of oxidative stress markers and vascular risk factors in patients with diabetic periph?eral neuropathy[J].Cell Biochem Funct,2012,30(4):328?334.
[6] CHRISTINE P J,AUCHINCLOSS A H,BERTONI A G,et al.Longitudinal Associa—tions Between Neighborhood Physical and Social Environments and Incident— Type 2 Diabetes Melli?tus:The Multi?Ethnic Study of Atherosclerosis(MESA)[J].JA?MA Intem Med,2015,175(8):1311?1320.
[7] MAO S,XIANG W,HUANG S,et al.Association between ho?mocysteine status and the risk of nephropathy in type 2 diabetes mellitus[J].Clin Chim Acta,2014,431:206?210.
[8] 李霞,周智廣,亓海英,等.用空腹C肽代替胰島素改良Homa公式評價胰島素抵抗和胰島β細胞功能[J].中南大學學報:醫學版,2004,29(4):419?423.
[9] BRUCE S G,YOUNG T K.Prevalence and risk factors for neu?ropathyin a Canadan First Nation community[J].Diabetes Care,2008,31(9):1837?1841.
[10] 白然,王亞軍,楊郁,等.血漿同型半胱氯酸水平與2犁糖尿病胃腸神經病變的關系[J].中國糖尿病雜志,2011,19(4):274?277.
[11] 施曉紅,陳英輝,周連華.高同型半胱氨酸血癥與糖尿病周圍神經病變的關系[J].中國糖尿病雜志,2008,16(6):331?333.
[12] 李劍波,成玉澤,石敏,等.血漿同型半胱氨酸與2型糖尿病外周神經病變的相關性[J].中華內科雜志,2011,50(1):14?17.
[13] 王宏利,樊東升,洪天配,等.血清同型半胱氯酸水平與2型糖尿病周圍神經病變的關系[J].中國糖尿病雜志,2007,15(5):299?302.
[14] PAN Y,JIAN S,QIU D,et al.Comparing the GFR estimation equations using both creatinine and cystatin c to predict the long?term renal outcome in type 2 diabetic nephropathy patients[J].J Diabetes Complications,2016 ,30(8):1478?1487.
[15] 黃贊鴻,張惜鈴,陳義杰,等.聯合檢測Cys?c、Hcy和 RBP在糖尿病腎病早期診斷中的意義[J].實用醫學雜志,2017,33(2):292?295.

