蒲公英甾醇對氧化損傷心肌細胞保護作用研究*
王娓娓,張紅苗,王 琳,鮑天昊,3△
(1.昆明醫科大學第二附屬醫院心內科三病區,昆明 650101;2.昆明醫科大學第二附屬醫院肝膽科,昆明 650101;3.云南省精神病醫院老年科,昆明 650224)
缺血的心肌發生再灌注后,心肌的功能障礙和結構損傷不能立即恢復反而加重的現象稱心肌缺血-再灌注損傷(myocardial ischemia-reperfusion injury,MIR)[1]。心肌細胞氧化應激損傷是MIR血運重建后的主要病理生理特征,因此保護損傷的心肌細胞,使其增加抵抗氧化損傷的能力對MIR治療有著重要的意義[2]。然而,目前卻缺少有效防止MIR所致心肌細胞氧化應激損傷的方法。蒲公英甾醇為蒲公英根中三萜類活性成分,已有報道蒲公英甾醇具有抗腫瘤,抗炎,抗氧化等多種藥理學作用[3],但對MIR的保護作用未完全清楚。本文就蒲公英甾醇對MIR發揮保護作用的部分機制進行研究,以期為心臟MIR損傷治療策略的制訂提供理論依據。
1 材料與方法
1.1材料 酶標儀(美國Molecular Devices公司,FlexStation 3),RT-PCR儀(美國Applied Biosystems公司,7300型),化學發光熒光成像系統(美國伯樂公司,ChemiDoc XRS)。小鼠心肌細胞(CSC)購自上海撫生實業有限公司。Dulbecco改良的Eagle培養基(DMEM)高糖培養基(批號11965092)、DMEM培養基(批號11966025)、青/鏈霉素(P/S,批號15070063)、L-谷氨酰胺的衍生物(Glut MAX,批號35050061)、0.05%胰酶-乙二胺四乙酸(Trypsin-EDTA,批號25300054)、胎牛血清(FBS,批號10099141)均購自美國Gibco公司。四甲基偶氮唑藍(MTT,批號M2128)、堿性纖維生長因子(bFGF,批號GF003AF)、磷酸化細胞外信號調節的蛋白激酶1/2(p-ERK1/2,批號05-797R)、總細胞外信號調節的蛋白激酶1/2(t-ERK1/2,批號06-182)購自美國Millipore公司。PCR逆轉錄試劑盒(批號639505)購自寶生物工程有限公司。SYBRGreenMaster(批號4309155)購自美國ABI公司。丙二醛(MDA,批號MAK085)、超氧化物歧化酶(SOD,批號19160)試劑盒購自美國Sigma公司。蒲公英甾醇購自成都瑞芬思生物科技有限公司(批號127-22-0,純度大于98%,每份20 mg)。甘油醛-3-磷酸脫氫酶(GAPDH),含半胱氨酸的天冬氨酸蛋白水解酶3(Caspase-3)及B淋巴細胞瘤-2(Bcl-2)基因引物由美國Invitrogen公司合成。GAPDH:F 5′-GCTTCGGCAGCACATATACTAAAAT-3′;R 5′-TTGGCTCCACCCTTCAAGTG-3′。Caspase-3:F 5′-ACCGATGTCGATGCAGCTAA-3′;R 5′-GGTGCGGTAGAGTAAGCATA-3′。Bcl-2:F 5′-GCTGGGGATGACTTCTCTCGT-3′;R 5′-TGTGGCCCAGGTATGCAC-3′。
1.2方法
1.2.1模型制作 CSC細胞以2×105/孔的細胞濃度接種于6孔板,24 h后使用PBS清洗細胞,然后將不含葡萄糖和血清的DMEM培養基加入6孔板,在37 ℃,5%CO2,1%O2培養箱中培養2 h,然后更換為含有10%胎牛血清(FBS)和高葡萄糖(4 500 mg/L)的DMEM培養基在正常細胞培養箱中培養6 h。正常對照組CSC細胞始終用含有10% FBS的高糖DMEM培養基在正常細胞培養箱中培養。蒲公英甾醇治療組于缺血-再灌注損傷(I/R)開始前6 h將蒲公英甾醇加入6孔板。實驗分組如下:正常對照組、I/R組、蒲公英治療組(蒲公英甾醇+I/R組)和陽性對照組(bFGF+I/R組)。蒲公英治療濃度分別為5、10、30 μmol/L。bFGF對細胞增殖具有明確的促進作用[4],在本研究中作為陽性對照,使用劑量為20 μg/L。
1.2.2MTT測定 CSC細胞以0.5×104/孔種于96孔板,每孔加入0.2 mL培養基并給予不同處理,體外培養48 h,加入5 mg/mL的MTT在37 ℃作用4 h,去除培養基,加入二甲基亞砜(DMSO) 150 μL/孔,室溫下孵育10 min,使用酶標儀450 nm測定吸光度。細胞活力=(吸光度/溶劑空白對照組吸光度)×100%。
1.2.3RT-PCR測定 用于實驗的細胞加入Trizol裂解液,提取總RNA。根據逆轉錄試劑盒說明書將總RNA逆轉為cDNA。cDNA加入引物建立擴增體系后按RT-PCR試劑盒說明書進行擴增。
1.2.4生化法測定SOD、MDA的表達 CSC細胞去除培養液,用PBS洗滌2遍,每孔加入0.1 mol/L的PBS和0.05 mmol/L的EDTA(pH 8.0) 1 mL,再加入1%的Triton-X 100 50 μL,孵育1 min,加入25%的磷酸(H3PO4)100 μL,4 ℃離心1 h,取上清液,按說明書測定MDA、SOD水平。
1.2.5Western blot分析 CSC細胞加入RIPA裂解液提取總蛋白并測定蛋白濃度,以40 ng蛋白濃度進行上樣。蛋白變性后在10%的分離膠上電泳。待溴酚藍剛跑出膠,停止電泳。進行轉膜、封閉后加入一抗p-ERK1/2(1∶2 000),t-ERK1/2(1∶1 000)在4 ℃孵育過夜,次日洗去一抗,加入二抗孵育1 h。洗去二抗,電化學發光(ECL)顯影。凝膠成像儀Image Lab拍照,Image J軟件檢測灰度值。
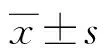
2 結 果
2.1CSC細胞活力 MTT測試發現,與正常對照組(0.651±0.085)比較,I/R組(0.418±0.059)細胞活力降低(P<0.05),bFGF+I/R組(1.023±0.062)細胞活力明顯增加(P<0.01)。各劑量蒲公英甾醇組細胞活力提高,其中30 μmol/L蒲公英甾醇(0.894±0.065)為最優選擇(P<0.05)。
2.2CSC細胞Caspase-3 mRNA及Bcl-2 mRNA 與正常對照組相比,I/R組Caspase-3 mRNA表達增加(P<0.01)。與I/R組比較,各劑量蒲公英甾醇治療均使CSC損傷模型Caspase-3 mRNA表達減少,10、30 μmol/L蒲公英甾醇組與I/R組比較差異有統計學意義(P<0.05)。與I/R組相比,bFGF+I/R組Caspase-3 mRNA表達減少(P<0.01)。與正常對照組相比,I/R組Bcl-2 mRNA表達減少(P<0.01)。與I/R組比較,各劑量蒲公英甾醇組Bcl-2 mRNA均表達回升,30 μmol/L蒲公英甾醇組與I/R組比較差異有統計學意義(P<0.05)。與I/R組相比,bFGF+I/R組Bcl-2 mRNA表達增加(P<0.05),見表1。

表1 各組CSC細胞Caspase-3 mRNA及 Bcl-2 mRNA比較
a:P<0.01,與正常對照組比較;b:P<0.01,c:P<0.05,與I/R組比較
2.3CSC細胞MDA及SOD變化 與正常對照組相比,I/R組MDA水平提高(P<0.01)。與I/R組比較,bFGF+I/R組MDA水平降低(P<0.01),各劑量蒲公英甾醇組MDA水平降低,其中10、30 μmol/L蒲公英甾醇組與I/R組比較差異有統計學意義(P<0.01)。與正常對照組相比,I/R組SOD水平降低(P<0.01)。與I/R組比較,bFGF+I/R組SOD水平增高(P<0.01),各劑量蒲公英甾醇組SOD水平增高,30 μmol/L蒲公英甾醇組與I/R組比較差異有統計學意義(P<0.05),見表2。

表2 各組CSC細胞MDA,SOD水平比較
a:P<0.01,與正常對照組比較;b:P<0.01,c:P<0.05,與I/R組比較

圖1 不同研究組CSC細胞中ERK1/2蛋白表達水平
2.4氧化損傷CSC細胞ERK1/2表達 與正常對照組(1.020±0.098)相比,I/R組(0.647±0.087)p-ERK1/2與t-ERK1/2比值降低。與I/R組比較,30 μmol/L蒲公英甾醇組(0.894±0.092)p-ERK1/2與t-ERK1/2比值增加,差異有統計學意義(P<0.05),見圖1。
3 討 論
蒲公英是一種無毒且具有多種活性的天然藥物,蒲公英甾醇是應用較為廣泛的蒲公英提取物。已有報道表明蒲公英甾醇在動物模型中發揮抗炎作用[5],可以通過調節Toll樣受體4(TLR4)表達抑制氧化損傷導致的肺組織炎癥[6], 蒲公英甾醇通過抑制血管細胞黏附分子1(VCAM-1)和分化集落因子80(CD80)的表達對H2O2損傷的人臍靜脈內皮細胞發揮抗凋亡等保護作用[7]。蒲公英甾醇通過調控ERK1/2和p38信號通路,抑制一氧化氮合酶(iNOS)和環氧合酶-2(COX-2)表達對脂多糖損傷的巨噬細胞發揮保護作用[8]。本研究發現蒲公英甾醇通過激活ERK1/2信號途徑對I/R的CSC細胞發揮保護作用。研究發現,I/R所致的氧化應激反應導致CSC細胞活力降低,凋亡基因Caspase-3 mRNA水平提高,抗凋亡基因Bcl-2 mRNA水平降低。蒲公英甾醇治療可以緩解I/R所致的CSC細胞氧化應激損傷,使細胞活力恢復,降低凋亡基因Caspase-3 mRNA水平,提高抗凋亡基因Bcl-2 mRNA水平。
I/R導致CSC細胞內氧自由基生成增多,脂質過氧化反應增強[9]。MDA是脂質過氧化反應的終末代謝產物,MDA水平可反應氧化損傷程度[10]。SOD能夠清除代謝過程中的清除氧自由基,是體內抗氧化系統的重要組成部分[11]。因此降低MDA水平,提高SOD水平在CSC細胞I/R的治療中具有積極意義[12]。本研究發現,I/R所致的氧化應激反應導致CSC細胞MDA水平提高,SOD水平降低,蒲公英甾醇治療降低MDA水平,提高SOD水平,可以緩解I/R所致的CSC細胞氧化應激損傷,對CSC細胞具有積極的保護作用。
ERK是第1個被確定識別并克隆的MAPK基因,目前研究較多的是ERK1和ERK2,ERK1/2主要與細胞的生長發育、增殖、凋亡、分化、遷移等生物學行為有關[13-14]。ERK進入細胞核激活AP-1、ELk-1、SAP等引起相應生物學效應[15]。本研究發現,缺血-再灌注損傷所致的氧化應激反應導致CSC細胞p-ERK1/2與t-ERK1/2比值降低,蒲公英甾醇治療使p-ERK1/2與t-ERK1/2比值增加,因此本研究認為蒲公英甾醇通過調控ERK1/2表達對I/R的CSC細胞發揮保護作用。
參考文獻
[1]WANG J,HU X,JIANG H.The Nrf-2/ARE-HO-1 axis:an important therapeutic approach for attenuating myocardial ischemia and reperfusion injury-induced cardiac remodeling[J].Int J Cardiol,2015,184(2):263-264.
[2]祝旭東,毛楠,郝麗英.雙酚A對大鼠心
肌缺血再灌注損傷影響的研究進展[J].實用藥物與臨床,2016,5(8):1026-1030.
[3]ZHANG X,XIONG H,LIU L.Effects of taraxasterol on inflammatory responses in lipopolysaccharide-induced RAW 264.7 macrophages[J].J Ethnopharmacol,2012,141(1):206-211.
[4]WANG W W,HAN J H,WANG L,et al.Scutellarin may alleviate cognitive deficits in a mouse model of hypoxia by promoting proliferation and neuronal differentiation of neural stem cells[J].Iran J Basic Med Sci,2017,20(3):272-279.
[5]WANG Y,LI G H,LIU X Y,et al.In vivo anti-inflammatory effects of taraxasterol against animal models[J].Afr J Tradit Complement Altern Med,2017,14(1):43-51.
[6]XUESHIBOJIE L,DUO Y,TIEJUN W.Taraxasterol inhibits cigarette smoke-induced lung inflammation by inhibiting reactive oxygen species-induced TLR4 trafficking to lipid rafts[J].Eur J Pharmacol,2016,11(3):301-307.
[7]YANG D,LIU X,LIU M et al.Protective effects of quercetin and taraxasterol against H2O2-induced human umbilical vein endothelial cell injury in vitro[J].Exp Ther Med,2015,10(4):1253-1260.
[8]XIONG H,CHENG Y,ZHANG X et al.Effects of taraxasterol on iNOS and COX-2 expression in LPS-induced RAW 264.7 macrophages[J].J Ethnopharmacol,2014,155(1):753-757.
[9]韓勇,賀滟,郭立榮,等.心肌缺血再灌注損傷大鼠中20-HETE對ROS生成及NADPH氧化酶活性的影響[J].現代醫藥衛生,2016,6(18):2781-2784.
[10]CERRETANI D,RIEZZO I,FIASCHI A I,et al.Cardiac oxidative stress determination and myocardial morphology after a single ecstasy (MDMA) administration in a rat model[J].Int J Legal Med,2008,122(6):461-469.
[11]杜斌,陳煒,陳俊良,等.α-硫辛酸對百草枯中毒大鼠胸腺Bax、Bcl-2表達及SOD活力、MDA水平的影響[J].中國醫院藥學雜志,2015,10(23):2071-2074.
[12]康天濟,韓宇博,田苗,等.苓桂術甘湯對心肌缺血再灌注損傷SOD、MDA含量的影響[J].中醫藥信息,2014,5(3):53-55.
[13]CARGNELLO M,ROUX P P.Activation and function of the MAPKs and their substrates,the MAPK-activated protein kinases[J].Microbiol Mol Biol Rev,2011,75(1):50-83.
[14]劉慧,盧少平,尚福軍,等.辛伐他汀對結締組織生長因子誘導大鼠心肌細胞肥大的影響及其與ERK1/2的關系[J].山西醫科大學學報,2016,5(6):489-492.
[15]RAPP UR,G?TZ R,ALBERT S.BuCy RAFs drive cells into MEK addiction[J].Cancer Cell,2006,9(1):9-12.

