miR-155-5p慢病毒載體的構建及其對正常胃上皮增殖的影響
宋 樂,任海風,劉亞坤,姜 玉,趙榮榮,魏道嚴,汪思應
在我國,胃癌高發是疾病致死的主要原因之一。據2015年我國癌癥統計報告,癌癥發病達到429.2萬/年,死亡病例高達281.4萬[1]。胃癌的發生是環境與宿主基因等多種因素共同作用的結果[2]。慢性胃炎是胃癌形成最危險的因素。miRNA是宿主基因表觀遺傳學重要的調控因素。據報道miR-155是介導炎癥和腫瘤的重要橋梁之一,在白血病細胞和實體瘤中高表達[3]。但胃腫瘤中miR-155如何與宿主基因相互作用,需要進一步探討。
Kruppel 樣因子(kruppel-like factor,KLF)家族是含有代表性的三個C2H2鋅指樣轉錄區域的鋅指蛋白類轉錄因子,包括SP1樣和KLF樣家族在內的25個家庭成員。KLF4又稱為胃腸富集KLF(GKLF),其基因位于人類9號染色體長臂第三區第一條帶,其通過鋅指結構結合富含GC堿基的DNA序列。前期研究[4-5]顯示胃癌中KLF4表達水平較正常組織明顯下降,其表達與患者預后呈反相關性,KLF4表達降低與胃癌的發生發展關系密切[6]。但KLF4在胃癌中表達異常的原因未見報道。該研究通過建立穩定過表達miR-155-5p的細胞株初步探索其對KLF4影響及其功能。
1 材料與方法
1.1細胞系HEK-293T細胞,人胚胎腎上皮細胞系,用含10%血清的DMEM培養基培養,由本單位病理生理學省級重點學科實驗室保存;胃黏膜上皮細胞株GES-1用含10%血清的F12培養基培養;AGS、GT-5、SGC-7901為胃腺癌細胞株,用含10%血清的DMEM培養基培養;以上細胞株均由西南醫院病理科饋贈。大腸桿菌菌株DH5α用于擴增慢病毒表達載體和載體質粒的輔助包裝,由本單位病理生理學省級重點學科實驗室保存。
1.2主要試劑DNA ladder、T4DNA連接酶(美國Thermo Scientific公司);Clone Express TMⅡ One Step Cloning Kit、DNA聚合酶(南京諾唯贊生物科技有限公司);去內毒素質粒抽提試劑盒(德國Qiagen公司);AgeI / NheI酶切(上海吉凱基因化學技術有限公司);miRNA引物(上海捷瑞生物工程有限公司);胰蛋白酶粉末(Tripsin)、Dulbecco's Modified Eagle Medium (DMEM)、Roswell Park Memorial Institute 1640 Medium 1×(1640) (美國Gibco公司);胎牛血清(廣州康源生物技術有限公司);嘌呤霉素(美國Sigma 公司)
1.3主要實驗方法
1.3.1miR-155過表達慢病毒載體系統
1.3.1.1miR-155過表達慢病毒載體系統組成 由GV369、pHelper 1.0以及pHelper 2.0 三個載體質粒構成。GV載體包含人類免疫缺陷型病毒的3′LTR和5′LTR等基本元件和其他元件。pHelper 1.0和pHelper 2.0質粒載體中也包含了包裝病毒所需的基因蛋白。見圖1。
1.3.1.2慢病毒載體構建和包裝 第一部分:miRNA過表達慢病毒克隆的制備。 ① 使用限制性內切酶獲得線性化的慢病毒載體;② 使用prime primer 5等引物設計軟件設計獲取目的片段的PCR擴增引物,擴增miRNA,獲得miR-155-5p片段;③ 加入線性化的病毒載體DNA(GV369 vector病毒載體)和純化后的PCR產物,在DNA連接酶的作用下將目的基因與病毒載體連接,獲得環形重組質粒;④ 轉化。反應產物與感受態細胞中混勻,置于冰上30 min;42 ℃熱激90 s,冰水浴2 min;加入500 μl 溶菌肉湯培養基,37 ℃振蕩培養1 h。取菌液涂板,挑取單克隆,PCR進行克隆鑒定。對陽性克隆進行測序,測序結果與miR-155目的序列進行結果比對,確保正確。抽提質粒從而獲得高純度的GV-369-hsa-miR-155-5p-mimic的慢病毒表達載體。第二部分:慢病毒包裝和質量檢測。以GV369(攜帶miR-155-5p mimic 序列)的工具載體質粒、病毒包裝質粒 Helper 1.0 和Helper 2.0 共轉到293T細胞中,轉染后48~72 h收獲細胞上清液(未純化的病毒液),經過濃縮與純化即離心、過濾、低溫高速離心2 h后棄上清液、加入病毒保存液得到高滴度的目的慢病毒液,最后進行病毒液滴度檢測。按照預期的病毒滴度鋪96孔板,通過梯度稀釋的方法將病毒液加入96孔板中,感染3 d后觀察熒光表達。病毒滴度的計算,如果在顯微鏡下看到2個熒光細胞,那么96孔板中應該至少有2個病毒顆粒感染了細胞,則病毒滴度為熒光細胞數/病毒原液量。
1.3.2穩定轉染細胞株的建立

圖1 質粒圖譜
1.3.2.1預實驗 ① 鋪板:接種2×104個目的細胞于24孔板中,設3個復孔,保證第2天進行病毒感染時細胞的融合度大約為30%;② 試劑稀釋:使用完全培養基稀釋polybrene (10 mg/ml),按1 ∶200稀釋至濃度為50 μg/ml,感染體系使用終濃度為5 μg/ml;使用ENi.S液稀釋病毒液至病毒滴度為1×108TU/ml;③ 設3個感染濃度,感染條件為復感染指數(multiplicity of infection,MOI)=10時,F12/DMEM培養基445 μl + polybrene (50 μg/ml)50 μl+慢病毒液(1×108)5 μl,500 μl培養體系;MOI=20時,F12/DMEM培養基440 μl+polybrene(50 μg/ml)50 μl+慢病毒液(1×108)10 μl,500 μl培養體系;MOI=50時:F12/DMEM培養基425 μl + polybrene (50 μg/ml) 50 μl + 慢病毒液(1×108) 25 μl,500 μl培養體系;混勻;④ 根據細胞狀態在感染后8~12 h內更換新鮮培養基;⑤ 感染2~3 d后,觀察熒光表達,判斷感染效果,確認最佳目的細胞感染條件。
1.3.2.2正式感染實驗 根據預實驗確定最佳感染條件。① 24孔板中接種GES-1細胞1.5×104/孔,MOI=10條件感染miR-155模擬物/陰性對照慢病毒液-hsa-miR-155 mimic/Negative Control病毒;② 8 h后在細胞狀態良好時更換新的培養液;③ 3 d后觀察綠色熒光表達;④ 藥物篩選與穩定細胞株的建立:通過設置不同的藥物濃度梯度得到嘌呤霉素對于這兩種細胞株的最低致死量,顯微鏡下觀察。本實驗篩選濃度為1 μg/ml。每隔3 d更換一次含有相應濃度嘌呤霉素的培養基。每周定期觀察細胞狀態和熒光強度,拍照記錄。待細胞克隆擴大,即獲得穩定表達目的基因的細胞株。
1.3.3qRT-PCR檢測miR-155表達 使用TRIzol提取GES-1細胞中總RNA。RNA提取后立即進行逆轉錄。逆轉錄和PCR反應試劑盒購自蘇州吉瑪基因股份有限公司(E22001-E22010),按照說明書操作。逆轉錄反應程序為:25 ℃、 30 min,42 ℃、30 min, 85 ℃、5 min,逆轉錄產物于-80 ℃可長期保存。羅氏G480儀器進行熒光定量PCR, PCR反應程序為:95 ℃、3 min, 95 ℃、30 s,40個循環定量PCR反應 ,62 ℃、40 s。以U6作為內參進行相對定量分析。實驗重復3次。
1.3.4Western blot檢測KLF4蛋白表達 抗KLF4抗體購自美國Abgent(AM2725A)公司;內參抗β-actin抗體購自美國Proteintech公司(6008-1-Ig)。蛋白提取全部在冰上操作。棄廢液,預冷的PBS沖洗3次,加入適量含蛋白酶抑制劑的裂解液,搖床上快速裂解30 min。4 ℃離心,取上清液, 5×loading buffer與上清液混勻使其稀釋至1×,即按4 ∶1的比例,99 ℃水浴10 min。電泳:10%蛋白分離膠電泳2 h;轉膜:200 mA 1 h;封閉:5%脫脂牛奶2 h;一抗孵育:過夜,抗體濃度按1 ∶1 000配制。第2天上午TBST洗膜4次,每次5 min,二抗-鼠抗室溫孵育1 h,TBST洗膜4次,每次5 min,凝膠成像儀顯影,實驗重復3次。

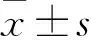
2 結果
2.1Hsa-miR-155-5p過表達慢病毒表達載體的構建
2.1.1擴增目的miRNA引物信息 其中ACCGGT是AGEI酶切位點,上游為配對堿基,下游為目的基因釣取序列。見表1。

表1 獲取目的片段引物信息
2.1.2GV369酶切 PCR電泳圖顯示載體成功的被酶切成線性載體(圖2A);經重組連接后轉化,轉化子 PCR鑒定電泳圖,說明重組載體構建成功(圖2B)。圖2C為重組慢病毒液不同滴度下明場視野和熒光視野圖,Negative control病毒滴度檢測為1E+9 TU/ml, miR-155-5p mimic病毒滴度檢測為5E+8 TU/ml。

圖2 Hsa-miR-155-5p過表達慢病毒載體的構建
2.2miR-155在不同細胞株中表達的測定通過qRT-PCR檢測了miR-155在GES-1和各胃癌細胞株中的表達。結果顯示,miR-155在胃黏膜上皮細胞株GES-1和惡性程度相對較低胃癌細胞株AGS中表達水平較低,在胃腺癌細胞株SGC-7901細胞中其表達較高,差異有統計學意義(t=-5.633,P<0.05),以下研究在正常的胃黏膜上皮GES-1細胞株中進行驗證。見圖3。

圖3 miR-155在惡性程度較高的胃癌細胞株中相對高表達
2.3穩定過表達miR-155-5p細胞株的建立為了下一步研究做準備,構建了穩定過表達miR-155-5p 及陰性對照的GES-1細胞株,見圖4,熒光倒置顯微鏡鏡下觀察視野,兩株細胞均有80%以上的感染效率。
2.4過表達miR-155-5p對KLF4表達的影響接著對miR-155-5p在胃癌中可能存在的功能作用進行了探索。通過Western blot檢測了過表達miR-155-5p后 KLF4 蛋白表達。結果顯示,GES-1細胞中,相較于對照組,過表達miR-155-5p抑制了KLF4蛋白表達,差異有統計學意義(F=5.702,P=0.041),見圖5。

圖4 穩定過表達miR-155-5p細胞株的建立×100
2.5過表達miR-155-5p對GES-1細胞增殖的影響MTT法檢測過表達miR-155-5p 對GES-1細胞增殖的影響。結果顯示:與Normal control組比較,隨著天數的增加,在GES-1細胞中過表達miR-155-5p后增殖較快,且在第2天和第3天較為明顯,差異有統計學意義(F=96.980、37.797,P<0.001);過表達miR-155促進了GES-1細胞增殖。見圖6。

圖5 過表達miR-155-5p抑制了KLF4蛋白表達水平

圖6 過表達miR-155-5p 促進了GES-1細胞增殖
3 討論
miRNA是一個片段短的、非編碼的小RNA分子,研究[7]顯示miRNA在生理學與病理生理條件下廣泛的參與到了多種靶基因的轉錄后水平的調控,在調控疾病發生和發展中扮演著十分重要的角色,對其已經進行了大量的研究和討論。目前研究在很多實體腫瘤中顯示miRNA 的異常表達或者miRNA基因突變,比如白血病、乳腺癌、胰腺癌、肺癌、結腸癌、肝癌等等。miR-155由B細胞誘導的淋巴瘤的禽白血病病毒整合的B細胞整合簇轉錄而來。miR-155-5p通過作用于不同的靶基因在癌癥當中發揮了不同的功能。一些研究[8]顯示miR-155-5p在正常細胞向腫瘤細胞轉化的過程中起到了重要的作用,骨髓中miR-155-5p的缺失造成了M2型巨噬細胞的集聚。miR-155-5p通過下調TP53INP1、DMTF1等抑癌基因的表達而發揮了一個癌基因的作用[9]。miR-155-5p通過靶向經典的癌基因c-myc等充當抑癌基因的角色也有報道[10]。miR-155-5p功能的多樣性使得很多學者對其產生了濃厚的興趣,但是也增加了研究的難度。
本研究對miR-155-5p在胃癌中的功能做了初步的探討。首先構建了過表達miR-155-5p基因的慢病毒表達載體(圖2),其感染效率高、毒性小,是常用的手段之一。PCR結果顯示GES-1和惡性程度相對較低的AGS細胞株中miR-155表達較低(圖3)。因此,通過慢病毒轉染的方式,建立了穩定過表達miR-155-5p的GES-1細胞株(圖4),這為以后研究miR-155功能的體內外實驗奠定了良好的基礎。KLF4是一個含有鋅指結構的轉錄因子,已經證實在胃腸道腫瘤中發揮著抑癌基因的作用。本研究通過生物信息學預測顯示KLF4 有可能是miR-155靶基因,因此本研究在蛋白水平上做了驗證,顯示miR-155能夠抑制KLF4蛋白表達(圖5),并且miR-155促進了胃黏膜上皮細胞GES-1和胃癌細胞AGS的增殖(圖6),這在一定程度上說明miR-155有可能在轉錄后翻譯的水平抑制KLF4表達,進而參與胃癌的發生發展。但是在胃癌中,miR-155功能還需要在體內外水平上進一步驗證。
胃癌的發展是一個從慢性胃炎、胃潰瘍、萎縮性胃炎、腸化生、異常增生到癌癥的一個發病過程,導致其發生的分子機制復雜。各種因素導致的慢性胃炎的持續發生是導致胃癌發生的最危險因素。在正常的胃黏膜上皮中,miRNA表達不同;在慢性胃炎、胃潰瘍、胃黏膜相關淋巴瘤等胃疾病中不同的miRNA 表達也有差異[11-12]。盡管miRNA的功能已經進行了很多的研究,但是在炎癥發生到胃癌形成的過程中,異常表達的miRNA在胃癌的發生發展中又發揮了怎樣的作用目前尚不清楚。報道[13]表明miR-155是調控免疫系統最重要的miRNA之一,其通過作用于不同的單個或者多個靶基因影響機體的免疫反應。miR-155靶向抑制κB-Ras1,從而增強了NF-κB的活性,最終造成了骨髓微環境中骨髓炎癥的持續發生,導致骨髓增生性疾病[14]。在慢性淋巴細胞性白血病的B細胞中miR-155尤其高表達,有望成為B細胞淋巴細胞增多癥惡性進程的生物標志[15]。目前,對miR-155在胃癌中的功能還知之甚少。了解miR-155在慢性胃炎至胃癌形成的過程中如何發揮其調控作用將會對胃癌發病機制研究提供有力的參考依據,同時這也是需要克服的難點。
參考文獻
[1] Chen W, Zheng R, Baade P D, et al. Cancer statistics in China, 2015[J]. CA Cancer J Clin,2016, 66(2): 115-32.
[2] Amieva M R, El-Omar E M. Host-bacterial interactions inHelicobacterpyloriinfection[J]. Gastroenterology,2008, 134(1): 306-23.
[3] Cui B, Chen L, Zhang S, et al. MicroRNA-155 influences B-cell receptor signaling and associates with aggressive disease in chronic lymphocytic leukemia[J]. Blood,2014, 124(4): 546-54.
[4] Wei D, Gong W, Kanai M, et al. Drastic down-regulation of Kruppel-like factor 4 expression is critical in human gastric cancer development and progression[J]. Cancer Res,2005, 65(7): 2746-54.
[5] Wei D, Kanai M, Huang S, et al. Emerging role of KLF4 in human gastrointestinal cancer[J]. Carcinogenesis,2006, 27(1): 23-31.
[6] Li Q, Jia Z, Wang L, et al. Disruption of Klf4 in villin-positive gastric progenitor cells promotes formation and progression of tumors of the antrum in mice[J]. Gastroenterology,2012, 142(3): 531-42.
[7] Lin Q, Ma L, Liu Z, et al. Targeting microRNAs: a new action mechanism of natural compounds[J]. Oncotarget,2017,8(9):15961-70.
[8] Fassi Fehri L, Koch M, Belogolova E, et al. Helicobacter pylori induces miR-155 in T cells in a cAMP-Foxp3-dependent manner[J]. PLoS One,2010, 5(3): e9500.
[9] Peng Y, Dong W, Lin T X, et al. MicroRNA-155 promotes bladder cancer growth by repressing the tumor suppressor DMTF1[J]. Oncotarget,2015, 6(18): 16043-58.
[10] Sun S, Sun P, Wang C,et al. Downregulation of microRNA-155 accelerates cell growth and invasion by targeting c-myc in human gastric carcinoma cells[J]. Oncol Rep,2014, 32(3): 951-6.
[11] Feng Y, Wang L, Zeng J, et al. FoxM1 is overexpressed inHelicobacterpylori-induced gastric carcinogenesis and is negatively regulated by miR-370[J]. Mol Cancer Res,2013, 11(8): 834-44.
[12] Teng G G, Wang W H, Dai Y,et al. Let-7b is involved in the inflammation and immune responses associated with Helicobacter pylori infection by targeting Toll-like receptor 4[J]. PLoS One,2013, 8(2): e56709.
[13] Gironella M, Seux M, Xie M J, et al. Tumor protein 53-induced nuclear protein 1 expression is repressed by miR-155, and its restoration inhibits pancreatic tumor development[J]. Proc Natl Acad Sci U S A,2007, 104(41): 16170-5.
[14] Wang L, Zhang H, Rodriguez S, et al. Notch-dependent repression of miR-155 in the bone marrow niche regulates hematopoiesis in an NF-kappaB-dependent manner[J]. Cell Stem Cell,2014, 15(1): 51-65.
[15] Ferrajoli A, Shanafelt T D, Ivan C, et al. Prognostic value of miR-155 in individuals with monoclonal B-cell lymphocytosis and patients with B chronic lymphocytic leukemia[J]. Blood,2013, 122(11): 1891-9.

