成人癲癇患者睡眠結構的多導睡眠圖研究
嚴金柱 莊小鵬 季曉林 林芳 吳美娜 王小勇 陳海泓 葉華 林細康
(1.福建省級機關醫院(福建衛生職業技術學院附屬醫院)神經內科,福州,350003; 2.福建醫科大學臨床技能教學中心,福州,350003)
應用包含16導腦電圖的視頻多導睡眠圖(Polysomno--graphy,PSG)對受檢查者的睡眠結構進行分析,可發現癲癇活動與睡眠間的相互關系。若多導睡眠監測時僅放置8導腦電圖導聯,癲癇波的發現率將會下降,本研究采取包含16導視頻腦電圖的PSG檢查,對癲癇患者的睡眠結構進行研究,探討癲癇活動和睡眠的相互關系。
1 資料與方法
1.1 一般資料 選取2013年3月至2017年8月期間在我院神經內科門診就診或病房住院的癲癇患者54例,年齡16~93歲,平均年齡(46.22±21.55)歲,病程2 d至30年,平均病程(4.91±6.70)年,其中局灶性起源患者42例(占77.8%),全面性起源患者12例(占22.2%);男35例(占64.8%),女19例(占35.2%)。部分癲癇患者除使用抗癲癇藥(Antiepileptic Drugs,AEDs)外,未使用(鎮靜促眠或興奮)的藥物。對照組:收錄無明顯中樞神經系統疾病的非癲癇患者58例,均未服用鎮靜催眠類等影響睡眠的藥物,年齡16~92歲,平均年齡(52.84±19.42)歲,其中男31例(占53.4%),女27例(占46.6%)。癲癇組和對照組年齡、性別、身高體重指數(Body Mass Index,BMI)經檢驗差異無統計學意義(P>0.05),具有可比性。
1.2 方法 對癲癇患者和對照組受檢者行全夜視頻PSG檢查,分別以性別、發作類型等進行分組,分析對比睡眠結構參數在癲癇組和對照組、男女性癲癇組、不同發作類型癲癇組間的特點,比較不同類型癲癇組在不同睡眠期IEDs分布的差異。
使用美國Rembrandt Embla公司生產的N7000 60導多導睡眠儀進行監測,包括腦電圖(16導)、眼電、肌電、胸腹式呼吸等,針對癲癇發作及睡眠行為異常,采用同步紅外線視頻錄像監測,人工分析睡眠期有無出現癲癇發作或發作間期癇樣放電。主要對睡眠期時間、總睡眠時間、總覺醒時間、入睡潛伏期、REM睡眠潛伏期、睡眠效率、各期睡眠占總睡眠時間的百分比、睡眠起始后清醒百分比(WASO%)、醒覺指數、睡眠周期次數、呼吸暫停/低通氣指數(Apnea-hypopnea Index,AHI)等進行分析。受檢查者需至少7 h的夜間視頻PSG監測,受檢者在檢查前1周禁用對睡眠有影響的藥物(癲癇患者使用AEDs除外)。
1.3 診斷標準與評定標準
1.3.1 癲癇的診斷標準與排除標準 癲癇診斷符合2017年國際抗癲癇聯盟(International League Against Epilepsy,ILAE)關于癲癇的診斷標準[1],并根據其關于癲癇分型的建議分為全面性起源和局灶性起源2組[2]。排除標準:1)年齡<16歲;2)近2周有嗜酒、飲咖啡等飲品和服對睡眠有影響的藥物(AEDs除外)者;3)有精神障礙、耳鼻喉科疾病、循環障礙等影響睡眠的疾病;4)檢查無法配合者。
1.3.2 PSG中睡眠分期標準 采用2016年美國睡眠醫學會(AASM)發表的《睡眠及其相關事件判讀手冊:規則、術語和技術規范》的判讀標準[3],將睡眠分為N1、N2、N3期睡眠和快速眼動期(REM)睡眠。癲癇活動:分為癲癇發作和發作間期癇樣放電(IEDs),癲癇波波型(典型癲癇波(包括尖波、棘波、棘、尖慢波綜合),慢波陣發,α高尖陣發),以上特點使用包含16導腦電圖的視頻多導睡眠監測儀來發現。

2 結果
2.1 癲癇組和對照組比較 2組夜間PSG睡眠結構參數的差異,由表1可看出,與對照組比較,癲癇組的WASO%、睡眠周期數降低(P<0.05),睡眠結構的其他各參數差異無統計學意義。
2.2 男女性癲癇患者比較 2組夜間PSG各參數的差異,由表2可看出,與女性癲癇組比較,男性癲癇組的BMI、總覺醒時間、WASO%、AHI增加,睡眠效率下降,N3%減少(P<0.05)。
2.3 局灶性起源癲癇組和全面性起源癲癇組比較 2組夜間PSG睡眠結構各參數的差異,由表3可看出,雖然與全面性起源癲癇組比較,局灶性起源癲癇組的年齡較大,夜間癲癇活動較活躍(P<0.05),而2組的睡眠結構參數差異無統計學意義。
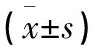
表1 癲癇組和對照組臨床資料、PSG睡眠結構參數比較
注:秩和檢驗,*P<0.05
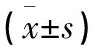
表2 男女性癲癇組臨床資料、PSG各參數比較
注:秩和檢驗,*P<0.05
2.4 夜間癲癇活動在睡眠期的分布 由有表4可見,癲癇組中視頻PSG監測發現36例患者存在癲癇活動(占62.9%,均出現IEDs),3例睡眠期存在癲癇發作,均為局灶性起源癲癇患者,其中在N1、N2期均發作的1例,在N1期發作有1例,在N2期發作有1例;IEDs在N1、N2、N3、REM睡眠期的分布為37.0%、40.7%、14.8%、7.4%(如表4所示),且多出現在N1、N2睡眠期;局灶性起源癲癇組和全面性起源癲癇組比較,2組在各睡眠期的IEDs分布差異無統計學意義(P<0.05)。見表5。
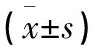
表3 局灶性起源癲癇組和全面性起源癲癇組臨床資料、PSG睡眠結構各參數比較
注:*t檢驗,△χ2檢驗,P<0.05

表4 夜間癲癇活動在睡眠期的分布[例(%)]

表5 不同類型癲癇組在不同睡眠期IEDs分布的比較[例(%)]
3 討論
癲癇和睡眠是相互影響的,癲癇活動程度受睡眠時相變化的影響,睡眠結構的紊亂也促進了癲癇復發[4];而頻繁的癲癇活動或持續存在的癲癇病因更容易促進睡眠結構的紊亂。本研究通過對54例臨床確診的成人癲癇患者和58例對照組行全夜PSG監測,分析癲癇患者的睡眠結構特點。
Zanzmera[5]等報道,睡眠結構紊亂在癲癇患者中較常見,本研究通過PSG監測發現:癲癇患者的WASO%、睡眠周期次數比對照組低(見表1)。李桂花[6]等通過對63例成人癲癇患者的夜間PSG檢查,發現癲癇患者存在N1%、N2%增多、WASO%增加、醒覺指數增加,而N3%、REM%減少、睡眠效率減低,REM潛伏期延長等特點。研究結果存在差異,可能與本研究中的以下幾個因素有關:年齡偏大、癲癇組男性占比例高、BMI偏高、以局灶性起源癲癇占比例較高、夜間癲癇活動的比例較高,服用抗癲癇藥不同等。對癲癇患者睡眠結構有影響的因素包括病因、癲癇活動頻繁程度、致癇灶的位置、發作分型等,癲癇活動可引起睡眠片段化、睡眠時相頻繁轉換,導致睡眠結構紊亂持續存在[7]。在我們的研究中發現男性患者的BMI比女性患者高,而阻塞性睡眠呼吸暫停綜合征(SAS)的病因常與上氣道狹窄、舌根后墜、中樞神經系統疾病等有關,在肥胖的男性中尤為常見,SAS患者可能存在上氣道解剖負荷增加、上氣道代償功能的紊亂、組織壓/血管容積增加、覺醒閾值降低等因素,可導致氣道塌陷,引起機體缺氧、CO2潴留,產生高碳酸血癥[8]。本研究中與女性癲癇組比較,男性癲癇組的總覺醒時間、WASO比例增加,睡眠效率下降,N3%減少,可能與男性患者的AHI高有關,SAS可引起癲癇患者的覺醒閾值降低、頻繁覺醒,進一步激活各種神經-體液系統,加重睡眠結構紊亂,從而出現睡眠效率下降,深睡眠比例減少,而且增加癲癇的再發[4]。
不同癲癇類型對睡眠結構的影響不同,目前已有局灶性起源癲癇對睡眠結構影響的報道,Crespel A[9]等報道,15例顳葉癲癇患者(與健康對照組比較)出現睡眠破碎,N1%、N2%增加,睡眠效率減少,頻繁覺醒;Parrino L[10]等報道,額葉癲癇患者(與對照組比較)出現WASO%、REM潛伏期、N3%增加,REM%減少。全面性起源癲癇對睡眠結構影響的報道相對較少,在未成年癲癇患者的研究方面,Barreto JR[11]等曾報道,部分性發作癲癇患者(與全面性發作癲癇患者比較)出現總睡眠時間、N2%增加,總覺醒時間、N1%減少;而本研究雖然與全面性起源癲癇組比較,局灶性起源癲癇組的年齡較大,夜間癲癇活動較多,但2組的睡眠結構參數差異無統計學意義,兩者研究結果差異,考慮可能與癲癇發作類型、性別比例、年齡等因素有關:Barreto JR研究的癲癇發作類型中全面性發作有10例(6女4男)、部分性發作有13例(6女7男),均為未成年癲癇患者;而本研究的癲癇發作類型中12例全面性起源的癲癇患者(2女10男)、42例局灶性起源癲癇患者(17女25男),均為成年癲癇患者。目前有關全面性起源癲癇對睡眠結構影響的研究較少,相關研究樣本量也少、結論不一致[12],有待于進一步深入的研究。
癲癇活動包括癲癇發作和IEDs,NREM睡眠對癲癇活動起易化作用,REM睡眠則起抑制作用。Nobili L[13]等報道,IEDs在全面性發作癲癇患者的N1、N2期睡眠期最多見,而較少出現于REM睡眠期;而Malow BA[14]等報道,IEDs多見于部分性發作癲癇患者的N3睡眠期。在本研究發現,36例癲癇活動患者(占62.9%,均存在IEDs),其中睡眠期癲癇發作有3例,均為局灶性起源癲癇患者,其中發作在N1睡眠期1例,發作在N2睡眠期1例,這兩睡眠期均發作有1例;IEDs在N1、N2、N3、REM睡眠期的分布分別為37.0%、40.7%、14.8%、7.4%(如表4,5所示),提示癲癇患者的IEDs主要發生在淺睡眠期;局灶性起源癲癇組和全面性起源癲癇組比較,2組在各睡眠期的IEDs分布差異無統計學意義,12例全面性起源患者僅有4例在夜間出現IEDs,多出現在淺睡眠期(N1+N2期占75%)(見表5),這與Nobili L報道的結果相似。42例局灶性起源癲癇患者IEDs主要發生在淺睡期(N1+N2期占78.3%),僅6.5%出現在REM睡眠期,3例局灶性起源癲癇患者癲癇發作都出現在N1、N2睡眠期(見表4,5)。NREM睡眠期時丘腦-皮質傳入沖動介導的大腦皮質呈彌散性同步化,引起致癇灶神經元興奮性增加,對癲癇活動起泛化作用,這在全面性發作和部分性發作繼發全面性發作中更明顯;而REM睡眠期時丘腦-皮質傳入沖動呈去同步化,引起通過胼胝體傳播的神經沖動減弱,對癲癇活動起抑制作用[15-16]。本研究中癲癇患者組和對照組的REM潛伏期差異雖然無統計學意義,但近期的研究中REM潛伏期長短對癲癇活動的影響,引起很多學者的關注,Miller[17]等研究發現REM潛伏期延長的局灶性起源癲癇患者,其第一次睡眠周期中N2睡眠期增加,N3睡眠期減少,夜間癲癇活動也增加,并認為REM潛伏期可能是癲癇患者睡眠結構紊亂的敏感指標。
總之,臨床醫師需關注患者夜間睡眠障礙主訴,對癲癇患者睡眠結構異常,可以進行包含16導視頻腦電圖的PSG檢查,能較為客觀的評估癲癇活動與睡眠之間的關系。
參考文獻
[1]SchefferIE,BerkovicS,CapovillaG,et al.ILAE classification of the epilepsies:Position paper of the ILAE Commission for Classification and Terminology[J].Epilepsia,2017,58(4):512-521.
[2]Fisher R S,Cross J H,French J A,et al.Operational classification of seizure types by the International League Against Epilepsy:Position Paper of the ILAE Commission for Classification and Terminology[J].Epilepsia,2017,58(4):522-530.
[3]Berry R B,Brooks R,Gamaldo C E,et al.The AASM manual for the scoring of sleep and associated events:rules,terminology and technical specifications VERSION 2.3[M].Westchester,Illinois:American Academy of Sleep Medicine,2016:16-61.
[4]Kataria L,Vaughn BV.Sleep and Epilepsy[J].Sleep Med Clin,2016,11(1):25-38.
[5]Zanzmera P,Shukla G,Gupta A,et al.markedly disturbed sleep in medically refractory compared to controlled epilepsy-a clinical and polysomnography study[J].Seizure,2012,21(7):487-490.
[6]李桂花,徐江濤,楊俊.成人原發性癲癇患者63例睡眠結構分析[J].癲癇與神經電生理學雜志,2010(6):354-356.
[7]Matos G,Andersen ML,do Valle AC,et al.The relationship between sleep and epilepsy:evidence from clinical trials and animal models[J].Journal of the neurological sciences,2010,295(1):1-7.
[8]趙忠新.睡眠醫學[M].北京:人民衛生出版社.2016.117-123.
[9]Crespel A,Coubes P,Baldy-Moulinier M.Sleep influence on seizures and epilepsy effects on sleep in partial frontal and temporal lobe epilepsies[J].Clin Neurophysiol,2000,111(Suppl 2):S54-59.
[10]Parrino L,De Paolis F,Milioli G,et al.Distinctive polysomnographic traits in nocturnal frontal lobe epilepsy[J].Epilepsia,2012,53(7):1178-1184.
[11]Barreto JRS,Fernandes RMF,Sakamoto AC.Correlation of sleep macrostructure parameters and idiopathic epilepsies[J].Arquivos de neuropsiquiatria,2002,60(2B):353-357.
[12]Derry CP,Duncan S.Sleep and epilepsy[J].Epilepsy & Behavior,2013,26(3):394-404.
[13]Nobili L,Giuseppina Baglietto M,Beelke M,et al.Temporal relationship of generalized epileptiform discharges to spindle frequency activity in childhood absence epilepsy[J].Clinical neurophysiology,2001,112(10):1912-1916.
[14]Malow BA,Lin X,Kuswaha R,et al.Interictal spiking increases with sleep depth in temporal lobe epilepsy[J].Epilepsia.1998,39(12):1309-1316.
[15]Minecan D,Natarajan A,Marzec M,et al.Relationship of epileptic seizures to sleep stage and sleep depth[J].Sleep,2002,25(8):899-904.
[16]Steriade M,Amzica F.Sleep oscillations developing into seizures in corticothalamic systems[J].Epilepsia,2003,44(Suppl 12):9-20.
[17]Miller LA,Ricci M,van Schalkwijk FJ,et al.Determining the relationship between sleep architecture,seizure variables and memory in patients with focal epilepsy[J].Behav Neurosci,2016,130(3):316-24.


