藍靛果酒發酵工藝優化及發酵過程對花色苷的影響
梁 敏,包怡紅*
(東北林業大學林學院,黑龍江 哈爾濱 150040)
藍靛果,又名羊奶子、黑瞎子果、山茄子果等,為忍冬科忍冬屬的多年生落葉小灌木,是藍靛果忍冬的變種,其品種較多,原產于俄羅斯東北部、中國、日本和加拿大[1]。在我國,藍靛果忍冬抗晚霜能力強,屬于耐寒植物,主要分布在東北、華北和西北的一些地區,特別在我國東北的大小興安嶺和長白山地區[2-3]。藍靛果是一種橢圓形的藍黑色小漿果,營養豐富,除含有多種維生素、有機酸、礦物元素外,還含有多種活性成分,特別是花色苷含量豐富。研究表明藍靛果花色苷具有抗氧化[4]、抗炎[1]、抗腫瘤[5]、降低膽固醇[6]、抑菌[7]等功效。由于藍靛果口味酸澀,不適合鮮食,多用以制作各種產品,如果醋、果酒、果醬等。但是研究發現花色苷性質不穩定,在產品加工過程中易受某些理化因素影響而發生降解或轉化,如光照、溫度、pH值、糖及其降解產物等[8],因此,研究加工過程對花色苷含量及組成的影響具有很大的意義。
果酒是以新鮮水果為原料,經過破碎、發酵或者浸泡等工藝而制成的含有一定酒精度數的營養保健型酒[9-10]。一般來說,根據釀造方法和成品特點的不同,將果酒分為4 大類,即發酵酒、蒸餾酒、配制酒和氣泡酒[11]。杜恣閑等[11]的研究表明,發酵釀造的果酒不僅保留了原果的主要維生素、大部分的氨基酸和礦物元素,還產生了有利于人體生長發育所需的各種醇類物質和微生物次級代謝產物。目前,已經報道了各種果酒的工藝研究,如藍莓果酒、樹莓果酒、桑葚果酒、藍靛果酒等。但是,關于發酵對果酒花色苷含量及組成的變化的研究還鮮有報道。本實驗以藍靛果為原料,研究了發酵菌株、糖種類、接種量、起始pH值、發酵溫度對藍靛果酒理化性質及花色苷含量的影響,采用正交試驗對發酵工藝進行優化,并利用高效液相色譜-串聯質譜研究發酵前后花色苷組成及各組成所占比例的變化。
1 材料與方法
1.1 材料與試劑
藍靛果由黑河林業局提供;果膠酶(活力≥1 000 U/mg)上海源葉生物科技有限公司。
甲酸、甲醇(均為色譜純) 天津市福晨化學試劑廠;KCl、乙酸鈉、酒石酸鉀鈉等均為國產分析純。
1.2 儀器與設備
1290-6430高效液相色譜-串聯譜聯用儀 美國Agilent公司;PHS-3E雷磁pH計 上海儀電科學儀器股份有限公司;721可見光分光光度計 上海佑科儀器儀表有限公司;H/T20MM臺式高速離心機 湖南赫西儀器裝備有限公司;DH6000A電熱恒溫培養箱 天津市泰斯特儀器有限公司。
1.3 方法
1.3.1 藍靛果酒釀造工藝
藍靛果→清洗→與水1∶1打漿→酶解→調整成分→添加偏重亞硫酸鈉,室溫放置6~8 h→接種→發酵→二次加糖→發酵→倒灌過濾→后發酵→陳釀→調配→澄清→灌裝殺菌→成品
1.3.2 酶解工藝
向藍靛果漿中添加0.075%的果膠酶,在45 ℃酶解160 min,95 ℃滅酶5 min。
1.3.3 酵母的活化
將酵母與5%的糖水按質量比1∶10混合[12-13],于40 ℃水浴鍋內活化30 min。
1.3.4 發酵菌株的篩選
取滅酶后的藍靛果漿,用蔗糖調整初始糖度為20 °Bx,用10%的NaHCO3溶液調pH值為3.6,分別接入0.2%的安琪高活性釀酒酵母(以下簡稱酵母GA)和葡萄酒、果酒專用酵母SY(以下簡稱酵母SY),置于28 ℃恒溫箱內進行發酵,測定發酵前及1、2、3、4、5、6、7 d后殘糖、總酸和花色苷含量,在發酵結束時測定乙醇體積分數,并進行感官評價。每個處理重復3 次。
1.3.5 碳源種類的篩選
取藍靛果漿,分別添加葡萄糖、蔗糖、葡萄糖與蔗糖比為1∶1的混合糖,使果漿初始糖度達到20 °Bx,調節pH 3.6,加70 mg/L偏重亞硫酸鈉,放置過夜[14]。接入0.2%的酵母SY,置于28 ℃的恒溫箱內發酵。發酵7 d后測定發酵液中的殘糖、總酸、花色苷含量、乙醇體積分數,并進行感官評價,確定最佳糖種類。每個處理重復3 次。
1.3.6 加糖量的確定
果酒乙醇質量濃度一般為10~12 g/100 mL,若乙醇質量濃度過低則容易發生發酵變質,難以保存。本實驗初步擬定乙醇質量濃度為10 g/100 mL。葡萄糖發酵理論產酒率測定:C6H12O6→2C2H5OH+2CO2(分子質量180→92+88),理論產酒率為92/180×100%=51.11%,即1 g糖理論可產0.511 1 g乙醇,但實際發酵率一般在90%左右,即1 g糖實際僅可產生0.46 g乙醇[15]。藍靛果漿中含糖量較低,經測定藍靛果汁含糖量為3.31 g/100 mL,需額外加糖。加糖量計算如式(1)所示:

式中:X為需添加糖質量濃度/(g/100 mL);k為擬定發酵酒的乙醇質量濃度/(g/100 mL);m為藍靛果汁的含糖量/(g/100 mL);2.17為每產生1 g乙醇理論需糖量(經驗值1/0.46)。
1.3.7 發酵工藝的單因素試驗
1.3.7.1 接種量的影響
取藍靛果漿,調pH值為3.6,加入總加糖量50%的蔗糖(經計算每100 mL果漿中需加蔗糖總量為18.40 g),分別接入0.1%、0.2%、0.3%、0.4%、0.5%酵母SY,置于28 ℃的恒溫箱內發酵,經預實驗發現在第4天時發酵液內的總糖質量濃度下降至32 g/L,此時加入剩余總加糖量50%的蔗糖,繼續發酵,記錄發酵液的質量,根據二氧化碳失重法,待質量基本保持不變時結束發酵,測定發酵液中的殘糖、總酸、花色苷含量、乙醇體積分數,并進行感官評價。每個處理重復3 次,取平均值。
1.3.7.2 起始pH值的影響
調藍靛果漿起始pH值分別為2.9、3.2、3.5、3.8、4.1,加入總加糖量50%的蔗糖,接0.2%酵母菌,置于28 ℃的恒溫箱內發酵,在第4天時加入總加糖量50%的蔗糖,記錄發酵液質量,待質量基本保持不變時結束發酵,測定發酵液中的殘糖、總酸、花色苷含量、乙醇體積分數,并進行感官評價。每個處理重復3 次,取平均值。
1.3.7.3 發酵溫度的影響
將調好的藍靛果漿接種0.2%酵母后,分別置于20、23、26、29、32 ℃發酵,在第4天加入總加糖量50%的蔗糖,記錄發酵液質量,待質量基本保持不變時結束發酵,測定發酵液中的殘糖、總酸、花色苷含量、乙醇體積分數,并進行感官評價。每個處理重復3 次,取平均值。
1.3.8 正交試驗優化
在單因素試驗的基礎上,以酵母SY接種量(A)、起始pH值(B)、發酵溫度(C)為因素,以感官評分為指標,進行3因素3水平正交試驗,確定最佳發酵工藝。

表1 正交試驗因素及水平Table1 Factors and their levels used for orthogonal array design
1.3.9 指標測定
1.3.9.1 出汁率計算
出汁率計算如式(2)所示:

1.3.9.2 殘糖、總酸含量和乙醇體積分數測定
殘糖含量的測定:參照GB/T 15038—2006《葡萄酒、果酒通用分析方法》直接滴定法;總酸含量的測定:參照GB/T 12456—2008《食品中總酸的測定》酸堿滴定法,以酒石酸計;乙醇體積分數的測定:參照GB/T 15038—2006酒精計法。
1.3.9.3 花色苷含量測定
參照Denev等[16]的方法,采用pH值示差法。
1.3.9.4 感官評價
由10 位專業人士,參考葡萄酒、果酒通用分析中的品酒方法,根據表2感官評價標準進行評分。

表2 藍靛果酒感官評價標準Table 2 Criteria for sensory evaluation of Lonicera caerulea berry wine
1.3.9.5 花色苷組成的高效液相色譜-串聯質譜分析
測定樣品為發酵前經成分調整后的藍靛果汁及發酵后的藍靛果酒。樣品在6 000 r/min離心15 min,取上清液經0.45 μm的濾膜過濾,于-4 ℃保存備用。
色譜條件:色譜柱:UHPAQ C18(2.1 mm×50 mm,1.9 μm)。柱溫27 ℃,進樣體積5 μL。流動相:0.1%甲酸溶液(A)和甲醇(B),梯度洗脫條件:0 min,85% A;1~2 min,50% A;4~6 min,20% A;7 min,85% A。流速:0.30 mL/min。
質譜條件:采用正離子采集模式。掃描范圍m/z 400~1 000;毛細管溫度300 ℃;毛細管電壓4 kV;干燥氣壓力15 psi;流速11 L/min。
1.4 數據統計分析
應用Origin 8和Minitab 16進行數據處理及正交試驗優化,并采用SPSS 22進行顯著性差異分析,所有實驗重復3 次,表示為 ±s。
2 結果與分析
2.1 發酵菌株的確定

圖1 發酵過程中不同酵母對總酸和殘糖含量的影響Fig. 1 Effects of different yeasts on total acid and residual sugar concentration during fermentation process
總酸對于發酵類型產品的香味和風味具有決定性的影響,且其水平可用作保質期的指標[17]。由圖1可知,兩種酵母在殘糖和總酸含量方面具有相似的發酵特性。藍靛果汁發酵前的初始總酸質量濃度為(12.66±0.11)g/L,在發酵前3 d,總酸含量增加較快,4~7 d有所波動,但基本保持不變。發酵液中殘糖含量逐漸降低,在發酵前2 d時,殘糖含量下降迅速,在3~7 d時仍處于下降趨勢,但下降速度緩慢,在發酵7 d時,酵母GA和酵母SY的殘糖質量濃度分別為(7.69±0.17)g/L和(7.45±0.17)g/L。發酵液的總酸含量逐漸升高,這可能是由于在釀酒過程中,特別是在乙醇發酵開始時,甘油丙酮酸發酵途徑中產生了α-酮戊二酸和琥珀酸[18]。

圖2 發酵過程中不同酵母對花色苷含量的影響Fig. 2 Effects of different yeasts on anthocyanin concentration during fermentation process
如圖2所示,兩種酵母的發酵液中的花色苷含量隨著發酵時間的延長而呈現下降趨勢。這與Wang Lihua等[19]在桑葚酒發酵過程中的趨勢相似。在發酵第1天,花色苷含量迅速降低,在之后的2~7 d內花色苷含量下降速度減緩。在發酵7 d時,酵母SY和酵母GA發酵液中的花色苷質量濃度分別為(98.56±2.89)mg/L和(99.89±3.01)mg/L。發酵過程中花色苷降解且兩種發酵液中花色苷含量不同可能的原因有3 個:一是不同的酵母對花色苷的吸附作用不同,吸附能力與其自身的細胞壁結構和成分、帶電量、電量分配和可接觸面積有關;二是花色苷不穩定,在發酵過程中酵母釋放的次級代謝產物如丙酮酸、乙醛會與部分花色苷發生反應,轉變為一些大分子衍生物[17,20-21];三是酵母產生的酶也會使花色苷發生降解,導致其溶解性降低而沉淀下來[22-23]。
在發酵7 d時,酵母GA和酵母SY發酵液的乙醇體積分數分別為(9.3±0.2)%和(8.9±0.3)%,二者差異不顯著;感官評分分別為68.78±0.86和73.25±1.23,差異顯著(P<0.05)。可以看出由酵母SY釀得的藍靛果酒總酸含量較低,花色苷含量與酵母GA所得果酒差異不顯著,且香氣更濃,評分更高。因此,選擇酵母SY進行下一步研究。
2.2 碳源種類的確定
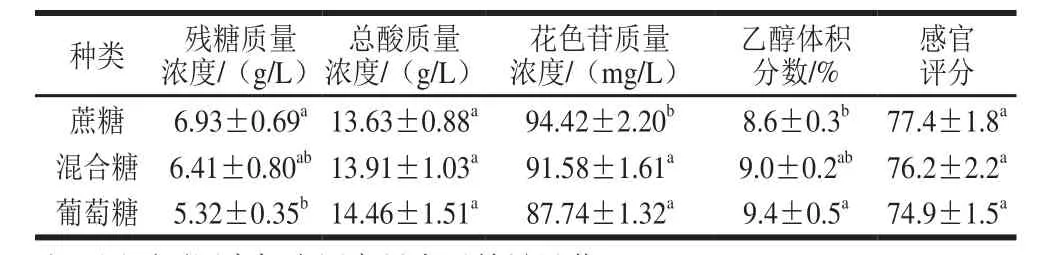
表3 不同糖對藍靛果酒指標的影響Table 3 Effects of different sugars on indices of L. caerulea berry wine
由表3可知,所使用的糖不同,所得到的藍靛果酒的各指標存在差異。酵母SY對葡萄糖的利用度更高,產生的乙醇更多。但是,發酵結束時采用蔗糖釀造的果酒中花色苷含量稍高于葡萄糖釀造的果酒,且生產的藍靛果酒的感官評分稍高于采用葡萄糖釀造的果酒,綜合考慮,選擇蔗糖進行下一步實驗。
2.3 發酵工藝單因素試驗結果
2.3.1 接種量的確定

圖3 接種量對藍靛果酒的影響Fig. 3 Effect of inoculum amount on quality attributes of L. caerulea berry wine
由圖3可知,隨著酵母SY接種量的增大,總酸含量和乙醇體積分數呈現先升高后降低的趨勢,殘糖逐漸降低,在接種量為0.2%時,乙醇體積分數達到最大9.3%,殘糖含量在此之后逐漸保持平緩。這是因為當酵母接種量偏低時,酵母繁殖速度緩慢,發酵周期延長,乙醇體積分數低,香氣不足;當接種量較大時,發酵液中的營養物質不能滿足酵母的快速生長繁殖代謝,且大部分的營養物質被用于酵母的生長繁殖使得乙醇體積分數低,香氣不足,此外,酵母菌的殘體還會導致果酒澄清度降低,感官和口感會嚴重下降[9,14],只有在酵母接種量適度時,才能產生乙醇體積分數高,酒體豐滿的果酒。
隨著接種量的增大,發酵液中花色苷含量在逐漸降低,酒體的顏色也逐漸變淺,這可能是因為酵母菌對花色苷具有吸附作用,酵母菌越多對花色苷的吸附量就越多。在接種量為0.1%和0.2%時,感官評分基本相同,之后隨酵母接種量升高,感官評分逐漸降低,綜合考慮,選擇0.1%、0.15%和0.20%進行后續的優化試驗。
2.3.2 起始pH值的確定

圖4 起始pH值對藍靛果酒的影響Fig. 4 Effects of initial pH on quality attributes of L. caerulea berry wine
由圖4可知,隨著發酵液起始pH值的升高,總酸含量逐漸降低,殘糖含量整體呈現降低趨勢,乙醇體積分數和感官評分先增加后降低,在起始pH值為3.2時,感官評分最高,在pH 3.8時,乙醇體積分數最高。隨著pH值的升高,發酵液中花色苷含量顯著降低,這是因為花色苷在較高pH值下性質不穩定。
由于發酵液pH值過低會抑制了酵母SY的生長,不利于果酒的發酵,且味道酸澀;pH值過高時不僅會阻礙酵母菌的生長繁殖,還會使發酵液中的花色苷降解加速,從而使得果酒的顏色變淡,影響藍靛果酒的感官品質。綜合考慮,在pH 3.2時,藍靛果酒的色澤、感官評分和乙醇體積分數都較高。
2.3.3 發酵溫度的確定
由圖5可以看出,不同發酵溫度釀造藍靛果酒的乙醇體積分數、總酸含量、殘糖含量、感官評分及花色苷含量差異較大。發酵溫度在20~24 ℃時,發酵溫度較低,釀酒酵母生長比較緩慢,藍靛果酒中殘糖含量較高而乙醇體積分數較低,若要發酵完成需要延長發酵時間;發酵溫度為26 ℃時,果酒的乙醇體積分數達到最大,發酵完全,且酒體飽滿;當發酵溫度大于26 ℃時,酵母細胞生長代謝迅速,易衰老,且在高溫條件下容易產生雜菌,不利于果酒風味物質的形成,且產生的乙醇體積分數較低,酒體不飽滿。此外,還可以發現隨著發酵溫度的升高,藍靛果酒花色苷含量逐漸降低,而花色苷含量會影響藍靛果酒的色澤,從而影響其感官品質。

圖5 發酵溫度對藍靛果酒的影響Fig. 5 Effects of fermentation temperature on quality attributes of L. caerulea berry wine
2.4 藍靛果酒發酵工藝正交試驗結果

表4 正交試驗設計與結果Table 4 Orthogonal array design with experimental results
感官品質是評價食物的重要指標,其包括食物的色澤、滋味、香氣等。由表4可以看出,影響藍靛果酒感官品質的因素依次為:起始pH值(B)>發酵溫度(C)>酵母接種量(A),其中起始pH值的影響最大,而接種量影響最小。最佳發酵工藝為A2B2C2,即接種量0.15%、起始pH 3.2、發酵溫度26 ℃。在此最佳發酵條件下發酵12 d,藍靛果酒乙醇體積分數為9.33%,感官評分為75.15,花色苷質量濃度為80.49 mg/L,為初始花色苷質量濃度(211.0 mg/L)的38.13%。
2.5 發酵對藍靛果花色苷組成的影響
經液相色譜柱洗脫后,采用質譜進行檢測,花色苷的總離子流色譜圖見圖6。采用高效液相色譜-串聯質譜分析藍靛果酒發酵前后花色苷組成一級質譜圖分別見圖7、8。

圖6 花色苷的總離子流色譜圖Fig. 6 Total ion current chromatogram of anthocyanins

圖7 發酵前花色苷組成一級質譜圖Fig. 7 Mass spectra of anthocyanins in juice

圖8 藍靛果酒花色苷組成一級質譜圖Fig. 8 Mass spectra of anthocyanin components of L. caerulea berry wine
由圖7、8可以看出,藍靛果發酵前后的樣品中均含有分子質量為433、449、463、491、609、611、625、737的花色苷,并通過對各母離子的二級質譜碎片離子進行分析,可以推斷出花色苷的種類,結果如表5所示。

表5 藍靛果酒發酵前后花色苷組成及對應的峰面積比例Table 5 Anthocyanin compositions and corresponding peak area ratios of L. caerulea berry juice and wine
由表5可以看出,藍靛果發酵前后的樣品中含有8 種花色苷,即矢車菊素-3-己糖苷衍生物、芍藥素-3,5-二己糖苷、矢車菊素-3,5-二己糖苷、芍藥素-3-蕓香苷、矢車菊素-3-乙酰基乙糖苷、芍藥素-3-葡萄糖苷、矢車菊素-3-葡萄糖苷和天竺葵素-3-葡萄糖苷。通過計算這8 種花色苷的總峰面積,可以發現發酵過程中這8 種花色苷的總峰面積降低了9 190 654,這可能是因為花色苷性質不穩定,在發酵過程中溫度[27-28]、pH值的變化[29]、添加的蔗糖及其代謝產物[30]等會使花色苷降解或生成較穩定的衍生物,且研究表明接入的酵母菌對花色苷具有一定的吸附作用[20-23]。在質譜掃描過程中未檢測到矢車菊素-3-己糖苷聚合物和矢車菊素-己糖苷聚合物。
此外,由表5可知,發酵后矢車菊素-3-己糖苷衍生物、芍藥素-3,5-二己糖苷、矢車菊素-3,5-二己糖苷、芍藥素-3-蕓香苷、矢車菊素-3-乙酰基乙糖苷、芍藥素-3-葡萄糖苷的峰面積所占比例均有所增加,而天竺葵素-3-葡萄糖苷和矢車菊素-3-葡萄糖苷的峰面積所占比例有所降低。可以看出二糖苷及花色苷的衍生物有所增加,而單糖苷花色苷含量降低,這可能是因為單糖苷的花色苷性質不穩定,在發酵過程中逐漸形成了更穩定的花色苷衍生物。研究表明,花色苷的穩定性與其結構存在很大關系,如花色苷糖苷配基的甲氧化程度增強可以使花色苷的穩定性增加[31],因此與矢車菊素-3-葡萄糖苷和天竺葵素-3-葡萄糖苷相比,芍藥素-3-葡萄糖苷更穩定,這與本實驗結果吻合。
3 結 論
以藍靛果為原料,選擇酵母SY作為發酵菌,蔗糖作為菌株的碳源,研究酵母接種量、起始pH值和發酵溫度對藍靛果酒理化性質及感官的影響,經單因素試驗和正交試驗優化,得到藍靛果酒發酵的最佳工藝為:接種量0.15%、起始pH 3.2、發酵溫度26 ℃。在此最佳發酵條件下發酵12 d時,所得藍靛果酒乙醇體積分數為9.33%,感官評分為75.15,此時,發酵液中保留的花色苷質量濃度為80.49 mg/L,占初始花色苷質量濃度(211.0 mg/L)的38.13%。
采用高效液相色譜-串聯質譜測定發酵對花色苷組成及各組成所占比例的影響,結果顯示發酵前后的樣品中均含有所測的8 種花色苷,但是,兩個樣品在質譜掃描過程中均未檢測到矢車菊素-3-己糖苷聚合物和矢車菊素-己糖苷聚合物。此外,可以看出發酵后的樣品中矢車菊素-3-二己糖苷、芍藥素-3,5-二己糖苷、矢車菊素-3,5-二己糖苷、芍藥素-3-蕓香苷、矢車菊素-3-乙酰基乙糖苷及芍藥素-3-葡萄糖苷所占峰面積均有所增加,而矢車菊素-3-葡萄糖苷和天竺葵素-3-葡萄糖苷所占峰面積降低,表明發酵過程中不穩定的花色苷逐漸轉變為較穩定的花色苷衍生物。
參考文獻:
[1]WU S S, HE X, WU X S, et al. Inhibitory effects of blue honeysuckle(Lonicera caerulea L) on adjuvant-induced arthritis in rats: crosstalk of anti-inflammatory and antioxidant effects[J]. Journal of Functional Foods, 2015, 17: 514-523. DOI:10.1016/j.jff.2015.06.007.
[2]呂聞明. 藍靛果忍冬酚類物質提取及抗氧化性研究[D]. 長春: 吉林大學, 2012: 9-10.
[3]趙桂紅. 藍靛果天然色素提取、精制條件及穩定性研究[D]. 哈爾濱: 東北農業大學, 2003: 21-25.
[4]RAUDSEPP P, ANTON D, ROASTO M, et al. The antioxidative and antimicrobial properties of the blue honeysuckle (Lonicera caerulea L.),siberian rhubarb (Rheum rhaponticum L.) and some other plants,compared to ascorbic acid and sodium nitrite[J]. Food Control, 2013,31(1): 129-135. DOI:10.1016/j.foodcont.2012.10.007.
[5]楊恩月, 金光, 金海英, 等. 藍靛果乙酸乙酯萃取物對小鼠S_(180)實體瘤的抑制作用[J]. 延邊大學醫學學報, 2005, 28(3): 19-21.DOI:10.16068/j.1000-1824.2005.03.005.
[6]王恩福, 包怡紅. 藍靛果提取物調節血脂功能特性的研究[J]. 食品與機械, 2010, 26(1): 81-82. DOI:10.13652/j.issn.1003-5788.2010.01.046.
[7]包怡紅, 于陽陽, 彭冬香, 等. 提取條件對藍靛果花色苷抑菌作用的影響[J]. 食品科技, 2011, 36(10): 178-182. DOI:10.13684/j.cnki.spkj.2011.10.030.
[8]WANG W, JUNG J, ZHAO Y. Chitosan-cellulose nanocrystal microencapsulation to improve encapsulation efficiency and stability of entrapped fruit anthocyanins[J]. Carbohydrate Polymers, 2017, 157:1246-1253. DOI:10.1016/j.carbpol.2016.11.005.
[9]黨翠紅. 低度海紅果酒釀造工藝研究[D]. 西安: 陜西科技大學,2015: 14-16.
[10]羅啟榮, 何文丹. 中國酒文化大觀[M]. 南寧: 廣西民族出版社, 2002:33.
[11]杜恣閑, 鄭建莉. 果酒的營養成分及其發展分析研究[J]. 江西化工,2011(2): 23-26. DOI:10.14127/j.cnki.jiangxihuagong.2011.02.062.
[12]何曉蒙. 南國梨多酚氧化酶性質及果酒的釀造研究[D]. 大連: 大連工業大學, 2016: 40.
[13]董華強, 鄧煜, 上官國蓮, 等. 楊桃果酒釀造工藝研究[J]. 食品科學,1999, 20(9): 44-46.
[14]王芳. 藍莓果酒釀造工藝及對其品質影響的研究[D]. 哈爾濱: 東北林業大學, 2015: 20-35.
[15]RANKINE B. 釀造優質葡萄酒[M]. 馬會勤, 譯. 北京: 中國農業大學出版社, 2008: 89-91.
[16]DENEV P, KEATCHANOVA M, CIZ M, et al. Biological activities of selected polyphenol-rich fruits related to immunity and gastrointestinal health[J]. Food Chemistry, 2014, 157: 37-44. DOI:10.1016/j.foodchem.2014.02.022.
[17]BERENGUER M, VEGARA S, BARRAJON E, et al. Physicochemical characterization of pomegranate wines fermented with three different Saccharomyces cerevisiae yeast strains[J]. Food Chemistry, 2016, 190:848-855. DOI:10.1016/j.foodchem.2015.06.027.
[18]RIBEREAU-GAYO P, DUBOURDIEU D, DONECHE B, et al.Handbook of enology, volume 1, the microbiology of wine and vinifications[M]. 2nd ed. John Wiley & Sons Ltd., 2006: 62-63.
[19]WANG L H, SUN X Y, LI F, et al. Dynamic changes in phenolic compounds, colour and antioxidant activity of mulberry wine during alcoholic fermentation[J]. Journal of Functional Foods, 2015, 18: 254-265. DOI:10.1016/j.jff.2015.07.013.
[20]MEDINA K, BOIDO E, DELLACASSA E, et al. Yeast interactions with anthocyanins during red wine fermentation[J]. Journal of Enology and Viticulture, 2005, 56: 104-109.
[21]CARRIDI A. New perspectives in safety and quality enhancement of wine through selection of yeasts based on the parietal adsorption activity[J]. International Journal of Food Microbiology, 2007,120(1/2): 167-172. DOI:10.1016/j.ijfood micro.2007.08.032.
[22]張曉松, 孫艷梅, 胡振生, 等. 都柿果酒在釀制過程中總酚和花色苷含量和抗氧化活性[J]. 東北農業大學學報, 2010, 14(3): 120-124.
[23]胡冀太, 杜金華, 何桂芬. 果酒酵母對發酵山楂酒品質及抗氧化性的影響[J]. 釀酒, 2012, 39(5): 52-56.
[24]MYJAVCOVá R, MARHOL P, K?EN V, et al. Analysis of anthocyanin pigments in Lonicera (caerulea) extracts using chromatographic fractionation followed by microcolumn liquid chromatography-mass spectrometry[J]. Journal of Chromatography A ,2010, 1217(51): 7932-7941. DOI:10.1016/j.chroma.2010.05.058.
[25]VEBERIC R, SLATNAR A, BIZJAK J, et al. Anthocyanin composition of different wild and cultivated berryspecies[J]. LWTFood Science and Technology, 2015, 60(1): 509-517. DOI:10.1016/j.lwt.2014.08.033.
[26]WANG Y H, ZHU J Y, MENG X J, et al. Comparison of polyphenol,anthocyanin and antioxidant capacity in four varieties of Lonicera caerulea berry extracts[J]. Food Chemistry, 2016, 197: 522-529.DOI:10.1016/j.foodchem.2015.11.006.
[27]李穎暢. 藍莓花色苷的提取純化及生理功能研究[D]. 沈陽: 沈陽農業大學, 2008.
[28]鄒波, 徐玉娟, 吳繼軍, 等. 貯藏溫度對藍莓汁單個花色苷降解的影響[J]. 現代食品科技, 2015, 31(12): 256-262; 276. DOI:10.13982/j.mfst.1673-9078.2015.12.038.
[29]凌文華, 國紅輝. 植物花色苷[M]. 北京: 科學出版社, 2009: 60-66.
[30]DARAVINGAS G, CAIN R F. Thermal degradation of black raspberry anthocyanin pigments in model systems[J]. Journal of Food Science, 1968, 33(2): 138-142.
[31]李穎暢. 植物花色苷[M]. 北京: 化學工業出版社, 2013: 130-143.

