表皮生長因子受體抑制劑致相關皮膚瘙癢的機制研究
彭艷梅,劉 青,鄧 博,崔慧娟*,段 樺,邱鈺芹(.北京中醫藥大學,北京 0009; .中日友好醫院,北京 0009)
表皮生長因子受體(epidermal growth factor receptor,EGFR)的過表達與許多惡性腫瘤的發生和發展有關,使其成為重要的抗腫瘤治療靶點。目前,表皮生長因子受體抑制劑(epidermal growth factor receptor inhibitors,EGFRIs)已廣泛用于肺癌、胰腺癌、乳腺癌、頭頸部腫瘤和腸癌的一線至三線治療。這類藥物皮膚不良反應的發生率為36%(粘膜炎)~ 80%(痤瘡樣皮疹)[1],導致了60%的患者減量,32%的患者停藥,因而影響靶向藥的療效[2]。其中,瘙癢總發生率約為50%,不同藥物發生情況有一定差別,厄洛替尼總發生率為13%,3/4級發生率< 1%[3],西妥昔單抗總發生率為11%,3/4級發生率< 1%[4],帕尼單抗總發生率為57%,3/4級發生率為2%[5]。皮膚瘙癢常常伴隨皮疹發生,也可因皮膚干燥而引起。盡管瘙癢極少導致靶向藥減量或停藥,但是它嚴重影響患者的生活質量[1]。一項應用靶向藥前6周的生活質量研究顯示,干燥和瘙癢是影響患者生活質量主要的因素[6]。EGFRIs相關皮膚瘙癢使患者心煩意亂,夜間的瘙癢會打亂睡眠周期,影響日間正常生活,常見的皮膚表現是抓痕后的水腫、丘疹、苔蘚樣硬化、滲出或結硬皮。目前對于瘙癢性疾病的發生認為存在中樞和外周的雙重機制調控,即瘙癢介質通過刺激C類神經纖維或通過與皮膚感覺神經纖維上的受體結合而介導瘙癢。P物質(substance P,SP)是引起皮膚瘙癢的一個重要神經介質,在靶向藥引起的皮膚瘙癢中起著關鍵作用。目前對于EGFRIs相關皮膚瘙癢的機制研究尚缺乏,本研究以此為基礎,旨在通過EGFRIs類藥物厄洛替尼與P物質致癢小鼠的對比性研究,對皮膚瘙癢的機制進行探索。
1 材料和方法
1.1 實驗動物
SPF級雄性ICR小鼠30只,5~6周齡,26~28 g,購于北京維通利華實驗動物公司[SCXK (京) 2012-0001]。飼養環境為中日友好醫院SPF級動物房[SYXK (京) 2016-0043]。無菌手術在中日友好醫院SPF級動物房內實驗操作室[SYXK (京) 2016-0043]進行。并按實驗動物使用的3R原則給予人道主義關懷。
1.2 主要試劑與儀器
厄洛替尼為上海羅氏公司產品;SP購于美國MedChemExpress公司(1 mg/支,純度98.07%,批號HY-P0201);NK-1R抗體購于北京博奧森生物技術有限公司;一氧化氮(NO)比色法試劑盒購于南京建成生物工程研究所;IL-31、IL-33 ELISA檢測試劑盒購于武漢優爾生科技股份有限公司;組胺、白三烯B4、SP ELISA檢測試劑盒購于上海藍基生物科技有限公司。采用多道微量加液器、(450±10) nm濾光片的酶標儀進行檢測。
1.3 實驗方法
1.3.1 厄洛替尼與P物質致癢小鼠
將30只雄性ICR小鼠按體重排序,根據隨機數字表隨機分成5組,每組6只,分別編號SP、A、B、C、D,每只單籠飼養,分別給藥:SP組藥物濃度為2.7 mg/mL,注射于小鼠頸背部,每只50 μL,注射前一天剔除頸背部皮膚,為注射做準備;A組予去離子水灌胃,每天一次;B組予厄洛替尼20 mg/kg灌胃,每天一次;C組予厄洛替尼100 mg/kg灌胃,每天一次;D組予厄洛替尼150 mg/kg灌胃,每天一次。
1.3.2 行為學觀察
小鼠瘙癢行為學表現為搔抓。小鼠搔抓行為觀察按照Kuraishi等的方法[7]。實驗前,小鼠分別放入觀察盒適應性活動,實驗開始后,保持室內安靜無人,動物房監控系統對小鼠進行監控錄像,實驗結束后,回放錄像進行搔抓行為觀察,由2名不參加實驗的工作人員記數。一次搔抓是指小鼠后爪對頸背部注射處及其鄰近部位的一次或連續多次搔抓,后爪落地或被舔吃時代表本次搔抓結束;前肢的活動以及后爪對面、耳、腹部等處的搔抓則不做統計。
厄洛替尼致癢小鼠[8]:厄洛替尼連續灌胃10 d,首次給藥前1 d剔除背部毛發,面積約1 cm2。若小鼠在給藥過程中出現搔抓,說明出現厄洛替尼所致瘙癢,每天對監測錄像進行回放,記錄小鼠每日的搔抓次數及持續時間。SP致癢小鼠[9]:實驗前1 d剔除頸背部毛發,注射藥物前將小鼠放人玻璃籠內適應環境1 h。對照組、實驗組分別在頸背部皮內注射100 nmol SP和等量的生理鹽水,于小鼠頸后部中央皮內注射后立即放回。在無人條件下用數碼攝像機拍攝小鼠搔抓行為1 h,回放錄像觀察小鼠后爪對注射部位的搔抓次數。
1.3.3 皮膚取材及病理切片
干預后于小鼠頸背部進行皮膚活檢,標本大小為5 mm × 5 mm。進行皮膚石蠟切片,并進行蘇木精-伊紅(hematoxylin-eosin,HE)染色,顯微鏡下觀察皮膚組織的表現。包括表皮、毛囊的改變及炎性細胞聚集情況。
1.3.4 免疫組織化學檢測
皮膚切片常規脫蠟至水,3%雙氧水甲醇液封閉阻斷內源性過氧化物酶,微波爐熱修復抗原,10%正常山羊血清封閉非特異性背景。傾去血清加入稀釋(1∶500)的第一抗體工作液(為兔抗鼠NK-1R抗體),4℃過夜孵化,PBS沖洗后滴加第二抗體(羊抗兔IgG)及SABC,最后滴加新鮮配制的AEC顯色液,光鏡觀察下顯色后沖洗,甘油明膠封片,光鏡下觀察。顯色陽性為胞內呈棕黃色顆粒狀沉積。
1.3.5 血清標本采集
干預10 d后留取心尖血1 mL,注入試管中,靜置5~10 min,離心(2000 r/min,10 min),吸取上層血清注入EP試管中,加蓋塞緊,-80℃保存。
1.3.6 比色法檢測
取出試劑盒分別加0.1 mL雙蒸水、100 μmol/L標準應用液、樣本于空白管、標準管和測定管中,加入試劑一、試劑二各0.2 mL,混勻,37℃準確水浴60 min后,分別加入試劑三、試劑四0.2 mL、0.1 mL,充分旋渦混勻30 s,室溫靜置10 min,3500~4000 r/min,離心10 min,取上清顯色。
采用測定波長為550 nm,應用可見光分光光度計(上海菁華科技有限公司)進行檢測血清NO含量。計算公式:NO含量=(測定OD值-對照OD值)/(標準OD值-空白OD值)×標準品濃度×稀釋倍數。
1.3.7 酶聯免疫吸附劑測定(ELISA)
取出試劑盒,于室溫放置30 min。取出酶標板,按照標準品的次序分別加入100 μL的標準品溶液于空白微孔中。在各孔中加入50 μL的酶標記溶液。將酶標板用封口膠密封后,37℃孵育反應1 h。酶標板洗滌后用吸水紙徹底拍干。各孔加入顯色劑A 50 μL。各孔加入顯色劑B 50 μL。室溫下避光反應10 min。各孔加入50 μL終止液,終止反應。酶標儀在450 nm波長測量各孔的光密度。
1.4 統計學方法
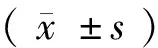
2 結果
2.1 兩組均表現瘙癢的搔抓行為
應用厄洛替尼致癢小鼠與SP致癢的小鼠模型進行對照,研究發現二組均表現為搔抓行為。厄洛替尼所致瘙癢表現在給藥2~5 d一過性瘙癢,每次搔抓3~4次,持續1~2 min,第4天達到高峰,第5天搔抓逐漸緩解;P物質所致瘙癢表現在給藥后1 h,以10 min為時間段,第一個10 min內搔抓最明顯,平均4.7 min開始出現搔抓,8 min達到高峰,后搔抓逐漸減少,至1 h基本完全緩解(如圖1所示)。

圖1 注射SP后1 h內搔抓情況Fig.1 Scratching behavior at one hour after substance P stimulation
2.2 厄洛替尼和P物質致癢皮膚病理
分別取頸、肩背、腰部皮膚組織,制作石蠟切片。HE染色后于光學顯微鏡下觀察顯示,對照組表現出正常的表皮和毛囊狀態,厄洛替尼組及SP組均表現為表皮和毛囊周圍中性粒細胞、淋巴細胞等炎性細胞的聚集,部分表現為表皮脫落、不全(如圖2所示)。
2.3 厄洛替尼和SP上調皮膚NK-1受體的表達
免疫組化顯示對照組小鼠皮膚,NK-1R表達為陰性;SP致癢小鼠皮膚,NK-1R表達陽性,主要分布在表皮、毛囊區域,棕黃色免疫復合物主要沉積在胞漿內;厄洛替尼瘙癢模型小鼠,皮膚NK-1R表達陽性,其分布情況與P物質致癢小鼠基本一致,以表皮和毛囊的分布最多(如圖3所示)。
2.4 厄洛替尼和SP均能調節血清中SP/NK-1受體下游相關因子的濃度
通過檢測SP組、不同劑量厄洛替尼組(其中低劑量組20 mg/kg,中劑量組100 mg/kg,高劑量組150 mg/kg)和空白對照組中的血清瘙癢相關神經傳遞介質。與對照組相比,厄洛替尼組:白三烯B4、NO無明顯差異(P> 0.05);IL-31、IL-33的血清濃度呈劑量依耐性,低劑量組濃度減少,中、高劑量組濃度增加(P< 0.05)。P物質在低劑量組的血清濃度增加(P< 0.05);組胺在低劑量組的血清濃度減少(P< 0.05),中、高劑量組與對照組相比差異有顯著性。P物質組:NO無明顯差異(P> 0.05);IL-31、IL-33的血清濃度減少(P< 0.05);白三烯B4的血清濃度增加(P< 0.05);組胺的血清濃度減少(P< 0.05)(如表1所示)。

注:A:對照組;B:厄洛替尼組;C:P物質組。圖2 各組小鼠皮膚組織病理切片變化(HE染色,× 200)Note.A: Control group; B: Erlotinib group; C: Substance P group.Fig.2 Pathological changes in skin tissue of mice from the control group, erlotinib group, and substance P group. HE staining

注:A:對照組;B:厄洛替尼組;C:P物質組。圖3 各組小鼠皮膚NK-1受體免疫組化變化(免疫組化染色,× 200)Note.A: Control group; B: Erlotinib group; C: Substance P group.Fig.3 Immunohistochemical changes in neurokinin 1 receptor in skin tissue of mice from the control group, erlotinib group, and substance P group. Immunohistochemical staining

表1 各組白介素-31、白介素-33、組胺、白三烯B4、一氧化氮、P物質濃度Tab.1 Concentration of interleukin-31, interleukin-33, histamine, leukotriene B4, nitric oxide, and substance P in each group
注:與對照組相比,ΔP< 0.05;與P物質組相比,*P< 0.05。
Note.Compared with the control group,ΔP< 0.05. Compared with the substance P group,*P< 0.05.
3 討論
EGFRIs致皮膚不良反應的機制已進行了大量的研究。Saveria等[10]闡明了應用EGFRIs后發生皮膚毒性的機制,應用EGFRIs皮膚細胞EGFR磷酸化受阻致下游信號通路異常,發生在角質細胞的炎癥反應,最終出現了皮膚不良反應,皮膚瘙癢是其中典型的表現之一。本課題組前期的動物實驗研究,已建立厄洛替尼引起的皮疹小鼠模型,驗證了皮膚病理過程是一種炎癥反應[11]。本研究中,致癢小鼠皮膚HE染色顯示表皮及毛囊周圍炎性細胞聚集,提示瘙癢可能也是在炎癥反應的基礎上發生的。
SP是引起皮膚瘙癢的一個重要神經介質,SP通過與神經激肽受體結合發揮作用,其中SP與NK-1R的親和力最大,SP激活后的瘙癢機制主要是NK-1R介導的[12]。Severini等[13]進一步闡釋了皮膚瘙癢發生的機理可能是厄洛替尼誘導角質細胞干細胞因子的分泌,隨后導致肥大細胞累積,肥大細胞活化后釋放介質(如組胺、白三烯B4、NO等)引起瘙癢,SP通過與NK-1R結合后是活化肥大細胞的主要介質。Gangemi等[14]研究EGFRIs相關皮疹瘙癢的血清標志物時發現,EGFRIs相關皮疹患者瘙癢的程度與IL-33、IL-31血漿水平呈正相關,提示EGFRIs可誘導IL-33、IL-31而誘發瘙癢,其致癢機制可能也有SP/NK-1R有關[15]。因此,阿瑞匹坦能通過阻斷NK-1R介導的肥大細胞脫粒而發揮止癢作用。Duval等[16]首次報道了應用阿瑞匹坦治療皮膚瘙癢的3例有效病例。2013年Tonini[17]通過單中心、前瞻性研究,探索性地評估了阿瑞匹坦治療EGFRIs類靶向藥引起難治性皮膚瘙癢的效果,療效顯著。阿瑞匹坦是一種口服的NK-1R抑制劑,通過阻斷NK-1R而起到止癢作用,提示EGFRIs相關皮膚瘙癢可能是由于SP/NK-1受體結合而誘導的。本研究正是基于這個假說進行的,以SP致癢小鼠為陽性對照[18],觀察厄洛替尼導致皮膚瘙癢后的行為學表現,通過檢測SP/NK-1R信號通路可能的下游因子的表達情況,以此來初步驗證假說。
本實驗通過厄洛替尼和SP激發小鼠瘙癢反應,兩者均出現了瘙癢行為,而二者表現有差異。厄洛替尼所致瘙癢表現為間斷性發作的瘙癢行為,發作的頻次和程度差別不大,此瘙癢模型是首次探索,有待進一步驗證。SP所致瘙癢發生在注射后8 min左右達高峰,后搔抓逐漸減少,與文獻報道一致[11]。二者的搔抓行為相似,考慮均為瘙癢相關的反應。但二者的表現形式有差別,可能與給藥途徑有關,SP致癢小鼠為局部皮內注射給藥,誘發皮膚瘙癢迅速;EGFRIs致癢小鼠為灌胃給藥,皮膚瘙癢與藥物應用的累積量有關,這與患者的表現一致。
皮膚NK-1R免疫組化顯示,厄洛替尼組和SP組小鼠表皮中NK-1R相比對照組均表達上調,免疫復合物沉積主要沉積在表皮和毛囊內,推測NK-1R的表達部位主要在表皮和毛囊,與皮膚反應病變的位置一致。提示NK-1R參與了二者的瘙抓行為,可能致癢的重要因素。致癢過程一方面可能是誘導一些激動劑的釋放,激發感覺神經元的活動引起瘙癢;另一方面可能是SP激活傳導癢覺的無髓C纖維上NK-1受體直接引起皮膚瘙癢[19-20]。
實驗用ELISA法檢測小鼠血清SP/NK-1R可能的下游瘙癢介質,結果顯示厄洛替尼組各因子的釋放,隨著給藥劑量的增加而增多,NO差異無顯著性。說明瘙癢可能與SP的表達以及下游的信號分子IL-31、IL-33、組胺、白三烯B4有關,但厄洛替尼組僅低濃度組與SP組在IL-31、IL-33、組胺、SP的水平具有一致性,提示可能二者的致癢過程中,下游信號分子相似。說明SP/NK-1R信號通路可能對厄洛替尼誘發的瘙癢行為有調控作用,但與靶向藥的劑量有關。此外,其他信號通路可能也對這些因子的表達具有調控作用。基于此,筆者推測EGFRIs相關皮膚瘙癢的機制可能有以下方面:①SP通過激活皮膚細胞上的NK-1R釋放激動劑,例如組胺等,激發感覺神經元的活動引起瘙癢;②IL-33、IL-31也可能對此通路有調控作用;③SP直接激活傳導癢覺神經纖維上NK-1R引起皮膚瘙癢[21]。
根據前期研究及本實驗結果,EGFRIs相關皮膚瘙癢可能的機制有SP激活角質形成細胞、肥大細胞等效應細胞表面的NK-1R,誘導瘙癢介質組胺、IL-31、IL-33等的合成和釋放,這些瘙癢介質作用于神經纖維而導致了瘙癢的發生和發展。鑒于角質形成細胞是表皮的主要成分,也是EGFRIs相關皮膚反應的主要效應細胞,推測角質形成細胞可能也是SP作用的主要靶細胞。然而,該實驗存在一定的局限性,一方面SP/NK-1R下游信號因子有待于進一步挖掘,另一方面不能排除各因子的表達與時間的相關性。本實驗為探索性研究,有待于更深入的研究驗證假說。
參考文獻:
[1] Lacouture ME, Anadkat MJ, Bensadoun RJ, et al. Clinical practice guidelines for the prevention and treatment of EGFR inhibitor-associated dermatologic toxicities [J]. Support Care Cancer, 2011, 19(8): 1079-1095.
[2] Boone SL, Rademaker A, Liu D, et al. Impact and management of skin toxicity associated with anti-epidermal growth factor receptor therapy: survey results [J]. Oncology, 2007, 72(3-4): 152-159.
[3] Tarceva Package Insert. (2005) OSI Pharmaceuticals, Inc. (Melville, NY). http://www.gene.com/gene/products/information/pdf/tarceva-prescribing.pdf. Accessed 8 December 2017.
[4] Erbitux Package Insert. (2006) ImClone Systems Incorporated and Bristol-Myers Squibb Company (Branchburg and Princeton, NJ). http://erbitux.com/erb/pdf/PI.pdf. Accessed 8 December 2017.
[5] Vectibix Package Insert. Amgen, Inc. Thousand Oaks, CA. U.S. Food and Drug Administration Website. https://www.accessdata.fda.gov/drugsatfda_docs/label/2009/125147s080lbl.pdf. Accessed 8 December 2017.
[6] Clabbers JMK, Boers-Doets CB, Gelderblom H, et al. Xerosis and pruritus as major EGFRI-associated adverse events [J]. Support Care Cancer, 2016, 24(2): 513-521.
[7] Kuraishi Y, Nagasawa T, Hayashi K, et al. Scratching behavior induced by pruritogenic but not algesiogenic agents in mice [J]. Eur J Pharmacol, 1995, 275(3): 229-233.
[8] Surguladze D, Deevi D, Claros N, et al. Tumor necrosis factor-α and interleukin-1 antagonists alleviate inflammatory skin changes associated with epidermal growth factor receptor antibody therapy in mice [J]. Cancer Res, 2009, 69(14): 5643-5647.
[9] Akasaka Y, Yoshida T, Tsukahara M, et al. Glycyrrhetinic acid prevents cutaneous scratching behavior in mice elicited by substance P or PAR-2 agonist [J]. Eur J Pharmacol, 2011, 670(1): 175-179.
[10] Saveria P, Daniela L, Giampiero G. Epidermal growth factor receptor signalling in keratinocyte biology: implications for skin toxicity of tyrosine kinase inhibitors [J]. Arch Toxicol, 2014, 88(6): 1189-1203.
[11] 宋亞中, 徐央波, 鄧博, 等. 厄洛替尼引起皮膚不良反應的小鼠模型建立 [J]. 中國比較醫學雜志, 2017, 27(1): 17-21.
[12] Munoz M, Covenas R. Involvement of substance P and the NK-1 receptor in human pathology [J]. Amino Acids, 2014, 46(7): 1727-1750.
[13] Severini C, Improta G, Falconieri-Erspamer G, et al. The tachykinin peptide family [J]. Pharmacol Rev, 2002, 54(2): 285-322.
[14] Gangemi S, Franchina T, Minciullo PL, et al. IL-33/IL-31 axis: a new pathological mechanism for EGFR tyrosine kinase inhibitors-associated skin toxicity? [J]. J Cell Biochem, 2013, 114(12): 2673-2676.
[15] Theoharis CT, Anastasia IP, Alexandra T, et al. Targeting IL-33 in autoimmunity and inflammation [J]. J Pharmacol Exp Ther, 2015, 354(1): 24-31.
[16] Duval A, Dubertret L. Aprepitant as an antipruritic agent? [J]. N Engl J Med, 2009, 361(14): 1415-1416.
[17] Tonini G. Aprepitant for management of severe pruritus related to biological cancer treatments: a pilot study [J]. Lancet Oncol, 2012, 13(10): 1020-1024.
[18] 沈非沉, 王暉, 薛漫清. 瘙癢動物模型的研究進展 [J]. 中國比較醫學雜志, 2007, 17(3): 182-186.
[19] Andoh T, Nagasawa T, Satoh M, et al. Substance P induction of itch-associated response mediated by cutaneous NKl tachykinin receptors in mice [J]. J Pharmacol Exp Ther, 1998, 286(3): 1140-1145.
[20] Carstens E, Akiyama T. Central mechanisms of itch [J]. Curr Probl Dermatol, 2016, 50: 11-17.
[21] Taracanova A, Alevizos M, Karagkouni A, et al. SP and IL-33 together markedly enhance TNF synthesis and secretion from human mast cells mediated by the interaction of their receptors [J]. Proc Natl Acad Sci U S A, 2017, 114(20): E4002-E4009.

